微生物法制备单唾液酸四己糖神经节苷脂的机制和方法
董惠钧,姜俊云
微生物法制备单唾液酸四己糖神经节苷脂的机制和方法
董惠钧,姜俊云
273400 山东省临沂,鲁南制药集团股份有限公司
单唾液酸四己糖神经节苷脂(GM1)是含有单个唾液酸的酸性鞘糖脂,被认为是除脑源性神经生长因子和层粘蛋白外,对神经系统损伤具有显著临床疗效的生物药物。GM1主要来源于哺乳动物含丰富神经的脑组织,经有机溶剂提取和柱层析分离精制获得。由于 GM1在脑组织神经节苷脂类物质中的含量非常少约为 32.9%[1],提取收率低,所以要经过多唾液酸神经节苷脂的转化作用生成单唾液酸四己糖神经节苷脂。目前转化方法主要是酸法转化,但是酸法转化的效率低,处理温度高以及处理量少,限制了其大规模应用。近年来,科研人员开发了一种利用酶促反应水解唾液酸糖苷键进行神经节苷脂转化的方法,该法具有转化效率高、转化条件温和、处理量大等优点。本文概括介绍了国内外在神经节苷脂、唾液酸酶和 GM1微生物酶法转化工艺研究等方面的研究进展,并展望了生物法制备 GM1的发展趋势。
1 神经节苷脂结构性质与功能
1.1 结构性质
神经节苷脂(ganglidosides,GLS)由一类含唾液酸的亲水寡糖通过 β-1, 1 糖苷键与疏水的神经酰胺连接而成的两性大分子(图1)。神经节苷脂由鞘氨醇、脂肪酸和含唾液酸的寡糖链三部分组成。神经节苷脂鞘氨醇为链长 18 或 20 个碳的多羟基脂肪胺;脂肪酸是通过亚氨基连结在神经鞘氨醇基上,主要是硬脂酸(18:0)占 95%,其他 5% 的脂肪酸有蛛网酸(20:0)、棕榈酸(16:0)或棕榈油酸(16:1)。脂肪酸和鞘氨醇组成神经酰胺(ceramide),是神经节苷脂结构中的疏水部分。神经节苷脂中的寡糖链主要为 D-葡萄糖(D-Glc)、D-半乳糖(D-Gal)、D-乙酰半乳糖胺(GalNAc)。寡糖链末端的唾液酸以乙酰化形式存在,称为 N-乙酰神经氨酸(NeuNAc,NANA)。寡糖链和唾液酸上的多羟基组成神经节苷脂的亲水部分[2-3]。因此,两性分子神经节苷脂是以微泡或聚合物形式溶于水。
1.2 生物学功能
神经节苷脂广泛存在于哺乳动物的组织和细胞膜上,其中在脑组织和神经组织中含量最高。作为膜抗原和病毒、细菌及毒素的受体,GLS 在细胞识别,细胞粘合,调节细胞免疫,决定血型等方面起着非常重要的作用[4-6]。神经节苷脂水解产生的神经酰胺(ceramide),是一种抑制性第二信使,参与多种细胞功能,具有调节细胞生长、变异、凋亡,调节蛋白分泌,参与免疫过程与炎症反应等功能[7]。其中含有一个唾液酸的 GLS 称为单唾液酸四己糖神经节苷脂,它能够通过血-脑脊液屏障,聚集受损脑区嵌入细胞膜,模仿内源性 GM1发挥作用,能够促进神经细胞生存、轴突生长和突触生长的神经重构,恢复由于各种原因引起的中枢神经系统损伤的功能,而且对损伤后继发性神经退化和脑水肿也有积极作用[8-11]。1996 年我国从阿根廷 TRB Pharma 公司引进了利用猪脑生产的 GM1注射液,商品名为 Sygen(施捷因),用于治疗颅脑损伤、神经退化、帕金森综合征等脑部疾病。
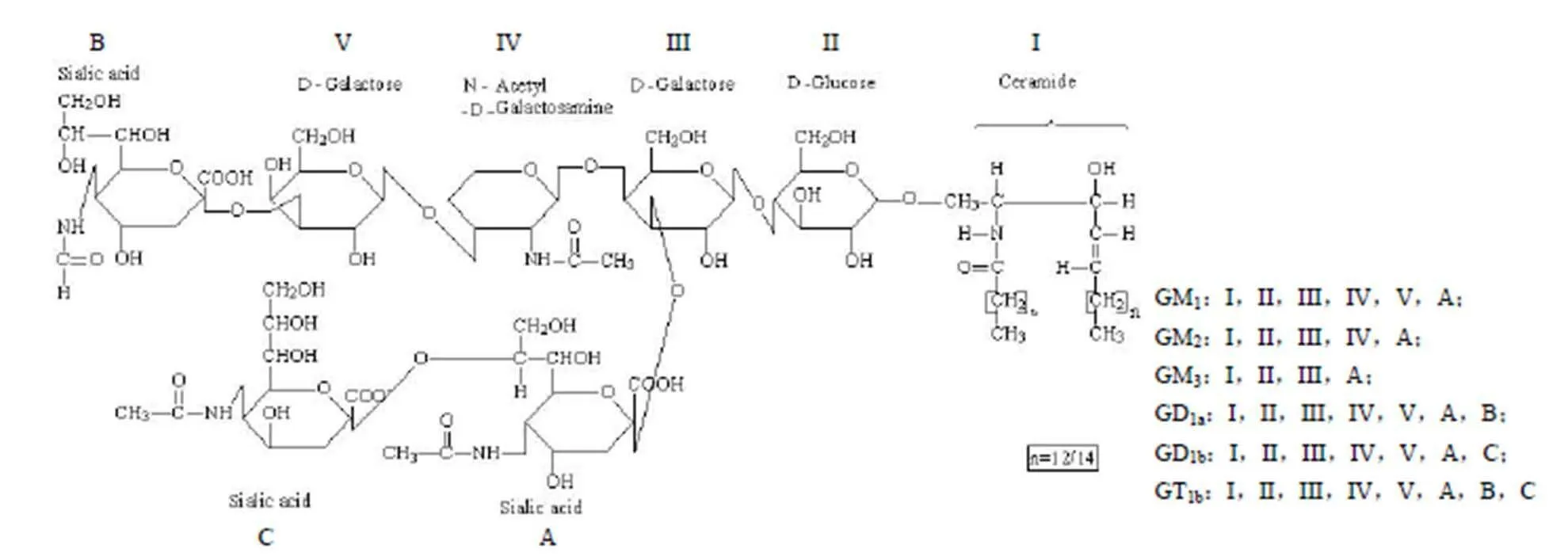
图 1 神经节苷脂结构[12]
国内齐鲁制药有限公司生产的相同规格的猪脑来源 GM1钠注射液(商品名:申捷)于 2004 年上市,获得了良好的临床应用效果。
2 唾液酸酶
2.1 唾液酸酶类型
唾液酸酶(sialidase)又称神经氨酸酶(neuraminidase),是水解酶系中的大家族,按水解方式可分为内切唾液酸酶(exo-α-sialidase,EC 3.2.1.18)和外切唾液酸酶(endo-α- sialidase,EC 3.2.1.129);按照来源可分为哺乳动物唾液酸酶(共有 Neu1、Neu2、Neu3、Neu4 4个类型)、细菌唾液酸酶和流感病毒唾液酸酶(N1 ~ N9 共 9 个亚型)。序列分析表明细菌唾液酸酶的大小从 40 到 115 kDa不等,唾液酸酶蛋白质序列中除了两处保守的模块 FRIP(Phe-Arg-Ile- Pro)和 Asp box(Ser/Thr-X-Asp-[X]-Gly-X-Thr-Trp/Phe)外,其余序列并不保守。由致病菌或病毒分泌的唾液酸酶是四个结构完全相同的单体亚基组合而成的四聚体,唾液酸酶基因由基因编码[13-15],因物种不同长度从 1 200 ~ 1500 bp不等。Roggentin 等[16]首次从中成功克隆了唾液酸酶基因,为研究唾液酸酶的结构和功能提供了便利。尽管微生物唾液酸酶的蛋白序列并不保守,但它们的空间结构具有保守的典型特征(图2),主要是 β 螺旋功能域、免疫球蛋白样模块和半乳糖结合功能域(卷曲构型)[17]。需特别指出的是唾液酸酶是流感病毒的抗原决定簇之一,随着病毒的不断复制和变异,唾液酸酶会发生氨基酸突变,形成不同的亚型,目前发现有 9 个亚型。目前已知共有 70 多个物种的基因组中含有唾液酸酶基因,编码 137 种不同类型的唾液酸酶,包括人、灵长类动物、海洋软体动物、原虫和各种微生物,其中非致病性普通微生物有糖多孢红霉菌()、灰色链霉菌()、谷氨酸棒杆菌()、阿维链霉菌()、烟曲霉()、禾谷镰孢菌()、树干毕赤酵母()、游海假交替单胞菌()、烟草节杆菌()等。有的土壤微生物绿色小单胞菌()分泌的唾液酸酶有两种形式,一种仅含有水解功能域,大小约为 42 kDa,另一种则含有水解功能域和半乳糖结合功能域,大小约为 68 kDa,前一种形式的唾液酸酶与流感病毒分泌的唾液酸酶相似,出现不同大小唾液酸酶是由不同的培养基中不同碳源诱导所致,但具体的诱导物和诱导机制还不清楚[18]。
2.2 唾液酸酶功能、性质和活性测定
在流感病毒或致病菌中,唾液酸酶能够将病毒颗粒表面含唾液酸的糖蛋白进行水解,使病毒颗粒脱离宿主细胞进行传播和扩散。而在一些非致病菌如土壤细菌中,唾液酸酶主要的功能则是水解唾液酸用作碳源或能源进行物质代谢[19]。唾液酸酶在弱酸性条件下(pH 5.0 ~ 5.5)活性最强,而且受多种无机离子的影响,其中卤素离子 Cl–和 Br–能够显著提高唾液酸酶活性[20],2 mmol/L 浓度的 Hg2+、Cu2+、Fe2+则会抑制唾液酸酶的活性[21]。唾液酸酶酶活定量测定有多种方法,基本原理是利用神经氨酸衍生物作为底物,经唾液酸酶酶解后释放衍生部分作为待测定物质,利用颜色反应或荧光检测来测定唾液酸酶活性,主要方法有 4-甲基伞形酮基法、溴吲哚基法和苯酮苷法[22-23]。Yao 等[24]则利用离子交换色谱和酸性茚三酮测定唾液酸酶活性。经典的硫巴比妥酸法(TBA)则是测定唾液酸酶水解唾液酸衍生物后的唾液酸含量来确定,NANA 被过碘酸钠氧化生成 β-醛基丙酮酸,继而与硫代巴比妥酸偶联生成红色化合物,该化合物在 549 nm 波长下有最大吸收[25]。
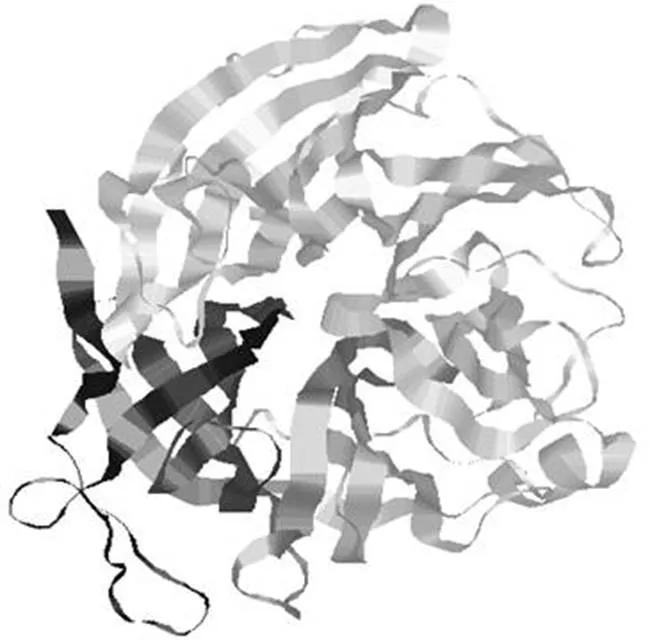
图 2 唾液酸酶蛋白结构
3 微生物酶法转化神经节苷脂
3.1 转化机制
从神经节苷脂的糖链结构上可以看出有三种水解酶可以破坏寡糖链,分别为神经节苷脂内切酶、外切半乳糖甘酶和唾液酸酶,但事实上只有唾液酸酶适用于水解神经节苷脂,而不破坏 GM1中唾液酸。唾液酸酶负责催化唾液酸与糖酯之间糖苷键中酮基的水解,唾液酸酶不同于神经节苷脂内切酶,后者水解切割神经酰胺与寡糖链间的糖苷键。微生物来源唾液酸酶能够水解 α-2, 3、α-2, 6 和 α-2, 8 糖苷键,但对 α-2, 3 糖苷键的水解活性高于 α-2, 6 和 α-2, 8 糖苷键,而且微生物唾液酸酶对于处于寡糖链非末端的 α-2, 3 糖苷键连接的唾液酸没有水解活性[26],利用这一特性可以将三唾液酸神经节苷脂和双唾液酸神经节苷脂水解成单唾液酸四己糖神经节苷脂,而 GM1则不会被脱去唾液酸(表1)。
3.2 应用
GLS 在动物脑组织中含量丰富,在脑灰质中含量较高,例如猪脑和牛脑,其中猪脑 GLS的总含量为猪全脑湿重的 0.0894%,高于牛脑的 0.0536%,而且牛脑提取物容易被病毒污染,所以猪脑是理想的 GM1来源。猪脑 GLS 的主要成分有 GM1、GM2、GD1a、GD1b和 GT1b[27]。目前其生产工艺大多采用溶剂萃取、酸法水解转化和柱层析等分离提取程序从脑组织中制备 GM1单体。该方法制备 GM1需要消耗大量有机溶剂,成本高,而且剩余大量的多唾液酸神经节苷脂无法应用,是一种很大的浪费。因此,利用微生物或唾液酸酶进行神经节苷脂转化能够提高神经节苷脂转化效率,提高 GM1的收率。目前国内外一些学者对微生物法转化神经节苷脂进行了研究,并成功应用于 GM1的规模化生产中,取得了良好效果。

表 1 唾液酸酶对不同神经节苷脂的水解位点和活性

表 2 酸法和微生物酶法转化神经节苷脂比较
华东理工大学王学东等[28-29]利用能够分泌唾液酸酶的乳酪短杆菌()进行神经节苷脂的微生物转化,考察了 pH、温度、转化体积、底物浓度对转化的影响。结果表明乳酪短杆菌能够分泌特异性水解末端 α-2, 3和 α-2, 8 糖苷键的唾液酸酶,可将神经节苷脂中的 GD 和 GT 组分有效地转化为 GM1,使粗脂中 GM1的含量从 9% 提高至 45%,而且该酶并不催化水解 GM1中的唾液酸。日本学者 Fukano 和 Ito[30]从海洋微生物中筛选到一株产唾液酸酶的菌株 YF-2,经鉴定为假单胞菌属()。YF-2 菌株分泌的唾液酸酶大小为 110 kDa,也具有神经节苷脂 GD1a、GD1b和 GT 的底物特异性,对 GM1没有水解活性。25 ℃条件下培养 YF-2 菌株 3 d 可将 80% ~ 90% 的神经节苷脂转化为 GM1。除了上述已经应用于神经节苷脂转化的微生物外,绿色小单胞菌也能够高效分泌唾液酸酶,重组绿色小单胞菌唾液酸酶蛋白产品已经用于临床免疫学检测。我们对绿色小单胞菌分泌唾液酸酶进行了研究,发现在没有聚唾液酸或神经氨酸诱导情况下,该菌也能够高效分泌唾液酸酶,而且具有与上述研究中微生物唾液酸酶相同的水解特性,下一步我们将用家蚕丝素凝胶固定化绿色小单胞菌制备成柱式填充床反应器对神经节苷脂进行转化,建立适合于工业化生产的 GM1微生物转化和制备工艺,旨在提高神经节苷脂转化效率并实现连续化生产。
相对于酸法转化,利用微生物和唾液酸酶转化法生产 GM1具有专一性高,反应条件温和等优点(表2),可以将多唾液酸神经节苷脂专一性地转化为 GM1,提取分离后未转化的多唾液酸神经节苷脂仍可用于下一批次的转化,经转化后的样品中几乎不含 GT 组分,仅含少量 GD 组分,转化效果明显优于酸转化法,并且减少了溶剂消耗。而且微生物培养和转化过程的成本低,能够显著提高生产效率,降低 GM1的生产成本。
4 结语与展望
尽管微生物酶法转化神经节苷脂生产 GM1已经能够成功应用于工业化生产,但是目前发现的能够分泌唾液酸酶的微生物培养复杂,生长周期长,唾液酸酶分泌能力有待提高,这些因素直接影响了转化神经节苷脂的效率。与酸法相比,微生物酶法转化神经节苷脂的主要缺点就是转化时间长。因此,可以考虑从以下几个方面提高转化效率:通过对现有菌株进行诱变处理,获得高唾液酸酶活性菌株,缩短转化时间;从分泌唾液酸酶的微生物中获取唾液酸酶编码基因,采用适当的高表达载体,在大肠杆菌或酵母菌中高效表达分泌型唾液酸酶,实现高效转化;将固定化细胞技术和转化分离耦合相结合,建立微生物转化神经节苷脂的连续生产系统,能够在一定时期内连续不断的将转化后的 GM1分离出来,从而提高转化效率。
[1] Shioiri Y, Kurimoto A, Ako T, et al. Energy-resolved structural details obtained from gangliosides. Anal Chem, 2009, 81(1):139-145.
[2] Kato T, Hatanaka K. Purification of gangliosides by liquid-liquid partition chromatography. J Lipid Res, 2008, 49(11):2474-2478.
[3] Sonnino S, Mauri L, Chigorno V, et al. Gangliosides as components of lipid membrane domains. Glycobiology, 2007, 17(1):1R-13R.
[4] Wei JS, Fujita M, Nakai M, et al. Protective role of endogenous gangliosides for lysosomal pathology in a cellular model of synucleinopathies. Am J Pathol, 2009, 174(5):1891-1909.
[5] Miyamoto K, Takada K, Furukawa K, et al. Roles of complex gangliosides in the development of experimental autoimmune encephalomyelitis. Glycobiology, 2008, 18(5):408-413.
[6] Yanagisawa K. Role of gangliosides in Alzheimer's disease. Biochi Biophys Acta, 2007, 1768(8):1943-1951.
[7] Berenson CS, Gallery MA, Smigiera JM, et al. The role of ceramide of human macrophage gangliosides in activation of human macrophages. J Leukoc Biol, 2002, 72(3):492-502.
[8] Qiao GF, Cheng ZF, Huo R, et al. GM1 ganglioside contributes to retain the neuronal conduction and neuronal excitability in visceral and baroreceptor afferents. J Neurochem, 2008, 106(4):1637-1645.
[9] Duan JG, Xiang T, Chen H, et al. Role of extrinsic ganglioside GM1 in proliferation and differentiation of neural stem cells. J Sichuan Univ (Med Sci Edi), 2007, 38(2):260-263. (in Chinese)
段建刚, 项涛, 陈红, 等. 外源性神经节苷脂对神经干细胞增殖、分化作用的初步研究. 四川大学学报(医学版), 2007, 38(2):260- 263.
[10] Fighera MR, Royes LF, Furian AF, et al. GM1 ganglioside prevents seizures, Na+,K+-ATPase activity inhibition and oxidative stress induced by glutaric acid and pentylenetetrazole. Neurobiol Dis, 2006, 22(3):611-623.
[11] Chen ZG, Lu YC, Zhu C, et al. Effects of ganglioside GM1 on reduction of brain edema and amelioration of cerebral metabolism after traumatic brain injury. Chin J Traumatol, 2003, 6(1):23-27.
[12] Ariga T, Yu RK, Suzuki M, et al. Characterization of GM1ganglioside by direct inlet chemical ionization mass spectrometry. J Lipid Res, 1982, 23(3):437-442.
[13] Newstead SL, Potter JA, Wilson JC, et al. The structure of Clostridium perfringens NanI sialidase and its catalytic intermediates. J Biol Chem, 2008, 283(14):9080-9088.
[14] Chavas LM, Tringali C, Fusi P, et al. Crystal structure of the human cytosolic sialidase Neu2. Evidence for the dynamic nature of substrate recognition. J Biol Chem, 2005, 280(1):469-475.
[15] Crennell SJ, Garman EF, Laver WG, et al. Crystal structure of a bacterial sialidase (from Salmonella typhimurium LT2) shows the same fold as an influenza virus neuraminidase. Proc Natl Acad SciU S A, 1993, 90(21):9852-9856.
[16] Roggentin P, Rothe B, Lottspeich F, et al. Clonging and sequencing of a Clostridium perfringens sialidase gene. FEBS Lett, 1988, 238(1):31-34.
[17] Gaskell A, Crennell S, Taylor G. The three domains of a bacterial sialidase: a beta-propeller, an immunoglobulin module and a galactose-binding jelly-roll. Structure, 1995, 3(11):1197-1205.
[18] Watson JN, Newstead S, Narine AA, et al. Two nucleophilic mutants of the Micromonospora viridifaciens sialidase operate with retention of configuration by two different mechanisms. Chembiochem, 2005, 6(11):1999-2004.
[19] Vimr ER, Kalivoda KA, Deszo EL, et al. Diversity of microbial sialic acid metabolism. Microbiol Mol Biol Rev, 2004, 68(1):132-153.
[20] Nagaoka M,Shiraishi T,Furuhata K, et al. Effects of inorganic anions on the activation of acid sialidases. Biol Pharm Bull, 2003, 26(3):295- 298.
[21] van Aswegen CH, Dirksen van Sckalckwyk JC, du Toit PJ, et al. The effect of calcium and magnesium ions on urinary urokinase and sialidase activity. Urol Res, 1992, 20(1):41-44.
[22] Watts AG, Oppezzo P, Withers SG, et al. Structural and kinetic analysis of two covalent sialosyl-enzyme intermediates on Trypanosoma rangeli sialidase. J Biol Chem, 2006, 281(7):4149-4155.
[23] Myers RW, Lee RT, Lee YC, et al. The synthesis of 4-methylumbelliferyl alpha-ketoside of N-acetylneuraminic acid and its use in a fluorometric assay for neuraminidase. Anal Biochem, 1980, 101(1):166-174.
[24] Yao K, Ubuka T, Masuoka N, et al. Assay of sialidase activity using ion-exchange chromatography and acidic ninhydrin reaction.J Chromatogr, 1992, 581(1):11-15.
[25] Jiang ZY, Woollard AC, Wolff SP. Lipid hydroperoxide measurement by oxidation of Fe2+ in the presence of xylenol orange. Comparison with the TBA assay and an iodometric method. Lipids, 1991, 26(10): 853-856.
[26] Tiralongo J, Pegg MS, von Itzstein M. Effect of substrate aglycon on enzyme mechanism in the reaction of sialidase from influenza virus. FEBS lett, 1995, 372(2/3):148-150.
[27] Hirabayashi Y, Nakao T, Irie F, et al. Structural characterization of a novel cholinergic neuron-specificganglioside in bovine brain. J Biol Chem, 1992, 267(18):12973-12978.
[28] Wang XD, Yin Z, Peng Y, et al. Highly efficient conversion of polysialoganglioside to GM1 with Brevibacterium casei as a microbial biocatalyst. Biocatal Biotransformation, 2005, 23(1):29-32.
[29] Peng YF, Wang XD, Wei DZ. Development of a large scaleprocess for the conversion of polysialogangliosides to monosialotetrahexosylganglioside with a novel strain of Brevibacterium casei producing sialidase. Biotechnol lett, 2007, 29(6):885-889.
[30] Fukano Y, Ito M. Preparation of GM1 ganglidoside with sialidase-producing marine bacteria as a microbial biocatalyst. Appl Environ Microbiol, 1997, 63(5):1861-1865.
董惠钧,Email:dhjjjy@gmail.com
2009-11-02
10.3969/cmba.j.issn.1673-713X.2010.02.012

