慢病毒靶向携带survivin-siRNA抗肺腺癌裸鼠体内研究
司磊,赵岐刚,刘朝阳,张伟
慢病毒靶向携带survivin-siRNA抗肺腺癌裸鼠体内研究
司磊,赵岐刚,刘朝阳,张伟
252000 山东,聊城市人民医院检验科(司磊、赵岐刚);100021 北京,中国医学科学院中国协和医科大学肿瘤研究所肿瘤医院检测中心(刘朝阳、张伟)
探讨慢病毒载体介导 survivin-siRNA 对人肺腺癌裸鼠移植瘤的体内抑瘤活性。
参考 siRNA 的设计策略,构建表达survivin-siRNA 的慢病毒载体;于各 BALB/C 裸鼠右侧腋窝皮下接种人肺腺癌 A549 细胞悬液,构建人肺腺癌A549 细胞裸鼠移植瘤模型,肿瘤组织局部注射 survivin-siRNA 的慢病毒载体,观察肿瘤的体积及随时间变化的生长曲线;通过碘化丙啶(propidium iodide,PI)染色检测细胞凋亡情况;流式细胞术检测肿瘤细胞周期变化。
慢病毒载体介导 survivin-siRNA 对裸鼠人肺腺癌 A549 的抑瘤率为 46.07%;经过 PI 和 Annexin-V 染色区分凋亡早晚期的细胞为30% ~ 35%,荧光显微镜下观察肿瘤细胞凋亡;G1 期细胞比例明显增加,S 期细胞比例则明显减少。
慢病毒载体介导的 siRNA 能有效抑制裸鼠移植人肺腺癌 A549 的 survivin 基因的表达,有效激发细胞凋亡。
RNA,小分子干扰; 遗传载体; 慢病毒属; 肿瘤,实验性; 生存素
RNAi 技术又称为转录后基因沉默,近年来国内外诸多研究人员就 RNAi 技术用于临床治疗方面给予了肯定[1-2],如果利用 RNAi 的基因沉默作用抑制体内原癌基因的激活,肿瘤的发生率就会降低,甚至可以永久地避免相关肿瘤的发生[3]。
生存素(survivin)在多数恶性肿瘤组织中表达丰富且与预后不良相关,正常成人组织不表达,这种选择性表达的特性受到瞩目[4],并已成为目前恶性肿瘤基因诊断和治疗的新靶点。survivin 是 caspase-3 和 caspase-7 的直接抑制剂,从而阻断凋亡过程。同时,survivin 通过细胞周期依赖性表达,可对抗 G2/M 期凋亡的诱导,其在肿瘤细胞中的过度表达可克服凋亡的关卡,通过有丝分裂促进转化细胞的异常增殖[5]。由于几乎所有人类肿瘤中都有survivin 表达,可拮抗由Fas、Bax、caspase-3、caspase-7 和抗癌药物诱导的细胞凋亡[6],从而促进细胞增生或影响抗癌药物的治疗效果。抑制肿瘤细胞增殖和诱导肿瘤细胞凋亡是肿瘤治疗的 2 个重要指标。设计和构建沉默靶基因的 siRNA 慢病毒表达载体,siRNA 重组质粒载体转染病毒包装细胞293T,产生的含有 siRNA 表达序列的慢病毒感染靶细胞发挥基因沉默的作用稳定而持久。本研究通过构建慢病毒载体并介导 RNAi 来沉默 survivin 基因在移植瘤裸鼠肺腺癌的体内表达,以探索其作为肿瘤靶向性治疗的可能性。
1 材料与方法
1.1 主要试剂和仪器
BALB/C 品系裸鼠,雄性,平均体重 17 ~ 18 g,SPF 级,由中国医学科学院实验动物研究所繁育提供,许可证号 SCXK(京)20050013。survivin-siRNA、慢病毒载体、DMEM 培养基及 293T 细胞株购自上海吉凯基因公司;碘化丙啶(PI)、PBS、Annexin-V、大肠杆菌 DH5α 由聊城市人民医院中心实验室提供;人肺腺癌 A549 细胞株由 Giard DJ 等建株[7],引自中国医学科学院肿瘤研究所。
1.2 方法
1.2.1 survivin-siRNA 慢病毒载体的构建 参考 siRNA 的设计策略,选择 survivin 基因 cDNA 序列上 1 个位点,利用 BLAST 确定序列特异性,设计并合成其 shRNA 的 DNA Oligo,退火形成双链 DNA,酶切、连接载体,转化大肠杆菌 DH5α 后进入 pGCL-GFP 表达质粒。混合 pGCL-GFP 载体 20 μg,pHelper1.0(gag/pol 元件)载体 15 μg,pHelper2.0(VSVG 元件)载体 10 μg,包装入 293T 细胞。实验分为空白载体组、空白对照组和 RNAi组为 survivin特异性 siRNA 表达载体。
1.2.2 人肺腺癌实体移植瘤裸鼠模型建立及裸鼠体内实验 于各 BALB/C 裸鼠右侧腋窝皮下接种人肺腺癌 A549 细胞悬液 8 × 106C/鼠,待肿瘤生长至长径 × 短径约 10 mm × 5 mm 时,将动物随机分为空白对照组、空白病毒载体组、surviving- RNAi 病毒载体组(RNAi 组),每组动物 6 ~ 8 只,裸鼠饲养在 SPF 级屏障系统内设 IVC 环境内,3 ~ 4 只动物于同一塑料盒中,给予 SPF 级动物专用料块,自由饮用蒸馏水。饲养室温度 20 ~5 ℃、日温差≤ 3 ℃,相对湿度 40% ~ 60%、光照12 h 明暗交替,空气洁净度为 100 级,氨浓度≤ 14 mg/m3,噪声≤ 60 分贝,工作照度为 150 ~ 300克斯(LX),动物照度为 100-200 LX。动物称体重标号后 3 组动物分别每鼠瘤内注射生理盐水、空白病毒载体、survivin-siRNA 慢病毒表达载体 50 μl 一次。于接种肿瘤后第 4 周末处死动物,完整剥取瘤块并称重,计算抑瘤率,实验结果进行统计学分析。

肿瘤体积测定()= 1/2[肿瘤长径()× 肿瘤短径()2][ 8-9]
1.2.3 凋亡细胞细胞核着色 通过PI 染色,在荧光显微镜 488 nm 激发光条件下检测凋亡细胞细胞核着色情况、拍照计数,并统计分析。
1.2.4 细胞凋亡情况及细胞周期分布的观察 采用常规胰酶消化、收集肿瘤组织细胞 1 × 106~ 5 × 106/ml 进行流式细胞仪检测、PI 染色,观察细胞凋亡情况及细胞周期分布。
1.3 统计学处理

2 结果
2.1 各组肿瘤生长曲线
survivin-siRNA 慢病毒载体瘤内注射,肿瘤移植接种时间共计 28 d,实验期间 3 组动物无死亡,实验前后动物体重无显著变化,RNAi 组抑瘤率为 46.07%。与空白对照组、空白病毒载体组比较差异极显著(< 0.01),空白病毒载体组与空白对照组比较无统计学意义(> 0.05)(表 1、2)。
2.2 细胞凋亡的检测
3 组凋亡细胞经过统计结果分析(每组 n > 8),可见 RNAi 组可以诱发 30% ~ 35%细胞凋亡,经过 PI 和 Annexin-V 染色可以将凋亡早晚期的细胞以及死细胞区分开,荧光显微镜下观察肿瘤细胞的凋亡(图1)。

表 1 survivin-siRNA 对裸鼠移植人肺腺癌 A549 细胞移植瘤的抑制效果
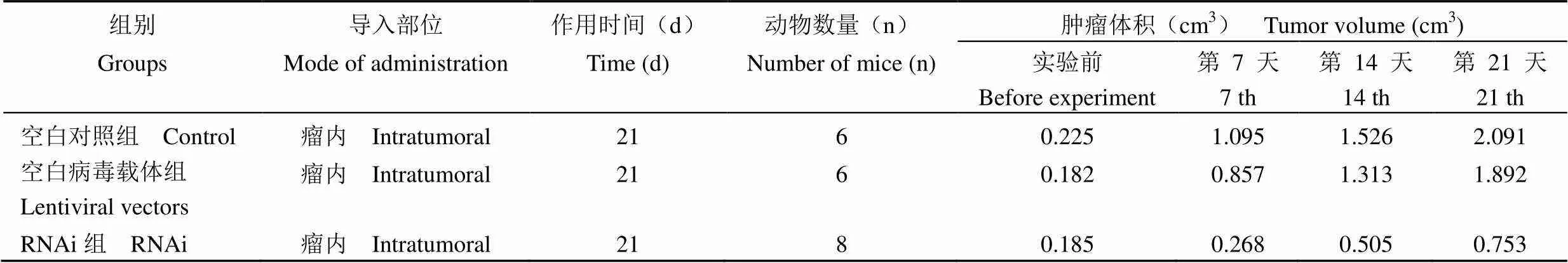
表 2 不同分组移植人肺腺癌 A549 裸鼠肿瘤的体积变化
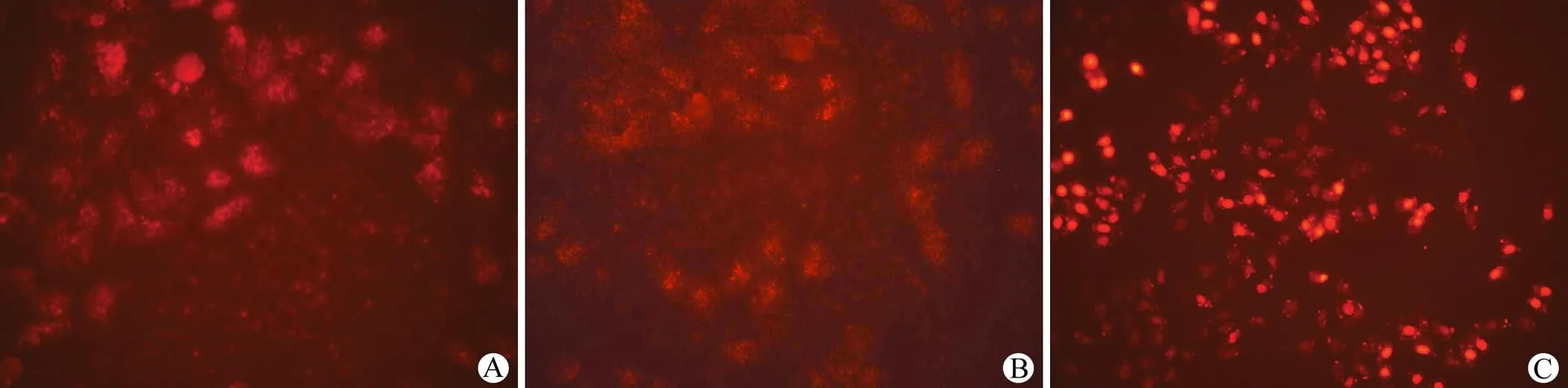
A:空白对照组;B:空白病毒载体组;C:RNAi 组
Figure 1 Human lung adenocarcinoma A549 cell line observation by PI staining

图 2 3 组人肺腺癌 A549 细胞系流式细胞仪分析的组方图及散点图
Figure 2 Three groups human lung adenocarcinoma A549 cell line flow cytometry analysis with histogram ang scatter diagram lung adenocarcinoma A549 cell lines (%)

表 3 3 组肿瘤细胞细胞周期分布比例(%)
2.3 细胞凋亡情况及细胞周期分布的观察
空白对照组和空白病毒载体组细胞周期分析可见标准的 G1/G0 期二倍体峰和正在分裂增殖的 G2/M期和 S 期四倍体峰,没有明显的凋亡亚二倍体峰。RNAi 组,用门技术排除成双或聚集的细胞以及发微弱荧光的细胞碎片后,在 PI 荧光直方图上,敲减 survivin 基因后可见凋亡细胞产生,在 G1/G0 期前出现一亚二倍体峰(图 2、表 3)。
3 讨论
本研究通过构建人 survivin 的 siRNA 及其慢病毒表达载体,裸鼠肺腺癌组织局部注射后,无论从肿瘤的质量还是体积上均有显著变化,同时在基因和蛋白水平上亦有一定程度降低,并且利用流式细胞仪技术和 PI 染色检测到由于 survivin 基因的抑制肿瘤细胞的凋亡逐渐增多,出现了典型的亚二倍体峰,且 30% ~ 35%的肿瘤细胞进入凋亡。研究中我们发现 survivin 的过度表达与肺腺癌的发生发展密切相关,是其治疗重要的靶基因。实验表明 survivin-siRNA 对裸鼠体内移植的人肺腺癌 A549 具有明显抑瘤活性,并且随着肿瘤生长时间延长一次给予的 survivin-siRNA 对肿瘤的抑制作用逐渐减弱。这可能与肿瘤伴随有多个癌基因激活和抑癌基因失活,使正常细胞不断增生、转化等因素有关,单独抑制 survivin 尚不能完全消除肿瘤,说明 RNAi 在体内实验中同样亦有降解的代谢途径,这点与文献报道相符[10-14],延长其在体内的作用时间是下一步研究需要解决的问题。与其他载体相比慢病毒载体用于体内实验更有优势,已有文献证实[15-17]慢病毒载体作为基因治疗工具无论在体外实验还是体内实验均已获得初步成功。但随着实验的进行还发现伴随时间的细胞周期分析结果中,survivin 表达阻断后,G1 期细胞比例升高,S 期、G2/M 期细胞相对减少,这与 survivin 在细胞周期调节中的作用一致。survivin 基因表达沉默后,细胞增殖抑制及克隆形成能力的下降,不仅源于细胞凋亡增多,而与 survivin 驱动细胞快速分裂作用的丧失密切相关。通过我们的实验发现尚需对 RNAi 作为基因治疗手段从不同浓度水平的 siRNA 以及不同给与时间进行深入研究,总之,survivin 基因的过表达与多种肿瘤的发生密切相关,是理想的肿瘤治疗的靶分子,而慢病毒作为载体的 RNAi 技术则是抑制肿瘤基因表达的有效工具,本研究将两者结合,有效地抑制了肿瘤细胞的体内增殖,成功诱导了肿瘤细胞的凋亡,从而为特定类型肿瘤的基因治疗提供了新的思路。
[1] Downward J. RNA interference. BMJ, 2004, 328(7450):1245-1248.
[2] Corey DR. Chemical modification: the key to clinical application of RNA interference? J Clin Invest, 2007, 117(12):3615-3622.
[3] An LF, Dong Z. RNA interference-Cancer research new means. ChinJ Oncol, 2005, 27(7):385-388. (in Chinese)
安立峰, 董震. RNA干扰—肿瘤研究的新工具. 中华肿瘤杂志, 2005, 27(7):385-388.
[4] Li F, Brattain MG. Role of the Survivin gene in pathophysiology. Am J Pathol, 2006, 169(1):1-11.
[5] Chen YQ, Li W, Zhou JH, et al. Molecular mechanism of anti-apoptotic action of survivin in NCI-H446 lung cancer cells. Chin J Oncol, 2006, 28(6):413-417. (in Chinese)
陈余清, 李伟, 周继红, 等. survivin抗肺癌细胞凋亡的分子机制.中华肿瘤杂志, 2006, 28(6):413-417.
[6] Blanc-Brude OP, Mesri M, Wall NR, et al. Therapeutic targeting of the survivin pathway in cancer: initiation of mitochondrial apoptosis and suppression of tumor-associated angiogenesis. Clin Cancer Res, 2003, 9(7):2683-2692.
[7] Giard DJ, Aaronson SA, Todaro GJ, et al. In vitro cultivation of human tumors: establishment of cell lines derived from a series of solid tumors. J Natl Cancer Inst, 1973, 51(5):1417-1423.
[8] Zhang JT. Modern Experimental Method in Pharmacology. Volume 1. Beijing: Peking Union Medical College, Beijing Medical University Joint Publishing House, 1998:927. (in Chinese)
张均田. 现代药理实验方法. 上册. 北京: 北京医科大学中国协和医科大学联合出版社, 1998:927.
[9] Liu ZY, Wang DC, Fu ZD, et al. Experimental study on antitumor efects of shen qi jin kang (SQJK). Chin J Cancer, 2006, 25(8):983- 989. (in Chinese)
刘朝阳, 王德昌, 付招娣, 等. 参芪金康胶囊抗肿瘤作用的实验研究. 癌症, 2006, 25(8):983-989.
[10] Singer O, Marr RA, Rockenstein E, et al. Targeting BACE1 with siRNAs ameliorates Alzheimer disease neuropathology in a transgenic model. Nat Neurosci, 2005, 8(10):1343-1349.
[11] Yang G, Huang C, Cao J, et al. Lentivirus-mediated shRNA interference targeting STAT3 inhibits human pancreatic cancer cell invasion. World J Gastroenterol, 2009, 15(30):3757-3766.
[12] Oliveira S, Storm G, Schiffelers RM. Targeted delivery of siRNA.J Biomed Biotechnol, 2006, 2006(4):63675.
[13] Liu T, Brouha B, Grossman D. Rapid induction of mitochondrial events and caspase-independent apoptosis in Survivin-targeted melanoma cells. Oncogene, 2004, 23(1):39-48.
[14] Connell CM, Colnaghi R, Wheatley SP. Nuclear survivin has reduced stability and is not cytoprotective. J Biol Chem, 2008, 283(6):3289- 3296.
[15] Chen D, Huang H, Pan C, et al. Antitumor effects of targeting hTERT lentivirus-mediated RNA interference against KB cell lines. Oncol Res, 2009,17(11/12):621-630.
[16] Ravet E, Lulka H, Gross F, et al. Using lentiviral vectors for efficient pancreatic cancer gene therapy. Cancer Gene Ther, 2009.
[17] Goverdhana S, Puntel M, Xiong W, et al. Regulatable gene expression systems for gene therapy applications: progress and future challenges. Mol Ther, 2005, 12(2):189-211.
Lentivirus targeted to anti-lung adenocarcinoma nude mice of carrying survivin siRNA
SI Lei, ZHAO Qi-gang, LIU Zhao-yang, ZHANG Wei
Author Affiliations: The Peoples Hospital of Liaocheng City in Shandong province, liaocheng 252000, China (SI Lei, ZHAO Qi-gang); Cancer Institute/hospital, Peking Union Medical College and Chinese Academy of Medical Sciences, Beijing 100021, China (LIU Zhao-yang, ZHANG Wei)
To explore tumor inhibition of human lung adenocarcinoma nude mice by the lentiviral vectors mediate siRNA for survivin gene.
Referencing siRNA design strategy to construct expression of survivin-siRNA lentiviral vector; we in all BALB / C nude mice inoculated human lung adenocarcinoma A549 cell suspension into subcutaneously of the right armpit. Human lung adenocarcinoma A549 nude mice model was constructed, and the lentiviral vectors were local injected in tumor tissue. Then the curve about the changing of tumor volume in different time were observed. The histogram of tumor cell cycle and apoptosis were examined by PI and FCM, respectively.
The inhibition rate of human lung adenocarcinoma A549 tumor of lentiviral vector mediated survivin-siRNA in nude mice was 46.07%; 30% ~ 35% by the PI and Annexin-V staining to differentiate between early late apoptotic cells and dead cells. Apoptosis of tumor cells were observed under fluorescence microscopy. G1 phase cells significantly increased, S phase cells were decreased significantly.
The lentiviral vectors mediated siRNA for survivin can significantly inhibit survivin gene expressand markedly induce the apoptosis of A549 tumor.
RNA, small interfering; Genetic vectors; Lentivirus; Neoplasms, experimental; Survivin
10.3969/cmba.j.issn.1673-713X.2010.02.007
聊城市科技攻关计划资助项目(20070248)
刘朝阳,Email:Liuzhy118@163.com
LIU Zhao-yang, Email: liuzhy118@163.com
2009-11-12

