黄土丘陵沟壑区土壤侵蚀对3种蒿属种子有效性的影响*
张小彦,焦菊英,,王宁,贾燕锋
(1.西北农林科技大学林学院,陕西 杨陵712100;2.中国科学院水利部水土保持研究所,陕西杨陵 712100)
土壤侵蚀是影响植被发育并受植被反作用的一种生态应力[1],不但可通过降低土壤的持水能力和养分积累,来胁迫植物群落的发生与演替[2-3],降低植被的盖度与物种的数量[4-5],并通过机械作用力破坏植物根系,使得根茎比减少,加速植被的逆向演替过程[4,6];而且还可减少土壤对种子的保持力,造成种子的流失,使得土壤种子库密度减小[7],并影响着种子的萌发及建植[8]。植物建植是植被恢复演替最为敏感的阶段[9],受种子活性与建植微环境特征的影响,决定着种子的萌发、出苗及成活[10-12];而种子活性、出苗与成活是植物生长发育的关键[13],影响着植物种群与群落的结构特征及植被恢复的程度。种子活性与建植微环境特征也受土壤侵蚀的影响,研究表明种子的活性与土壤侵蚀呈负相关[14],且土壤侵蚀造成地形的冲淤变化而形成微地形、土壤养分、水分条件的差异是导致植被分布格局变化的主要原因[15]。可见,土壤侵蚀对植被的影响始于种子的形成发育,且贯穿于植物的整个生长发育过程,干扰着种子的活性、再分布、萌发、建植、群落结构以及植被的空间分布格局。
种子在生态系统中具有非常重要的地位,可将退化劣地转变为植被环境[16]。在植物的整个生活史中,种子及种苗阶段对环境条件的反应特别敏感和脆弱,这一阶段中发生的一系列过程将影响着成年种群和群落的结构特征[17]。而种苗建植则是受种子有效性决定。种子的有效性指单位面积距地面某深度土层中具有活性的植物种子数量,首先取决于种子的产量与活性,其次是种子初级与次生掠夺,以及种子在土壤中的有效储量。关于土壤侵蚀对种子产量与活性的影响,则是通过降低土壤养分与水分来胁迫植物种子的正常发育,不能形成受精胚芽,种子失去活性,致使土壤侵蚀严重区域的植物种子活性与产量明显低于土壤保护好的区域[14]。而有关土壤侵蚀对植物种子产量与活性影响的研究很少见。为此以黄土高原主要优势物种猪毛蒿(Artemisia scoparia)、铁杆蒿(Artemisia gmelinii)、茭蒿(Artemisia giralaii)为研究对象,对不同侵蚀条件下3种蒿属种子产量与萌发特性比较分析,探讨土壤侵蚀对种子有效性的影响,以期为土壤侵蚀条件下种子生态学与恢复生态学的完善提供基础资料。
1 研究方法
1.1 研究区概况
研究区位于黄土丘陵沟壑区的典型地区安塞县(36°22′40″-36°32′16″N,105°51′44″-109°26′18″E),属暖温带半干旱气候,年平均降水量505.3 mm,年平均蒸发量1 000 mm,无霜期160~180 d,年日照时数2 352~2 573 h,≥10℃积温2 866℃,年均气温8.9℃[18]。该地区处于暖温带森林草原区,天然森林已全遭破坏,人工林以刺槐(Robinia psendoacacia)、小叶杨(Populus simonii)、柠条(Caragana intermedia)、沙棘(Hippophae rhamnoides)为主;荒坡主要为铁杆蒿、茭蒿、长芒草(Stipa bungeana)、白羊草(Bothriochloa ischaemum)等组成的处于不同演替阶段的草本植物群落;也有一些灌木物种,如狼牙刺(Sophora vicii folia)、丁香(Syringa julianae)、互叶醉鱼草(Buddleya alterni f olia)、虎榛子(Ostryopsis davidiana)、黄刺玫(Rosa xanthina)、杠柳(Periploca sepium)等零星或局部出现。多数荒坡因过度放牧成为退化草地。土壤类型主要为黄绵土,其中粉粒占 64%~74%,黏粒占 17%~20%,土质疏松,抗蚀抗冲性差,水土流失严重[19]。
1.2 种子采集
2008年10月在安塞杏子河的3个小流域(纸坊沟、大路沟、阳砭沟)内采集,每个物种选择7~10个具有不同侵蚀程度的样地,并记录样地的详细位置和坡位、坡度、坡向、海拔高度等,在每个样地选择一个5 m×5 m的样方(表1),对样方内的所有植株以标准枝为基准采集植株的部分种子,采集后的植株在室内风干,混合均匀,在纸袋内存储备用。
1.3 种子产量计算
风干后的标准株,去除枝条及叶片后,将含有种子的小花轻轻拨碎,将碎末过2 mm的筛子,去除2 mm以上的(种子远小于2 mm),再把2 mm以下的过0.15 mm的筛,将小于0.15 mm以下的混合均匀称其重量W(g),取其重量的1/n 3份,在显微镜下数每份含有的种子数,记为Ni,三次的平均值为N,即可得采集的标准枝的种子量=N×n,再根据采集量与样方植株的比例1/m,即可得到不同样地植物种子的产量Y,即Y=N×n×m(表 2)。
1.4 萌发实验
2009年3月随机选取部分样地内采集的种子以滤纸和蒸馏水为萌发基质,在培养皿中做萌发试验,在人工气候培养箱(RX-380C)内进行,白天(光照时段)取 13 h,温度 25℃,光照8 800 lx,湿度60%,夜晚(黑暗时段)取 11 h,温度为16℃。每个培养皿放50粒种子,重复3次。将种子置于培养皿中浸湿的滤纸上萌发,一旦胚根出现则认为已经萌发。发芽开始后,每天记数萌发种子数量,并将萌发种子移走,同时每天加入蒸馏水以保证滤纸湿润。记数直到连续5 d不出现发芽种子时为止。其中萌发指标有:
(1)萌发率(%)=种子发芽总数/供试种子数×100%
(2)萌发时滞(d),即萌发开始时间,就是从萌发试验开始到第1粒种子开始萌发所持续的时间。
(3)萌发持续时间(d),是指萌发开始到结束所持续的时间。
(4)T50和 T90分别是达最终发芽数50%和90%比例的萌发时间,作为种子萌发完成一半及萌发大致结束的两个衡量指标[20]。萌发结果见表2。
1.5 数据处理
所得数据用SPSS软件辅以Excel电子表格进行统计分析,通过One-Way ANOVA在95%的置信度水平上,用LSD显著性检验方法来比较不同样地下种子产量及萌发率的差异性。萌发结果以百分率±标准误差表示。注:鱼代表在样地里有鱼鳞坑。土壤侵蚀程度依据土壤侵蚀分类分级标准SL190-2007以及样地的植被长势状况与整地工程等分为轻度、中度、强烈、极强烈以及剧烈。

表1 样地的基本情况
2 结果与分析
2.1 种子产量
不同样地3种蒿类的种子产量较高,不同样地间单位面积的平均产量为猪毛蒿>茭蒿>铁杆蒿。不同样地猪毛蒿种子产量为(52.45±2.01)~(5.13±0.35)万粒/m2,样地3的种子产量最高,样地7的产量最低,7个样地间种子产量平均值为16.40万粒/m2。不同样地铁杆蒿种子产量为(1.16±0.05)~(0.09±0.01)万粒/m2,样地 17的种子产量最高,样地12的种子产量最低,10个样地种子产量平均值为0.42万粒/m2。不同样地茭蒿种子产量为(4.67±0.07)~(0.01±0.001)粒,样地26的产量最大,样地22的产量最小,10个样地种子产量的均值为0.75万粒/m2(表2)。
2.2 种子的萌发特性
总的来说,不同立地的3种蒿类在充分吸水的情况下,第2 d大多数种子开始萌发,萌发时滞、达到T50的时间相对于达到T90的时间与萌发持续时间比较集中,3种蒿类不同立地的种子达到T50的时间都集中在2~3 d,说明3种植物在不同立地的萌发具有相似的整齐度(即萌发的同步性)(表2)。
(1)猪毛蒿的萌发率为68%~87%,平均萌发率为78%。不同样地猪毛蒿的萌发时滞样地3为3 d,其余样地为2 d;达到T50的时间除样地2为3 d外,其余不同样地的种子均在萌发开始的2 d内达到;达到T90的时间样地 6与7最短,为3 d,样地2最长为16 d;萌发持续时间最短的为样地6,在7 d内完成萌发,而最长的为样地5,萌发持续进行了27 d。不同样地间猪毛蒿的萌发进程如图1所示。猪毛蒿在不同样地条件下的萌发趋势基本一致,萌发前期直线上升,后期缓慢增加,直至萌发结束。
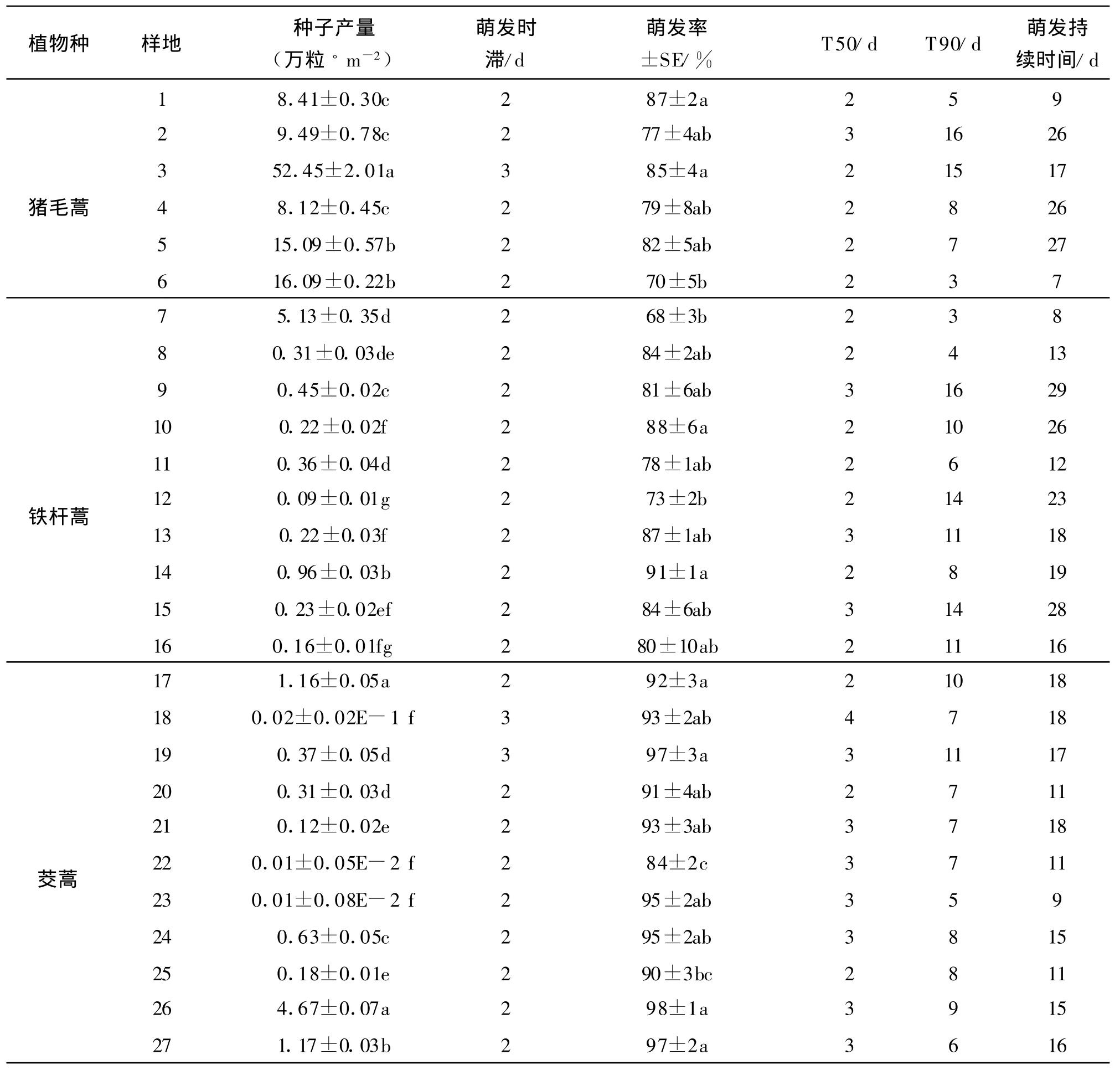
表2 不同样地3种蒿类物种的产量及萌发特性

图1 不同样地猪毛蒿的萌发进程(1-7为样地与表2对应,下同)
(2)铁杆蒿的萌发率为73%~92%,平均萌发率84%。10个不同样地的铁杆蒿种子萌发时滞一致,均为2 d;达到 T50的时间集中在2~3 d,样地9,13,15为3 d,其余样地为2 d;达到 T90的时间变化范围为4~16 d,样地8最短仅为4 d,样地9最长达16 d;萌发持续时间样地11的最短为12 d,而样地9的为29 d。不同样地的铁杆蒿的萌发进程如图2所示。铁杆蒿不同样地的萌发趋势也一致,从萌发开始到T50之间直线上升,而后平缓增加。
(3)茭蒿的最低萌发率为84%,最高萌发率可达98%,10个不同样地的平均萌发率为93%。不同样地茭蒿的萌发时滞除样地18与19萌发时滞为3 d外,其余8个样地的萌发时滞为2 d;达到 T50的时间2~4 d,样地20与25最短为2 d,样地18最长为4 d,其余样地下均为3 d;达到T90的时间范围5~11 d,样地23最短为 5 d,样地 19最长为11 d;萌发持续时间变化范围较窄,最短的为样地23持续9 d,样地18和21最长持续18 d。不同样地茭蒿的萌发进程如图3所示。茭蒿在不同样地的萌发趋势在6 d前直线增加(除样地 22,在4 d前),而后也是平缓增加。

图2 不同样地下铁杆蒿萌发进程

图3 不同样地下茭蒿的萌发进程
2.3 不同侵蚀程度对种子有效性的影响
2.3.1 对种子产量的影响 对不同侵蚀程度样地的3种蒿属产量通过单因素方差分析与LSD多重比较可知:3种蒿属的种子产量与土壤侵蚀程度有密切的关系,即土壤侵蚀越严重的样地,其种子产量越低。如对于猪毛蒿,样地3的侵蚀程度轻,其种子产量最大,与其它样地之间种子产量存在显著的差异(P<0.05),样地7的侵蚀程度强烈,种子产量最低,也与其它样地之间存在显著的差异(P<0.05);对于铁杆蒿,样地17的侵蚀程度为中度,种子产量最高,与其它样地之间存在显著的差异性(P<0.05),样地12的侵蚀程度极强烈,种子产量最低,与除样地16外的其它样地之间存在显著的差异(P<0.05);对于茭蒿,样地26的侵蚀程度为轻度,产量最高,与其它样地之间存在显著的差异性(P<0.05),样地22的侵蚀为极强烈,产量最低,与除样地23与18外的其它样地之间均存在显著的差异(P<0.05)(表1,2)。
2.3.2 对种子活性的影响 对不同样地3种蒿属的萌发率通过单因素方差分析与LSD多重比较,结果如下(表1,表2)。
(1)对于猪毛蒿,样地6、7的萌发率分别与样地1、3之间差异显著(P<0.05),而其它样地之间的萌发率则差异不显著(P>0.05)。这与样地所处立地的侵蚀程度有一定的关系。如样地7的萌发率最低为68%,这与其处于坡顶,受土壤侵蚀的影响强烈,水分与养分条件较差有关;而样地1的萌发率最高为87%,这与该样地处于阴坡的沟坡下部,水分和养分条件好,植株长势较好,土壤侵蚀程度低有关。样地6,7受土壤侵蚀的影响大,因而其萌发率低,样地1、3受土壤的影响程度轻,因而其萌发率高。
(2)对于铁杆蒿,样地12的萌发率与样地10,14,17之间存在显著差异(P<0.05),其它样地之间则没有明显的差别(P>0.05)。这也与样地所处的立地侵蚀环境有一定的关系。在10个样地中,样地12的土壤侵蚀极强烈,因而其萌发率最低为73%,样地10,14,17的土壤侵蚀为中度,其萌发率较高,由于样地 17的植被长势较好,其萌发率最高为92%(表 1,2)。
(3)对于茭蒿,样地22的萌发率与除样地25外的其它样地之间均存在显著差别,样地25与样地19、26、27之间存在显著差别(P <0.05),除此之外的其它样地之间不存在显著差别(P>0.05)。样地26处于阴坡、土壤侵蚀轻、植被长势好,种子萌发率最高为98%,样地22土壤侵蚀极剧烈,其萌发率最低为84%。由表2可知,茭蒿的萌发率也与样地的土壤侵蚀程度的关系表现出明显的一致性,即土壤侵蚀程度越轻的样地具有较高的萌发率。
综上可知,土壤侵蚀对种子的有效性具有明显的影响,同一物种不同样地之间种子产量、萌发率与土壤侵蚀程度的相关性具有一致性,即种子产量高的样地,其种子的萌发率也高。对于不同样地的猪毛蒿,样地3的产量最高,其种子的萌发率达85%(与最高萌发率87%无差异性),样地7的种子产量最低,其萌发率也是最低为68%;对于铁杆蒿,样地17的种子产量最高,其萌发率最高为92%,样地12的种子产量最低,其萌发率最低为72%;对于茭蒿,样地26的产量最高,萌发率最大为98%,样地22的产量最低,萌发率最低为84%。
3 结论
不同的侵蚀条件势必会造成土壤养分、水分、植被生长状况的差异,从而对植物种子的形成发育过程产生很大的影响。通过对3种蒿类种子的产量、萌发率与立地土壤侵蚀程度的分析可知:立地条件的土壤侵蚀程度对种子产量与萌发率有很大的影响,土壤侵蚀越严重,种子的有效性越低;种子产量与种子的萌发率具有一致性,立地的种子产量高,其萌发率也高,说明种子的产量与活性对土壤侵蚀变化的响应是一致的。由于土壤侵蚀关联到一系列的生态因子,包括土壤颗粒、有机质、养分、水分等,这些因子对植物的发育过程起到关键的作用,贯穿于种子的整个生活史,干扰着种子的活性、萌发、建植以及植被的分布。因此,需在了解植被与土壤侵蚀之间的相互生态应力的基础上,系统研究土壤侵蚀对植物种子的产量与活性、迁移与流失、萌发与存活,以及幼苗建植与植被发育的作用机制,才能更好地解释黄土丘陵沟壑区植被自然恢复演替的现状与格局,并为该区加速植被恢复进行人为适度干预与调控提供科学依据。
[1]吕仕洪,向悟生,李先琨,等.红壤侵蚀区植被恢复研究综述[J].广西植物,2003,23(1):83-89.
[2]Guerrero-Campo J,M ontserrat-M artí G.Effects of soil erosion on the floristic composition of plant communities on marl in the northeast Spain[J].Journal of Vegetation Science,2000,11:329-336.
[3]Zhang J G,Li H X,He X R,et al.Impoverishment of soil nutrients in the gully erosion areas in the Yuanmou Basin[J].Wuhan University Journal of Natural Sciences,2003,8(3B):1034-1040.
[4]Guerrero-Campo J,Montserrat-Martí G.Comparison of floristic changes on vegetation affected by different levels of soil erosion in Miocene clays and Eocene marls from Northeast Spain[J].Plant Ecology,2004,173:83-93.
[5]Tsuyuzaki S,Titus J.Vegetation development patterns in erosive areas on the Pumice Plains of Mount St.Helens[J].American Midland Naturalist,1996,135:172-177.
[6]王兆印,郭彦彪,李昌志,等.植被-侵蚀状态图在典型流域的应用[J].地球科学进展,2005,20(2):149-157.
[7]Jones F E,Esler K J.Relationship between soil-stored seed banks and degradation in eastern Nama Karoo rangelands(South Africa)[J].Biodiversity and Conservation,2004,13:2027-2053.
[8]Thornes J B.The ecology of erosion[J].Geography,1985,70:222-236.
[9]Garc í a-Fayos P,Cerdà A.Seed losses by surface wash in degraded Mediterranean environments[J].Catena,1997,29:73-83.
[10]Chambers J C,MacMahon J A.A day in the life of a seed:movements and fates of seeds and their implications for natural and managed systems[J].Annual Review of Ecology and Systematics,1994,25:263-292.
[11]Garc í a-Fayos P,Garcia-Ventoso B,Cerdà A.Limitations to Plant Establishment on Eroded Slopes in Southeastern Spain[J].Journal of Vegetation Science,2000,11(1):77-86.
[12]Barberá G G,Navarro-Cano J A,Castillo V M.Seedling recruitment in a semi-arid steppe:The role of microsite and post-dispersal seed predation[J].Journal of Arid Environments,2006,67(4):701-714.
[13]Sá nchez A M,Peco B.Lack of recruitment in Lavandula stoechas subsp.pedunculata:a case of safe-site limitation[J].Acta Oecologica,2007,31:32-39.
[14]Renison D,Hensen I,Cingolani A M.Anthropogenic soil degradation affects seed viability in Polylepis australis mountain forests of central Argentina[J].Forest Ecology and Management,2004,196:327-333.
[15]Guerrero-Campo J,Alberto F,Hodgson J,et al.Plant community patterns in a gypsum area of NE SpainⅠ.Interactions with topographic factors and soil erosion[J].Journal of Arid Environments,1999,41:401-410.
[16]Alexander R W,Harvey A M,Calvo A,et al.Natural Stabilisation Mechanism on Badland Slopes:Tabemas,Almeria,spain[M]//Millington A C,Pye k.Environment change in Drylands.Chichester:Wiley,1994:85-111.
[17]Harper J L.Population Biology of Plants[J].New York:Academic press,1977.
[18]白文娟,焦菊英,张振国.安塞黄土丘陵沟壑区退耕地的土壤种子库特征[J].中国水土保持科学,2007,5(2):65-72.
[19]王军,傅伯杰,邱扬.黄土高原小流域土壤养分的空间异质性[J].生态学报,2002,22(8):1173-1178.
[20]闫巧玲,刘志民,李雪华,等.埋藏对65种半干旱草地植物种子萌发特性的影响[J].应用生态学报,2007,18(4):777-782.

