两种羊膜脱细胞基质制备方法的比较*
雷宁静,胡 炜,王成春,朱根明,杨琳琳,关方霞#
1)郑州大学生物工程系郑州450001 2)郑州大学第一附属医院神经外科郑州450052
生物活性材料可用于修补受损组织和大面积缺损,是组织工程的研究热点。羊膜具有免疫原性极低,排异反应小,可分泌多种生长因子并含有多种炎性因子及新生血管抑制因子等生物学特性,是一种良好的生物活性载体[1]。羊膜脱细胞基质是一种特殊的细胞外基质,作为细胞培养的生物载体,特别是作为生物活性载体,已用于干细胞体外培养。又因其免疫原性低而广泛用于眼科、临床烧伤外科及骨科等皮肤、黏膜及神经重建移植研究[2]。作者采用2种改进方法进行羊膜脱细胞基质的制备,比较其脱细胞效果,并用于脐带间质干细胞的体外培养,观察脐带间质干细胞与羊膜脱细胞基质的生物相容性,为进一步进行组织工程研究提供实验依据。
1 材料与方法
1.1 主要试剂及仪器 基础培养基[体积比1∶1的DMEM/F12培养液,体积分数10%胎牛血清,20 μg/L碱性成纤维细胞生长因子(bFGF)],青、链霉素,胰蛋白酶,EDTA,TritonX-100,倒置显微镜 IX71(日本Olympus公司),细胞培养箱,超净工作台,扫描电镜。
1.2 羊膜脱细胞基质的制备 无菌条件下取正常足月剖宫产胎儿胎盘(郑州大学第一附属医院),采取前征得产妇知情同意,实验经医院伦理委员会批准。钝性分离羊膜约10 cm×10 cm,去除绒毛膜组织,保留羊膜层。
①Triton法:新鲜羊膜经生理盐水反复冲洗干净后置于体积分数0.1%TritonX-100溶液中,振荡,置于恒温培养箱中保存36 h,取出后用生理盐水漂洗干净。加入25 g/L胰蛋白酶+0.2 g/L EDTA,充分振荡,37℃保存4 h。取出后用生理盐水漂洗干净,裁剪成1 cm×1 cm大小后分装密封。
②甘油法:新鲜羊膜冲洗干净后置于培养皿中甘油浸泡,4℃保存,24 h×3次;生理盐水反复冲洗干净,25 g/L胰蛋白酶+0.2 g/L EDTA 4℃作用10 h。取出后用生理盐水漂洗干净,裁剪成1 cm×1 cm大小后分装密封。
1.3 脐带间质干细胞的制备及传代 将上述胎盘所附带的脐带剪成约2 cm的段状,用生理盐水冲洗干净。剥去脐带内两条动脉和一条静脉,再用生理盐水充分洗涤,剪碎成泡沫状,移液管吸取适量的脐带组织至培养瓶中,加入已配置好的培养基(DMEM/F12培养液,体积分数10%的胎牛血清,体积分数0.67%bFGF,体积分数1%的青、链霉素),吹打均匀后置于37℃、饱和湿度、体积分数5%CO2培养箱中培养。3~4 d更换培养液一次。待细胞生长达到80% ~90%融合铺满瓶底时,进行细胞传代。
1.4 羊膜脱细胞基质性状观察
1.4.1 残余细胞数 2种羊膜脱细胞基质各取6张样本置于载玻片上,HE染色,100倍镜下每张选取10个不同视野,采用网格计数法计数相同面积内的残余细胞数,重复实验3次。镜下观察到深蓝染色者计数为1个残余细胞。
1.4.2 电镜观察 用生理盐水将羊膜脱细胞基质清洗干净,然后用体积分数0.25%戊二醛固定,送检,扫描电镜下观察2种脱细胞基质的形态。
1.4.3 脐带间质干细胞在羊膜脱细胞基质上的生长状况 2种羊膜脱细胞基质用培养液预湿,展开置于6孔板内,将传至第3代的人脐带间质干细胞悬液(2×105mL-1)0.2 mL接种于脱细胞基质,加入 4.8 mL DMEM/F12 培养液,0.03 μL bFGF,置于37℃、饱和湿度、体积分数5%CO2培养箱中培养,隔日换液,HE染色,倒置显微镜下观察细胞黏附情况。将第3代人脐带间质干细胞以4×104mL-1分别接种在底部包被2种基质的24孔板中,用基础培养基培养,每隔24 h取6孔,胰酶消化混合后重悬细胞,台盼蓝染色,计数活细胞总数,重复3次,取平均值为当天的活细胞计数,共计数4 d。
1.5 统计学处理 应用SPSS 12.0处理数据,2种残余细胞数及脐带间质干细胞活细胞计数的比较用成组资料的t检验,检验水准α=0.05。
2 结果
2.1 2种羊膜脱细胞基质形态的比较 2组脱细胞后的羊膜均为白色透明的膜状物,柔韧性好。HE染色可见,2种脱细胞基质表面无蓝色核染物质(图1A、B)。扫描电镜下观察,2种脱细胞基质亦未见细胞残留;Triton组羊膜脱细胞基质可见纵横交错的编织状纤维;甘油组样本表面凹凸不平,看不到细胞形态(图1C、D)。Triton组残余细胞数为(1.13±0.35),甘油组为(1.11 ±0.22),2 组间差异无统计学意义(t=1.920,P=0.888)。
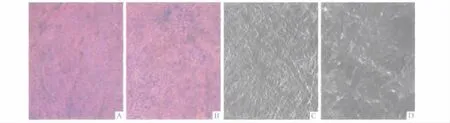
图1 2种羊膜脱细胞基质形态观察
2.2 脐带间质干细胞在2种羊膜脱细胞基质上的生长状况 脐带间质干细胞约6 h即可在2种羊膜脱细胞基质表面黏附。2组细胞增殖情况见表1。

表1 2组脐带间质干细胞活细胞计数结果 104mL-1
3 讨论
生物载体材料是组织工程研究的基础,目前,生物载体材料主要有两大类,一类是人工合成材料,另一类是天然生物材料。与人工合成材料相比,天然生物材料具有无法比拟的优点:一方面,天然生物材料直接取自生物体内,有良好的生物相容性和生物可降解性,且降解产物无毒副作用;另一方面,天然生物材料本身就具有相同或类似于细胞外基质的结构,可促进细胞黏附、增殖和分化[3]。因此,天然生物材料已成为人们研究的热点。
目前临床上使用的羊膜主要为新鲜羊膜、深冷保存羊膜和脱细胞羊膜(也称羊膜脱细胞基质)。国外多采用深低温(-80℃)保存的含有上皮细胞的羊膜,因技术工艺要求复杂,保存成本过高,不为国内所采用。羊膜脱细胞基质不含羊膜上皮细胞,保留了羊膜基底膜与致密层,它的主要成分是Ⅲ、Ⅳ及Ⅴ型胶原蛋白,蛋白多糖和糖蛋白,是一种天然的细胞外基质,可能是良好的组织工程生物载体材料。然而,目前常用的羊膜脱细胞处理方法是胰酶酶解及物理方法[4],膜制备过程中可能会产生二次污染,并且过度酶解会破坏羊膜基质的蛋白结构及韧性,器械处理也可能会对羊膜造成损伤。这些不足均降低了羊膜脱细胞基质作为天然细胞外基质的优越性。
作者采用2种方法处理新鲜羊膜,一组使用TritonX-100和酶消化法进行处理,该方法操作简单,用时较短(约需2 d);另一组使用甘油浸泡和酶消化法进行处理,操作也简单,耗时较长(约需4 d)。TritonX-100是常用的非离子性表面活性剂,能溶解脂质。甘油的重要特点之一是无毒无刺激,不会对生物组织造成伤害。2种方法得到的羊膜脱细胞基质均无细胞残留,均对脐带间质干细胞有良好的细胞相容性,但是脐带间质干细胞在Triton组羊膜脱细胞基质上的细胞增殖情况明显优于甘油组。从电镜扫描结果可看出,TritonX-100处理的羊膜可见纵横交错的编织状纤维,不含坏死组织,基质成分完整,三维结构清晰;而甘油处理的样本尽管无细胞残留,但无法观察到纵横交错的编织状纤维,其三维结构塌陷,原因可能为甘油强力脱水后影响三维结构及胰酶处理时间过长,影响基质的蛋白结构从而影响三维结构。据文献[5]可知,细胞的生长增殖不仅与培养基及生长因子相关,而且与所贴敷材料的空间物理结构有关,种植材料表面的理化性质能影响生物大分子层的结构、组成和空间构象,进而导致不同的细胞学表现。
综上所述,作者认为,TritonX-100预处理并酶消化法是制备羊膜脱细胞基质较好的方法。
[1]蔡琼霞,熊华锋,胡葵葵,等.脐血间充质干细胞分离培养的理论研究与应用[J].中国组织工程研究与临床康复,2007,11(28):5 630
[2]宋永周,崔慧先,王振显,等.羊膜脱细胞基质的制备及其生物相容性[J].中国组织工程研究与临床康复,2008,12(1):51
[3]杜心欣,瓦龙美.天然生物材料在皮肤组织工程中的应用[J].医学综述,2006,12(9):515
[4]肖光礼,聂卫,高萍,等.脱细胞羊膜制备及生物学评价[J].临床医学工程,2009,16(1):1
[5]张春宝,陈富林,张蓉,等.Ti-75合金对人成骨细胞的生长、增殖和功能分化的影响[J].实用口腔医学杂志,2000,16(1):24

