原花青素对培养的人脐静脉内皮细胞脂质过氧化的保护作用
董 娜 ,于 进,李 寰 ,陶 凌 ,王海昌,胡 涛
经皮冠状动脉介入治疗术(percutaneous coronary intervention,PCI)已成为治疗冠心病的主要手段,但术后的再狭窄(restenosis,RS)率高达20%~30%,严重影响了PCI术的疗效;尽管各国学者对此进行了大量基础及临床研究,但该问题仍未解决,已成为全球的研究热点[1]。近年来研究发现,血管内皮细胞(vascular endothelial cell,VEC)与RS的关系密切相关,PCI术后VEC损伤的程度决定了新生内膜的增厚程度,对RS的程度起着关键作用[2]。VEC损伤的原因很多,除了PCI术不可避免的机械损伤外,脂质过氧化是一个重要机制;PCI术后导致血管局部发生一系列复杂的病理生理变化,诱导还原型烟酰胺腺嘌呤二核苷酸磷氧化酶,使血管局部生成过量的活性氧(reactive oxygen species,ROS),导致脂质过氧化,从而引起VEC的DNA损伤及细胞功能障碍[3,4]。因此,有效地阻断ROS对VEC的损伤作用,尽快恢复VEC活性,加速VEC的修复,是防治RS的重要途径之一。原花青素为黄酮类化合物,存在于葡萄、松针、苹果、高粱、樱桃等多种植物中,具有广泛的生物活性;近年来的研究发现其有抗氧化、抗肿瘤、抗炎、抗病毒、预防心血管疾病等作用[5]。有研究发现,原花青素对心脏缺血再灌注时产生的ROS具有浓度依赖性的抑制作用,可保护和修复由缺血再灌注造成的心肌细胞损伤[6]。但其是否能作为抗氧化剂阻断ROS对VEC的损伤尚未见报道。本研究通过应用不同浓度的过氧化氢(H2O2)作为外源性ROS作用于培养的人脐静脉内皮细胞(human umbilical vein endothelial cells,HUVEC)造成其脂质过氧化损伤,观察了原花青素是否具有减轻VEC脂质过氧化损伤的作用。
1 材料与方法
1.1 材料和仪器 原花青素(成都康弘制药有限公司惠赠);过氧化氢(Sigma公司);3H-TdR(中科院上海原子能研究所);DNA-prep染色试剂(Coulter公司);DMEM干粉细胞培养基(Hyclone公司);流式细胞仪Elite ESP型(Coulter公司);CO2培养箱(Nuair公司);液体闪烁计数器 LS-6500(Beckmen公司);其他试剂均为进口分装或国产分析纯。
1.2 HUVEC体外培养 取剖腹产术中无菌脐带,进行原代细胞分离和培养[7]。用含100 g/L小牛血清DMEM培养液培养传代,实验采用3~5代细胞。免疫荧光法检测细胞Ⅷ因子相关抗原进行细胞鉴定。细胞分组如下:对照组,10、20、50、100 mol/L H2O2组,1、5、10 mmol/L 原花青素组,1、5、10 mmol/L 原花青素+100 mol/L H2O2组,共11组。
1.33H-TdR掺入法测定H UVEC增殖 取同代对数生长期细胞,用2.5 g/L胰蛋白酶消化,制成单细胞悬液,调整细胞密度为1×105/ml,将细胞接种于96孔培养板中,每孔 100 μ l,8孔为一组,用含100 g/L小牛血清的DMEM培养液静置培养24 h后换用无血清的DMEM培养液培养24 h,调整其同步化后,换含100 g/L小牛血清的DMEM培养液,按实验分组加入药物在CO2培养箱继续培养24 h。用常规方法测定cpm值。实验重复3次。
1.4 流式细胞仪测定细胞周期 取同代对数生长期细胞,用2.5 g/L胰蛋白酶消化,制成1×105/ml单细胞悬液,将细胞接种于培养瓶,用含100 g/L小牛血清的DMEM培养液静置培养24 h后换用无血清的DMEM培养液培养24 h,换含100 g/L小牛血清的DMEM培养液,按实验分组加入药物,在CO2培养箱继续培养24 h。培养结束后,用流式细胞仪测定并计算每瓶各时相细胞的比例。
1.5 统计学处理 采用SPSS 13.0软件完成。结果数据用±s表示。两组间及组间的两两比较采用配对t检验和多组均数的单因素方差分析。P<0.05为差异有统计学意义。
2 结 果
2.1 H2O2对HUVEC增殖的影响3H-TdR掺入实验显示,除 10 mol/L组外,20、50、100 mol/L H2O2各组 cpm值与对照组相比均有显著性差异(P<0.01),且呈浓度依赖性。100 mol/L H2O2抑制H UVEC增殖作用最强,倒置显微镜下见HUVEC变形,细胞间隙变宽,部分细胞脱落。据此选择该浓度作为本实验损伤HUVEC的浓度(图1)。
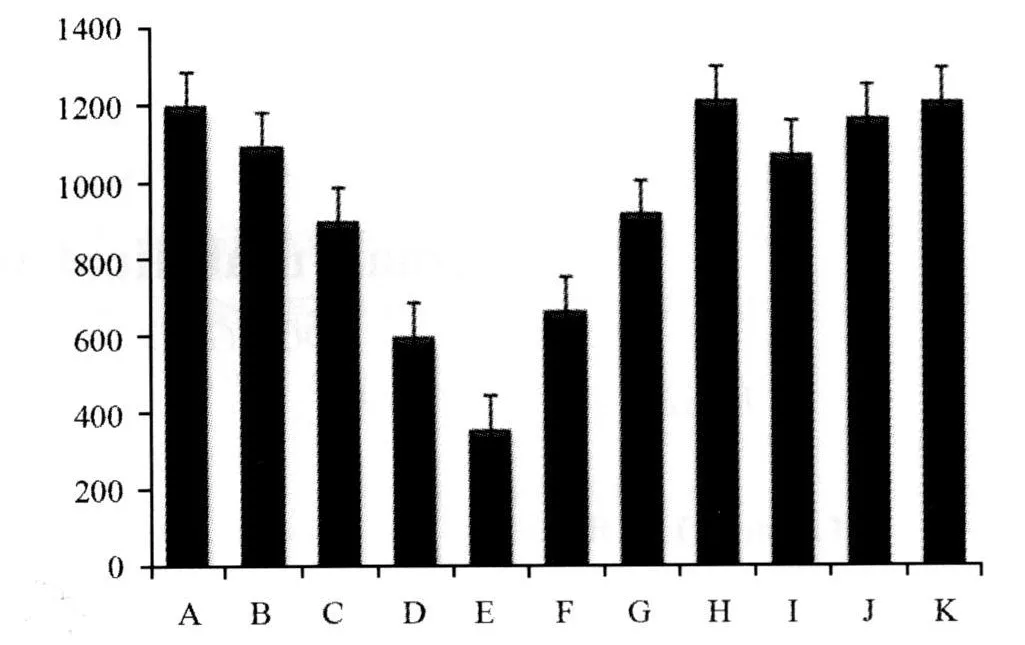
图1 原花青素和H2O2对HUVEC增殖的影响
2.2 原花青素对H2O2损伤后H UVEC增殖的影响3H-TdR掺入实验显示,不同浓度原花青素均可对抗H2O2对H UVEC的增殖抑制作用。加入1、5、10 mmol/L原花青素后,各组 cpm 值与100 mol/L H2O2组相比均显著升高(P<0.01)。且具有一定的浓度依赖性。而单纯原花青素本身对H UVEC增殖无影响(P>0.05,图1)。
2.3 原花青素和H2O2对HUVEC细胞周期的影响 细胞周期时相显示,H2O2组DNA合成期(S期)细胞所占百分比显著低于对照组;DNA合成前期(G1期)细胞所占百分比较对照组增高,反映细胞增殖活力的增殖指数值降低,差异显著(P<0.05)。不同浓度原花青素均可对抗H2O2对 HUVEC的DNA合成抑制作用,且具有一定的浓度依赖性。而单纯原花青素本身对HUVEC细胞周期无影响,各组细胞在不同周期时相与对照组比较均无显著性差异(P>0.05;表1)。
表1 原花青素和H2O2对HUVEC细胞周期的影响 (n=12 ±s)
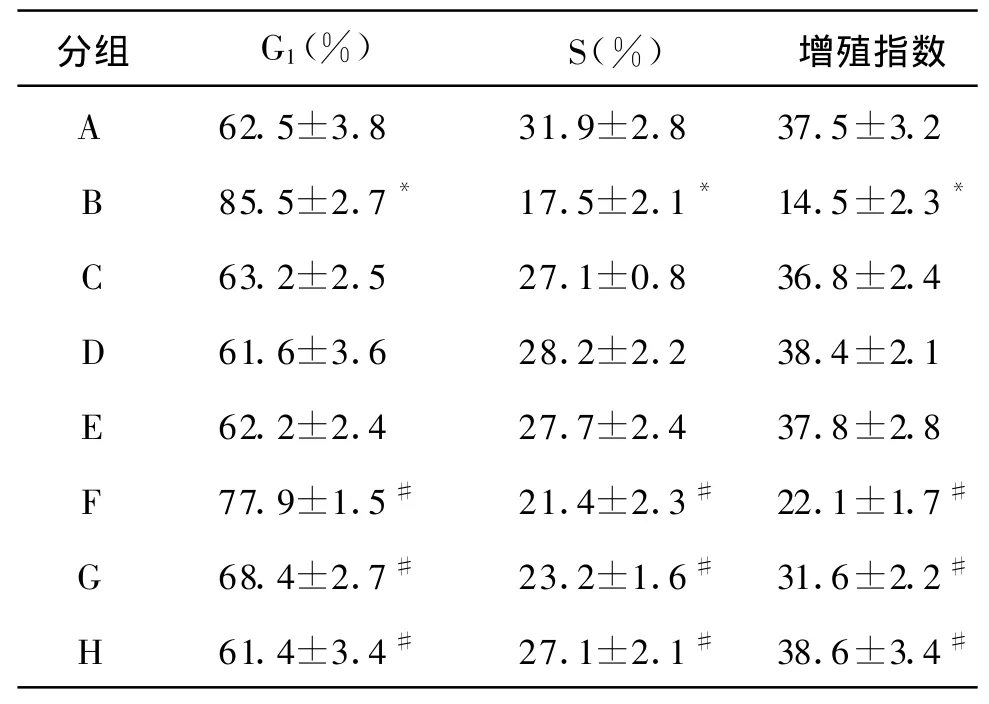
表1 原花青素和H2O2对HUVEC细胞周期的影响 (n=12 ±s)
注:A:对照组;B,C,D,E:10,20,50,100 mol/L H2O2;F,G,H:100 mol/L H2O2+1,5,10 mmol/L原花青素。与对照组比较,*P<0.05;与B组比较,#P<0.05
分组 G1(%) S(%) 增殖指数A 62.5±3.8 31.9±2.8 37.5±3.2 B 85.5±2.7* 17.5±2.1* 14.5±2.3*C 63.2±2.5 27.1±0.8 36.8±2.4 D 61.6±3.6 28.2±2.2 38.4±2.1 E 62.2±2.4 27.7±2.4 37.8±2.8 F 77.9±1.5# 21.4±2.3# 22.1±1.7#G 68.4±2.7# 23.2±1.6# 31.6±2.2#H 61.4±3.4# 27.1±2.1# 38.6±3.4#
3 讨 论
氧化应激以及氧化应激过程中产生的过量ROS是PCI术后 RS发生的一个重要促进因素。ROS除了能直接发挥细胞毒性作用外,还能通过影响细胞信号转导系统调控某些基因的表达。有研究显示,PCI术后ROS产生增多,且同一血管的损伤段与未损伤段相比,前者ROS产生量是后者的2~3倍[8]。生理状态下,VEC产生的各种收缩(促)生长因子与舒张(抑)生长因子处于平衡状态;从而调节血管的张力和血管平滑肌细胞生长。PCI术后ROS过度蓄积引起VEC脂质过氧化损伤,平衡状态被打破,是启动和促进RS的重要原因[9]。
高脂血症、糖尿病、高血压和吸烟是公认的RS发生发展的危险因子,虽然其致病机制并不十分清楚,但近年研究显示,细胞内氧化应激信号选择性诱导炎症相关基因表达是它们共同的分子机制之一[10]。很多细胞因子和生长因子可诱导产生ROS,通过Ras/ERK以及其他尚未阐明的信号通路激活靶基因,调控细胞增殖和分化,最终导致RS。越来越多的证据提示,ROS和一系列参与RS的活性因子相互促进相互影响,在RS形成过程中可能起着关键性作用。利用药物有效地阻断ROS对VEC的损伤已成为近年来 RS防治的研究热点[11,12]。
原花青素属多羟基类化合物,其分子结构特点使其具有很强的自由基清除能力。原花青素可以通过清除体内过多的ROS,抑制脂质过氧化,维持体内自由基和抗氧化酶之间的平衡,与体内各种抗氧化酶共同维持机体的稳态,从而预防由于自由基或脂质过氧化引起的各种疾病[13]。新近研究还发现,原花青素具有降低甘油三酯、低密度脂蛋白胆固醇,升高高密度脂蛋白胆固醇,抑制动脉粥样硬化等有益于心血管疾病的作用[14]。
本实验通过观察原花青素对 ROS引起的H UVEC脂质过氧化损伤的影响,揭示H2O2可作为脂质过氧化反应的诱发物,导致VEC脂质过氧化损伤,可抑制VEC3H-TdR掺入,减少DNA合成期细胞比例,并具有剂量依赖性;而原花青素可以对抗H2O2导致的VEC DNA合成减少及细胞增殖活性下降,具有一定的保护作用,并表现出剂量依赖性,这可能与原花青素对ROS有清除和抑制生成作用有关。
本实验发现,原花青素有益心血管效应,对于PCI术后 RS的防治可能具有应用前景,但其心血管治疗作用的研究资料大部分是基于动物实验,临床试验资料相对较少,最终能否用于PCI术后 RS防治,尚待进一步大规模临床试验证实。
[1]Pendyala L,Jabara R,Shinke T,et al.Drug-eluting stents:present and future[J].Cardiovasc Hematol Agents Med Chem,2008,6(2):105-115.
[2]Zhao FH,Chen YD,Jin ZN,et al.Are impaired endothelial progenitor cells involved in the processes of late in-stent thrombosis and re-endothelialization of drugeluting stents[J]?Med Hypotheses,2008,70(3):512-514.
[3]Berliner JA,Gharavi NM.Endothelial cell regulation by phospholipid oxidation products[J].Free Radic Biol Med,2008,45(2):119-123.
[4]Thomas SR,Witting PK,Drummond GR.Redox control of endothelial function and dysfunction:molecular mechanisms and therapeutic opportunities[J].Antioxid Redox Signal,2008,10(10):1713-1765.
[5]Del Bas JM,Ricketts ML,Baiges I,et al.Dietary procyanidins lower triglyceride levels signaling through the nuclear receptor small heterodimer partner[J].Mol Nutr Food Res,2008,52(10):1172-1181.
[6]Pataki T,Bak I,Kovacs P.Grape seed proanthocyanidins improved cardiac recovery during reperfusion after ischemia in isolated rat hearts[J].Am J Clin Nutr,2002,75(5):894-899.
[7]Iwaguro H,Asahara T.Endothelial progenitor cell culture and gene transfer[J].Methods Mol Med,2005,112:239-247.
[8]Farah R,Shurtz-Swirski R,Bolotin Y,et al.Oxidative stress and inflammation due to peripheral polymorphonuclear leukocytes after coronary angiography vs percutaneous coronary intervention[J].Minerva Cardioangiol,2008,56(2):189-195.
[9]Li HB,Yi X,Gao JM,et al.The mechanism of hyperoside protection of ECV-304 cells against tert-butyl hydroperoxide-induced injury[J].Pharmacology,2008,82(2):105-113.
[10]Gamkrelidze M,Mamamtavrishvili N,Bejitashvili N,et al.Role of oxidative stress in pathogenesis of atherosclerosis[J].Georgian Med News,2008,(163):54-57.
[11]Amom Z,Zakaria Z,M ohamed J,et al.Lipid lowering effect of antioxidant alpha-lipoic acid in experimental atherosclerosis[J].J Clin Biochem Nutr,2008,43(2):88-94.
[12]Bruckdorfer KR.Antioxidants and CVD[J].Proc Nutr Soc,2008,67(2):214-222.
[13]Kimura Y,Ito H,Kawaji M,et al.Characterization and antioxidative properties of oligomeric proanthocyanidin from prunes,dried fruit of Prunus domestica L[J].Biosci Biotechnol Biochem,2008,72(6):1615-1618.
[14]Lee KW,Kang NJ,Oak MH,et al.Cocoa procyanidins inhibit expression and activation of MMP-2 in vascular smooth muscle cells by direct inhibition of M EK and M T1-MMP activities[J].Cardiovasc Res,2008,79(1):34-41.

