老年钙化性心脏瓣膜病介入治疗进展
何国祥
老年钙化性心脏瓣膜病并非少见,药物治疗仅对瓣膜病变导致的并发症如心力衰竭等起一定作用,且效果有限。对于钙化性瓣膜病变本身的治疗,除传统的外科手术和经皮球囊瓣膜成形术(percutaneous balloon valvuloplasty,PBV)即球囊瓣膜扩张外,近年发展迅速的经导管心脏瓣膜病治疗(transcatheter valve therapy,TVT)主要是经导管主动脉瓣植入/置换(transcatheter aortic valve implantation/replacement,TAVI/TAVR)和经导管二尖瓣修复/瓣环成形术(transcatheter mitral valve repair/annuloplasty,TMVR/TMVA),也有二尖瓣装置的直接植入(transcatheter mitral valve implantation,TMVI)[1~3]。
1 高危老年钙化性心脏瓣膜病患者传统疗法的局限性
高危严重主动脉瓣狭窄患者外科主动脉瓣置换术和单纯球囊扩张术的疗效有限。
1.1 外科主动脉瓣置换术 虽然对主动脉瓣狭窄患者进行成功的主动脉瓣置换术后,能够显著改善左心室肥厚、心功能、血流动力学状态和患者的症状及生存率,但对于其中的高危主动脉瓣狭窄患者:年龄>75岁、左心室射血分数(left ventricular ejection fraction,LVEF)≤40%,则外科手术的院内病死率高达10%~33%,术后1年的病死率仍在20%左右,影响院内病死率的主要因素有年龄、心脏手术(含冠状动脉旁路移植术)史、心功能状态和LVEF、心房颤动和脑卒中史[4]。
1.2 经皮球囊主动脉瓣成形(扩张)术(percutaneous ballon anortic valvuloplasty,PBAV) 单纯的PBAV尽管能获得显著的血流动力学效果,主动脉瓣跨瓣压梯度(aortic valve gradient,AVG)虽显著下降,但因为钙化的瓣膜难以被充分扩张或限制了充分扩张,通常遗留的AVG仍有30 mmHg(1 mmHg=0.133 kPa)左右,主动脉瓣口面积也仅能达到0.8~0.9 cm2,PBAV后院内病死率为10%,1年病死率达40%~50%。荟萃分析的结果表明,1年的生存率为61%,无事件生存率仅41%。故其远期疗效是很有限的。
1.3 传统的二尖瓣外科手术 2000-2007年的统计资料表明,二尖瓣病变患者接受外科手术的数量呈显著减少趋势,而经导管治疗者则不断增加[5]。
上述情况提示,需要为高危的心瓣膜病变患者寻找一种更安全有效的治疗手段和方法。因此,TAVI/TAVR和TMVR/TMVA应运而生。
2 经导管主动脉瓣植入/置换
2.1 TAVI/TAVR的带瓣支架 Edwards和CoreValve分别已各超过5000临床应用病例。早期使用 Edwards SPAIENTM带瓣支架较多,优点是因为其本身较短,对冠状动脉不易产生压迫,缺点是经导管推送较困难。此外,Ventro EmbracerTMMedtronic,ABPS eNITIONOLTMMembrane PercValveTM等带瓣支架均有应用(图1)。

图1 经导管植入的各种带瓣主动脉瓣支架
2.2 TAVI/TAVR的临床指征 严重的钙化性主动脉瓣狭窄、超声心动图测量的AVA<0.8 cm2,或者AVG>40 mmHg,或主动脉瓣口射血流速>4.0 m/s;NYHA心功能级别≥Ⅱ级;预计行传统外科心脏瓣膜置换手术的病死率≥15%,或最小STS记分≥10分(新的STS记分为8分)。同时,需要注意瓣膜、瓣环、左心室流出道和主动脉窦的解剖状态,以及TAVI/TAVR介入手术操作所需要经过的外周动脉无明显病变及(或)畸形,且有足够的直径;并注意按照动脉及主动脉瓣环直径选择拟植入的带瓣支架型号和推送鞘直径的大小[6]。
2.3 TAVI/TAVR的疗效 The SOURCE Registry研究[7]共纳入欧洲34个中心1123例,其中1038例完成 TAVI/TAVR,80%以上为高危患者。结果:经股动脉和经心尖部途径的即刻操作成功率分别为95.6%和92.9%,总成功率为94.1%;器械成功率分别为92.4%和90.8%(91.5%);Ⅱ度以上的主动脉瓣反流分别为3.2%和5.9%(4.7%);严重主动脉瓣反流者为1.7%和3.5%(2.7%);植入的瓣膜移位分别为0.0%和0.5%(0.3%);瓣膜位置不良分别为1.7%和1.4%(1.5%);冠状动脉阻塞分别为 0.7%和0.5%(0.6%)。死亡:6.3%对10.3%;卒中:2.4%对 2.6%;需要透析的肾衰5.0%对11.7%;需永久起搏者6.7%对7.3%。血管操作并发症:血管入路并发症分别为17.9%和2.4%(9.3%);主动脉夹层1.9%对0.7%(1.3%);非入路相关的血管并发症1.2%;所有的血管并发症:严重并发症10.6%对2.4%(7.0%),轻微并发症10.4%对1.7%(5.5%)。
30d生存率:经股动脉途径者,无论有无血管并发症、以及血管并发症严重与否,生存率无显著差异;但经心尖部途径者,有血管并发症者的生存率(72.7%)显著低于无血管并发症组(90.7%),而严重血管并发症者的生存率仅61.1%(P<0.001)。该研究结论认为,经导管植入Edwards Sapien瓣膜术后30d的转归持续改善,超声心动图资料提示,血流动力学状态良好,而器材所致的显著主动脉瓣反流是有限的;欧洲记分与30d病死率有一定关系。进一步的随访研究、观察术后1年的预后将有助于完善新的危险记分方法。
Edwards SAPIENTM THV研究共报告了131例,结果表明,术后平均AVG显著降低,AVA显著增大,LVEF和NYHA心功能级别显著改善,生活质量显著提高。18个月的生存率:经股动脉途径者(71±6)%,经心尖部途径组为(41±6)%。需要永久起搏者为2%~10%。其他的研究结果也类似。
3 TMVR TMVA和二尖瓣装置的植入
3.1 二尖瓣反流的原因和机制 维持二尖瓣的正常功能,除瓣膜本身的完好外,瓣膜的附属装置——腱索和乳头肌的功能和结构也非常重要。左心房的扩大和二尖瓣环的扩张通常是导致二尖瓣反流的机械因素,当左心室扩大/扩张、心肌缺血、心室壁运动异常时,由乳头肌功能不全而导致二尖瓣反流(图2)。

图2 功能性二尖瓣反流的病因二尖瓣叶关闭不全
由于冠状静脉的心大静脉围绕二尖瓣环行走,可自冠状静脉窦植入器械“扎紧”和缩小二尖瓣环。
3.2 TMVR/TMVA/TMVI的方式和器材 (1)边缘对边缘(edge to edge):常用器材为eValve和Edwards Mobius。(2)经冠状窦瓣环成形/修复术:主要的器材有 Cardiac Dimensions,Edwards Monarc和Viacor。用两端带支架的“桥”,先释放并打开固定于冠状静脉(心大静脉)远端的1个支架,收紧“桥”使二尖瓣环缩小后释放且打开近端支架使“扎”住二尖瓣环的“桥”得以固定。(3)直接瓣环成形术:采用 Mitralign 、Guided Delivery Systems、Quantum Cor和 MiCardia。(4)非直接瓣环成形术:用Ample PS3、St.Jude和 i-Coapsys(图3)。(5)直接植入的二尖瓣装置(图4)。
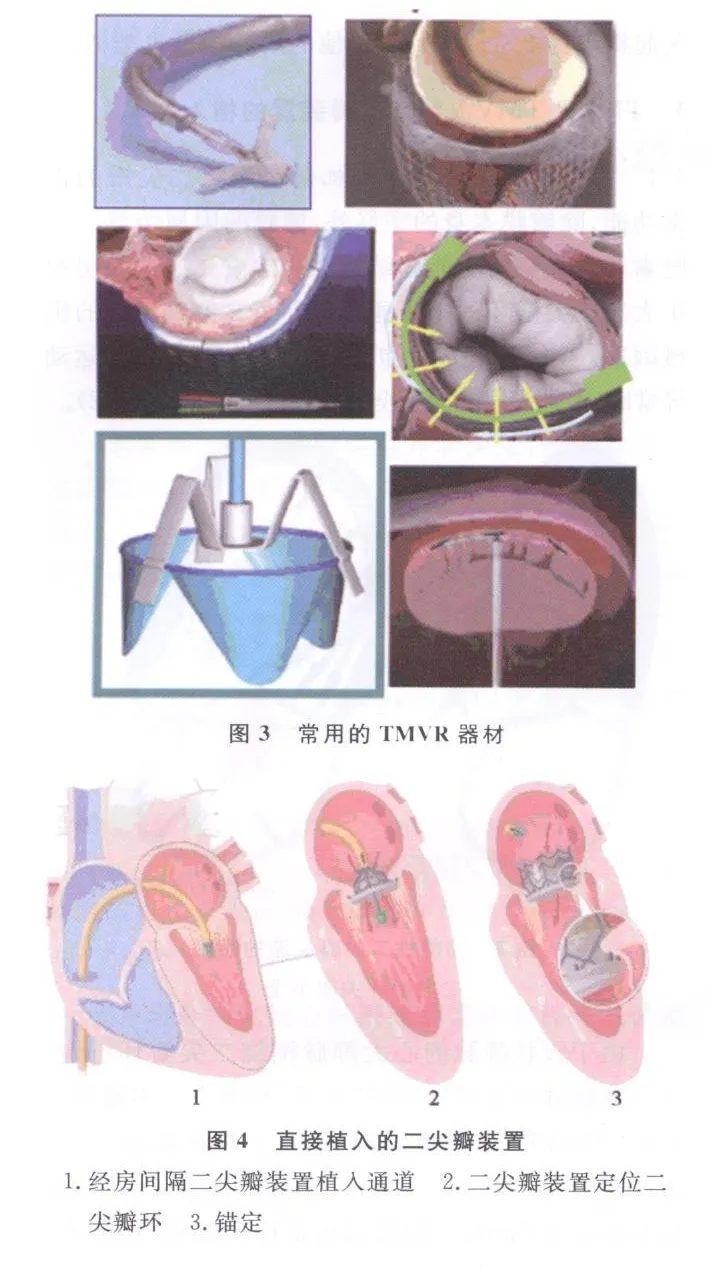
3.3 TMVR/TMVA/TMVI的疗效 2009年TCT报告了一组72例绝大部分为高危患者的结果表明,术后 6个月无事件生存率为 83%、1年为81%、2年为72%。随访2年,NYHA心功能级别显著改善、LVEF保持良好,二尖瓣反流的严重程度显著减轻。Liddicoat、Dubreuil和Sack等的报告结果均表明了TMVR/TMVA的优越效果和安全性。一组31例的结果表明,其中23例完成了操作,MR的程度由3.2±0.6减轻至2.0±0.96(P=0.0007),三维超声心动图检查结果表明二尖瓣环显著缩小。AMADEUS和TITAN研究采用Carillon TM的器材,113例有指征的意向者均为显著心脏扩大、心功能严重减退,17例未尝试操作,96例试图进行此操作者中,30例因为对减轻二尖瓣反流无作用、压迫冠状动脉、或因为器材上的“锚”滑动而不能固定等原因未完成操作。其中66例完成了 TMVR操作。未完成和完成操作的两组相比:术后30d的主要不良心脏事件发生率分别为13.0%和1.9%,死亡为2.2%和1.9%,急性心肌梗死为6.5%和0%,后者术后1、6个月二尖瓣反流显著减轻(P<0.001),NYHA心功能级别显著改善,6min步行试验显示运动耐力显著提高。同时,左心室舒张末期容积和收缩末期容积显著缩小,提示心室重塑得到显著改善。死亡相对风险亦较预计值降低 31%(P=0.004)。结果均显著优于未完成TMVR/TMVA操作组(P<0.001)。此临床研究的结论:TMVR/TMVA术后30 d的事件率显著降低,二尖瓣反流程度显著减轻,心功能、6 min步行耐力和生活质量显著改善,同时,可能有益于降低病死率、改善左心室重塑[8]。
采用MitraClip系统(图5)进行TMVR克服了外科手术对二尖瓣前后叶缝合产生的组织损伤和瓣膜活动的影响,而效果和转归与外科手术类似或更优。MitraClip系统由可操控引导导管、Clip推送系统和MitraClip装置组成。MitraClip有两个“臂”与二尖瓣的两个瓣叶相一致,每一个“臂”通过一定的摩擦力“钳”住两个瓣叶。在经食道超声心动图的引导下,由股静脉穿刺-房间隔穿刺心导管技术,将MitraClip推送至二尖瓣关闭线水平而定位固定于此。此装置已经通过北美系列研究评价。

图5 MitraClip系统
EVERESTⅠ研究和EVERESTⅡ研究分别评价了其安全性,并分别与传统标准外科手术二尖瓣修复或置换进行了比较。结果表明,最初的107例中,79%为退行性病变、21%系功能性瓣环扩张。出院时74%的患者由超声心动图评价的二尖瓣反流≤2级(其中77%<2级),16%≥2级;10%的患者因为Clip不能减少二尖瓣反流而没有完成植入操作。心功能级别:术后95%的患者改善或稳定,其中显著改善者73%;恶化占5%。术后12、24个月无事件生存率分别为95.9%、92.8%,显著高于外科手术组的88.5%和81.3%(P<0.001)。术后30 d的主要不良心脏事件率为9%,主要是与Clip无关的死亡、卒中各1例,需要输血的出血4例,持续用呼吸机48 h以上1例。
此研究的意义在于MitraClip组均为传统外科手术的高危患者,通常难以耐受传统外科手术,或者预计手术的效果很差。但因采用MitraClip而获得治疗机会。MitraClip系统是TMVR的首要技术,适合于治疗退行/钙化性和功能性二尖瓣反流,有限的研究资料表明能显著改善症状、减轻左心室重塑,且操作成功率高。对于传统外科手术高危者,更加安全、显著改善症状、减少因心力衰竭的住院。
类似的器械还有QuantumCor system,iCoapsys system,Mitralign Inc Annuloplasty system等。
3.4 二尖瓣反流的处理原则和指征 ACC/AHA对于严重二尖瓣反流患者的处理指南规定,二尖瓣手术临床适应证为:有症状或LVEF<60%或左室舒张末内径>40 mm,瓣叶周围具有可供支撑机械装置的边缘。患者没有风湿性或心内膜炎所致的二尖瓣脱垂、极严重的左心室功能不全(LVEF<20%)、或严重的左心室扩张(>60 mm)。均应先进行临床和超声心动图评价,如果无症状,则依据左心室功能:(1)左心室功能不全、LVEF≤60%,及(或)左室收缩末期内径≥40 mm,进行TMVR/TMVA/TMVI为Ⅰa类推荐。(2)左心室功能正常、LVEF>60%、左室收缩末期内径<40 mm者,如果有新发生的心房颤动、肺动脉高压,则进行 TMVR/TMVA/TMVI的推荐为Ⅱa;如果不能修复则进行外科手术二尖瓣置换;如果没有新发生的心房颤动和肺高压,患者希望进行 TMVR/TMVA/TMVI者,为Ⅱa类推荐;否则,每6个月进行临床和超声心动图评价。
4 经导管心脏瓣膜病介入治疗的趋势
4.1 器材的种类、结构和式样更新、增多 除进行经皮二尖瓣环成形术的器材外,对二尖瓣反流进行经皮修复的器材也日渐增多,如MitraClip系统、QuantumCor系统等,也有供直接植入的二尖瓣装置;经导管术植入的主动脉瓣带瓣支架的结构也在不断改进,包括通过球囊扩张和自膨胀等方式。
4.2 植入的途径多样 除常规经心脏导管术植入外,对周围血管径路有障碍者,可通过动脉鞘由心尖穿刺入左心室在经食道三维超声心动图引导下于导管室进行主动脉瓣带瓣支架植入,但因对心肌有一定创伤,并发症较经股动脉者多、术后病死率更高。
4.3 用途更广 除用于主动脉瓣、二尖瓣病变外,也有对三尖瓣病变者进行修复或植入瓣膜、以及用于治疗肺动脉瓣狭窄的成功经验和报告。
4.4 临床应用和发病机制研究更加广泛 对老年退行/钙化性瓣膜病的研究发现,其发病机理类似于动脉粥样硬化,但他汀类药物并不能抑制其病情进展;有报告认为瓣膜病变与某些基因异常表达有关;老年退行性/钙化性瓣膜病的进程中通常伴有炎症现象。
[1]Dubreuil O,Basmadjian A,Ducharme A,etal.Percutaneous mitral valve annuloplasty for ischemic mitral regurgitation:first in man experience with a temporary implant[J].Catheter Cardiovasc Interv,2007,69(7):1053-1061.
[2]Liddicoat JR,Mac Neill BD,Gillinov AM,et al.Percutaneous mitral valve repair:a feasibility study in an ovine model of acute ischemic mitral regurgitation[J].Catheter Cardiovasc Interv,2003,60(3):410-416.
[3]Sack S,Kahlert P,Bilodeau L,et al.Percutaneous transvenous mitral annuloplasty:initial human experience with a novel coronary sinus implant device[J].Circ Cardiovasc Interv,2009,2(4):277-284.
[4]Nowicki and Colleagues.Relative contribution of predictors to in-hospital mortality[C].Washington DC:TCT 2004.
[5]Gammie JS,Sheng S,Griffith BP,et al.Trends in mitral valve surgery in the United States:results from the Society of Thoracic Surgeons Adult Cardiac Surgery Database[J].Ann Thorac Surg,2009,87(5):1437-1439.
[6]Buchbinder M.Transcatheter aortic valve replacement[C].San Francisco:TCT 2009.
[7]Buchbinder M.The SOURCE REGIST RY[C].San Francisco:TCT 2009.
[8]Schofer J.Results with acute tensioning:From AMADEUS and TITAN to a US pivotal randomized trial(Cardiac dimensions CARILLON)[C].San Francisco:TCT 2009.

