Ni0.5Zn0.5Fe2O4铁氧体的制备及其催化性能
魏 磊
(山西大学化学化工学院,山西 太原 030006)
随着世界经济的发展,资源的大量消耗的同时,大量的CO2排向大气中,造成了严重的环境问题,如何消除这一问题便成了当前的一个重大社会问题。
1990年Tamaura等[1]首次报道用H2还原磁铁矿而制备的氧缺位磁铁矿Fe3O4-δ能将CO2直接转化成碳,CO2几乎100%转化成碳,Fe3O4-δ被CO2氧化而转变成Fe3O4,同时尖晶石结构得以恢复。这为模拟自然界中O2和CO2循环特别是O2循环原理,达到利用化学转化方法将CO2分解成O2和C提供了可能性,它也为解决密闭舱中CO2清除与转化问题的生命保障系统提供了新思路。
目前的研究主要是使用H2还原铁氧体制备氧缺位铁氧体催化剂,首先将CO2分解成碳,同时氧缺位铁氧体被CO2氧化成铁氧体,再通入氢气与碳生成CH4。
1 实验部分
1.1 Ni0.5Zn0.5Fe2O4铁氧体的制备
按照摩尔比分别称取镍、锌、铁的硝酸盐,用一定比例的无水乙醇和水溶解混合一定时间,氨水通过直接混合及滴加两种方式调节溶液pH为7.5,然后40℃温度搅拌24 h,得凝胶状棕色沉淀。产物经离心、醇洗脱水后得醇凝胶,以无水乙醇为介质进行超临界流体干燥,当达即可得到Ni0.5Zn0.5Fe2O4铁氧体气凝胶。
1.2 样品的表征
用日本岛津XRD-6000型X射线粉末衍射仪(XRD)测定晶体结构,CuKα射线,λ=1.542A,管电 40 kV,管电流 30 mA,扫描速度 5°/min,扫描范围 2θ=15°~75°。美国 Micromeritics公司ASAP2020物理吸附仪进行样品的低温氮吸脱附表征,根据BET方程计算比表面积。美国Lake Shore公司Lakeshore7410振动样品磁强计测量磁化强度,最大磁场为15000 Oe,根据外推法[2]计算比饱和磁化强度。
1.3 CO2甲烷化
选取催化剂于300℃焙烧后,进行压片、捣碎、过筛得到目数40~60范围内的样品,取1g的催化剂置入反应器[3]内。在N2气氛下,升温至 300℃并恒温;换气(N2+H2),控制流量 V(H2)及 V(N2)配比,一定时间后H2还原铁氧体可得到氧缺位铁氧体;此后开始 CO2的催化加氢,通入反应混合气(CO2+H2),控制流量 V(H2)与V(CO2)气体配比。TCD检测尾气含量。
2 结果与讨论
2.1 Ni0.5Zn0.5Fe2O4铁氧体的制备
反应温度40℃、醇-水比5:1时,通过直接与氨水混合调节pH为7.5,在不同超临界温度下,进行超临界干燥,恒温10 min。

图1 不同超临界温度得到的Ni0.5Zn0.5Fe2O4铁氧体XRD谱图
图1为不同超临界温度下得到的铁氧体的XRD图。图中所出现的(311)、(511)、(400)等衍射峰均为立方尖晶石结构的特征衍射[4],谱图未出现其他杂峰,基线规整,可知铁氧体的尖晶石结构完整。
图2是不同超临界温度制备的Ni0.5Zn0.5Fe2O4的磁滞回线,根据外推法是以磁化强度σ对外加磁场的倒数1/He作图,当1/He趋近于0时所求的σ值即为比饱和磁化强度σs,所得数据列于表1,可以看出,270℃及280℃时制备得到的铁氧体磁学性能较好,具有较高比饱和磁化强度。
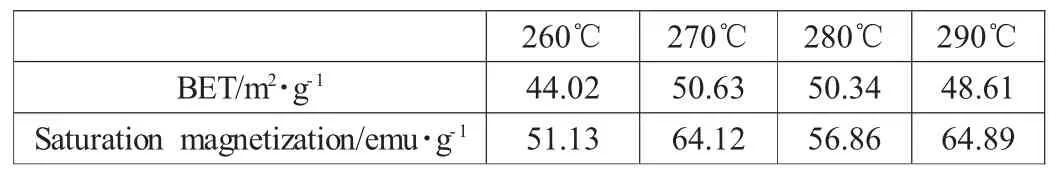
表1 不同超临界温度制备得到的Ni0.5Zn0.5Fe2O4铁氧体的性能

图2 不同超临界温度得到的Ni0.5Zn0.5Fe2O4铁氧体的磁滞回线
通过BET方程计算的比表面积也列在表1,可以看出当超临界温度在270℃时,可达到最大的比表面积,因此认为最佳的超临界温度应该为270℃。
2.2 催化CO2甲烷化
表2为超临界温度为270℃时制备的Ni0.5Zn0.5Fe2O4铁氧体进行CO2甲烷化的研究,可以看出其甲烷选择性为100%,且具有较高的CO2转化率。
3 总结
文章通过醇-水溶液加热法结合超临界流体干燥,制备得到晶相单一、比饱和磁化强度和比表面积都较高的尖晶石型Ni0.5Zn0.5Fe2O4铁氧体气凝胶。研究发现当超临界温度为270℃时,其比表面积达50.63 m2·g-1,比饱和磁化强度可达64.12emu·g-1。之后进行了催化CO2加氢甲烷化的实验,其CO2转化率可达27.43%,CH4选择性为100%。

表2 0.50.524铁氧体的催化甲烷化性能
[1]M.Tabata,Y.Tamaura.Complete reduction of carbon-dioxide to carbon using Cation-Excess magnetite[J].Nature,1990,346(19):255-256.
[2]Ahmed S R,Ogale S B,Papaefthymiou G C,et al.Magnetic properties of CoFe2O4nanoparticles synthesized through a block copolymer nanoreactor route[J].Appl.Phys.Lett.,2002,80(9):1616-1618.
[3]Kodama T,Sano T,Yoshida T,et al.CO2decomposition to carbon with ferrite-derived metallic phase at300℃ [J].Carbon,1995,33:1443-1447.
[4]Chen D H,He X R.Synthesis of nickel ferrite nanoparticles by sol-gel method[J].Mater.Res.Bull.,2001,36:1369-1377.

