不同产地白三叶种质遗传多样性的SRAP分析
张婧源,彭燕,罗燕,马啸
(四川农业大学草业科学系,四川 雅安625014)
相关序列扩增多态性(sequence-related amplified polymorphism,SRAP)是一种新型的基于聚合酶链式反应的标记系统,也称基于序列扩增多态性(sequence-based amplified polymorphism,SBAP)。是利用独特的引物设计对ORFs(open reading frames,开放阅读框架)进行扩增。由于SRAP技术简便、快速,不需预知物种的序列信息,故而近年来在植物遗传多样性分析[1]、种质鉴定[2]、遗传连锁图的构建[3]、基因连锁标记的寻找与基因定位[4]和比较基因组学研究[5]等方面得到广泛应用。目前在芸苔属(Brassica)[4]、南瓜属(Cucurbita)[6]、芍药属(Paeonia)[7]以及柿子(Diospyroskaki)等植物[8]已经展开SRAP标记的研究工作,并已取得了一定的成果。在草业上SRAP也已有了较多的应用,如野牛草(Buchloëdactyloides)[9]、垂穗披碱草(Elymusnutans)[10]和结缕草(Zoysiajaponica)[11,12]等草种,但就豆科(Leguminosae)植物而言,仅见于紫花苜蓿(Medicagosativa)[13]、花生(Arachishypogaea)[14]等少数植物。
白三叶(Trifoliumrepens)别名白车轴草、荷兰翘摇,为豆科(Leguminosae),三叶草属(Trifolium),全属在世界约有250余种,原产于欧洲、北非和亚洲西部,在温带及亚热带地区均有分布。为世界上分布最广的豆科牧草之一[15]。由于白三叶茎叶细软,叶量多,营养丰富,尤富含蛋白质,适口性好,刈牧兼用,耐践踏,再生性好等特点使其种植已遍布我国各地,尤其在长江以南地区大面积栽培,在长江中下游平原的鄂、湘、江、浙、皖等省,以及低山丘陵区的云、贵、川、广等省均有种植,是我国南方的当家豆科牧草[16]。国内外学者已通过形态标记、细胞学标记和同工酶生化标记等,对白三叶种质的遗传结构与生态型遗传分化及种质间遗传多样性进行研究[17-19]。由于分子标记技术简单、快捷、受环境影响小和可重复性强等优点,目前已被广泛应用在牧草遗传研究中,因此对白三叶种质资源的遗传多样性方面的研究也逐步深入到了分子水平。在国外,对白三叶的分子水平上的研究相对更多,Sharmas等[20]利用形态学和RAPD分子标记(随机扩增多态性DNA标记)对外来引进白三叶品种遗传多样性进行了分析,Gustine和Huff[21]利用RAPD标记分析了美国东北部3个州人工管理的多年生牧场中白三叶种群内和种群间的遗传变异,Joyce等[22]利用RAPD-PCR分子标记(基于聚合酶链式反应的随机扩增多态性DNA标记)对近缘杂交的白三叶的遗传多样性进行了分析,George等[23]利用SSR标记(串联重复序列DNA标记)检测了不同产地白三叶品种的遗传多样性,KÖlliker等[24]对白三叶进行了AFLP分子标记(扩增片段长度多态性DNA标记),Barrett等[5]更首次利用EST-SSRs(基于表达序列标签的串联重复序列DNA标记)制作了白三叶的完整基因连锁图;而国内对于白三叶在DNA分子遗传多样性方面的研究报告相对较少,随着白三叶在我国草地畜牧业、农业经济结构调整和生态环境建设等方面占有越来越重要的地位和作用,急切的需要开展更进一步的分子水平的白三叶种质资源遗传特性的基础研究。
本试验利用SRAP标记技术对来自5大洲的41份白三叶种质进行遗传多样性研究,目的在于:1)检测白三叶种质资源遗传多样性水平与地理来源的关系;2)分析白三叶种质资源的遗传多样性,为优良白三叶种质资源筛选提供依据;3)揭示白三叶种质资源的遗传结构及亲缘关系,为白三叶种质资源的保护、栽培利用以及核心种质的构建提供依据。
1 材料与方法
1.1 供试材料
供试的41份白三叶种质材料均来源于美国国家遗传资源库(United States Department of Agriculture),其中源自非洲的材料有8份、亚洲7份、大洋洲5份、欧洲13份、美洲6份、亚欧交界2份(表1)。每份材料取50粒种子,置于有盖培养皿内的吸水滤纸上萌发。萌发后的种子移栽至四川省眉山市洪雅县国家种质资源圃(东经102°49′~103°32′,北纬29°24′~30°00′,海拔2 800 m)种植。
1.2 白三叶基因组DNA提取
本试验于2009年7月进行。每份材料采用Saghai-Maroof等[25]的CTAB(十六烷基三甲基溴化铵)方法随机选取10~15个生长良好的单株的幼嫩叶片等量混合提取DNA。对比已知浓度的标准λDNA与样本DNA在0.8%(w/v)琼脂糖凝胶上的电泳图谱,计算出白三叶各种质材料的DNA浓度。将所有样本的基因组DNA用0.1×TE缓冲液[1 mmol/L Tris-HCl,0.1 mmol/L EDTA(乙二胺四乙酸),p H 8.0]稀释至10 ng/μL,储存于-80℃冰箱内,供SRAP扩增使用。
1.3 SRAP反应体系的建立及优化
参照前人发表的SRAP反应体系[26-28],利用单因素梯度组合试验的方法,得到优化后20μL SRAP反应体系:模板DNA 2μL(10 ng/μL),10×PCR Bufer 2μL,Mg2+2μL(25 mmol/L),d NTP 1.4μL(2.5 mmol/L),Taq DNA聚合酶0.4μL(2.5 U/μL),上、下游引物均为1μL(10μmol/μL),灭菌水补足20μL。
1.4 引物筛选和PCR反应
参照前人发表的引物[29-33],由9个上游引物和12个下游引物组合成108对SRAP引物序列,交由上海生物工程技术服务有限公司合成,选取4个DNA质量较高且田间试验性状差异较大的材料PI282379,PI404930,PI291841,PI440745对108对引物进行筛选,最终选出20对条带清晰、稳定性高、多态性好的引物用于全部材料进行PCR扩增,引物序列见表2。
PCR扩增程序参见Li和Quiros[4]的方法,采用以下程序:循环包括94℃变性5 min;94℃变性1 min,35℃复性1 min,72℃延伸1 min,共5个循环;之后35个循环:94℃变性1 min,50℃复性1 min,72℃延伸1 min,最后72℃延伸10 min;4℃保存。
1.5 电泳检测
扩增产物在6%聚丙烯酰胺凝胶上(丙烯酰胺∶甲叉=19∶1,7 mol/L尿素,1×TBE缓冲液)进行电泳检测。样孔中每样品点样10μL,以博瑞克公司的D2000 DNA梯度Marker为对照,先在北京六一电泳仪厂的DYY-6C电泳仪上进行200 V恒定电压下30 min的预电泳,然后在400 V恒定电压下电泳90~100 min,停止电泳后再用0.1%的Ag NO3进行银染色并在NaOH液中显色[29],凝胶在灯光下用高分辨率数码相机照相保存以供分析。
1.6 数据处理
对获得的清晰可重复的DNA条带进行统计,在相同迁移位置上,将稳定出现的有条带的记为1,无带的记为0,依次构成遗传相似矩阵。
据表征矩阵,统计SRAP扩增产物的条带总数和多态性条带数量,计算多态性位点百分率(PPB,percentage of polymorphic bands)、引物多态性信息含量(PIC,polymorphism information content)和Dice遗传相似系数(GS)
来估计各种质间的遗传多样性[30,34,35]。各遗传参数按以下公式计算:PPB=NPB/TNB,式中,TNB指总扩增的SRAP条带数(total number of bands),NPB指多态性条带数(number of polymorphic bands);PICi=2fi(1-fi),式中,PICi表示引物“i”的多态性信息含量,“fi”表示有带所占的频率,“1-fi”表示无带所占的频率,对每个引物组合而言,计算PIC应该求平均值,即PICav=∑PICi/N,这里N是各引物组合的多态性带数(NPB)[31];标记指数(MI,marker index)MI=NPB×PIC[23]。在 Hardy-Weinberg平衡的基础上,计算各种质材料 Nei基因多样性指数[33],利用 NTSYS-PC 2.10软件计算 Dice遗传相似性系数(GS),根据 UPGMA 法[36]进行聚类分系和主成分分析(PCo A)。
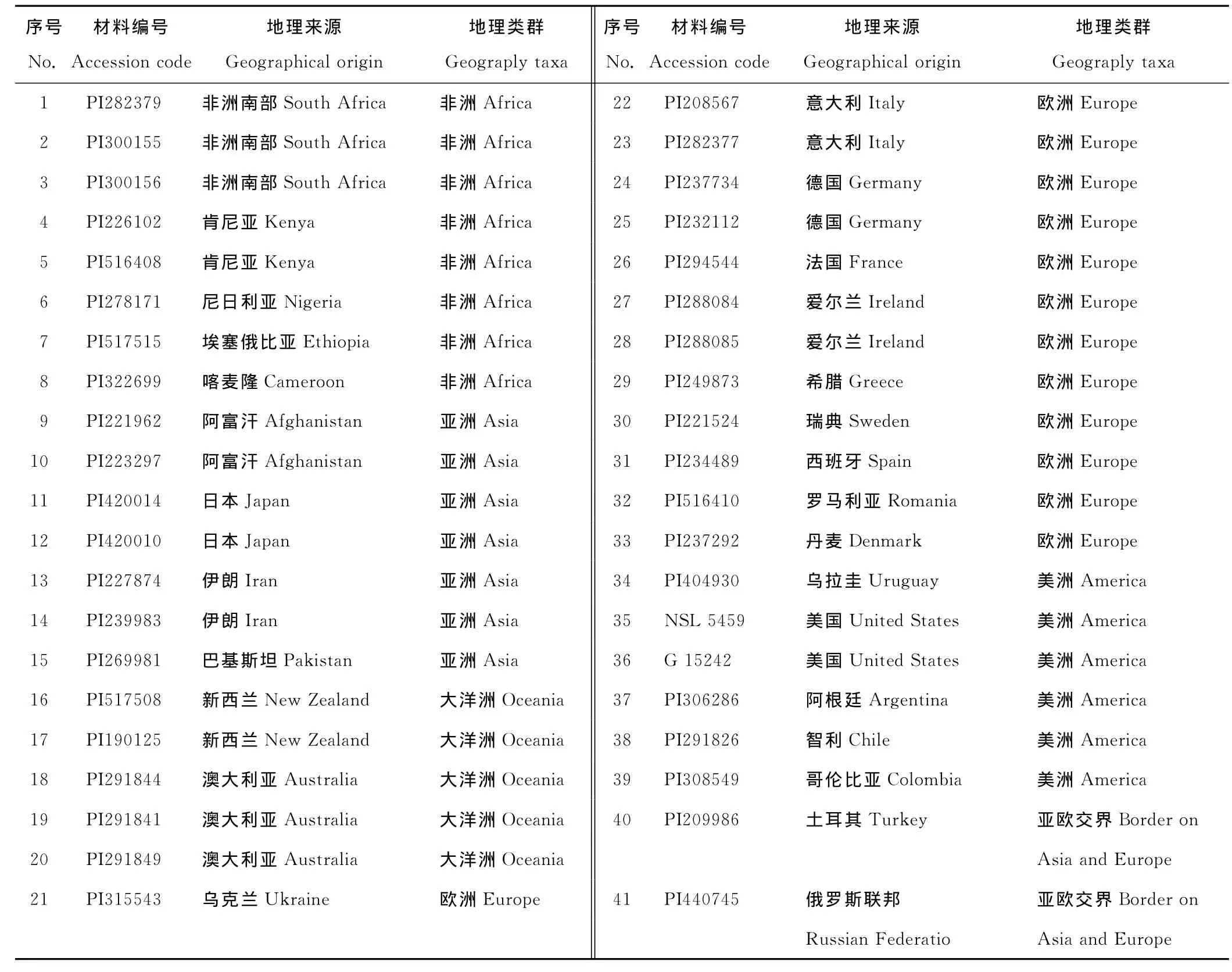
表1 供试材料及来源Table 1 The test materials and sources of T.repens
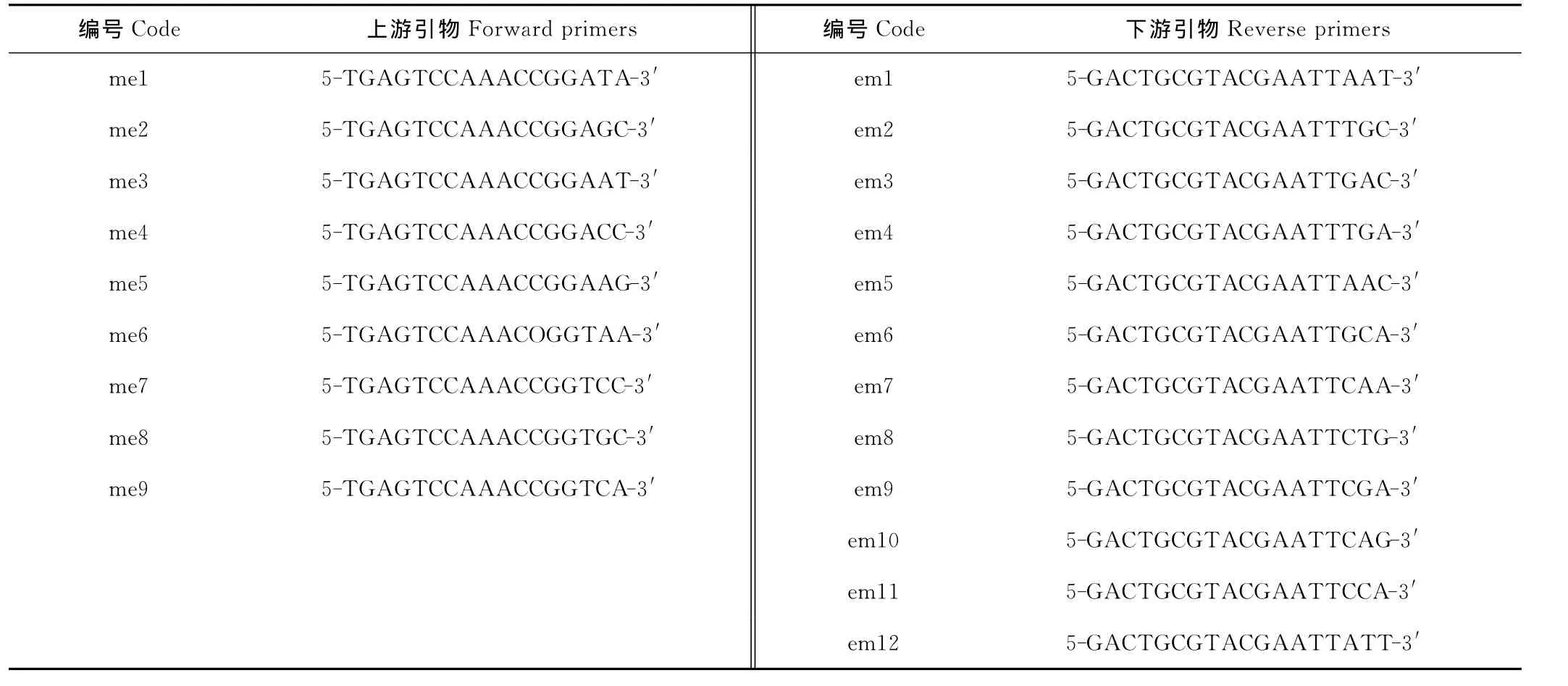
表2 用于白三叶SRAP分析的引物序列Table 2 Primer and sequences used in SRAP analyses of T.repens
以上参数计算分别在POPGENE 1.31、DCFA 1.1中进行。
2 结果与分析
2.1 供试白三叶SRAP扩增产物的多态性分析
从108对引物组合中筛选出20对条带清晰、多态性好的引物组合(表3)对41份白三叶基因组DNA进行PCR扩增,共得到479条清晰可辨的条带,平均每对引物组合扩增出23.95条带,me5+em9引物组合扩增出最多的44条带,而me4+em6组合扩增出的条带最少,仅有13条;多态性条带总数411条,平均每对引物扩增20.55条,引物的平均多态性位点百分率(PPB)为85.16%,不同的SRAP引物组合所揭示的参试材料的多态性信息含量(PIC)范围为0.182~0.334,平均为0.268;不同的SRAP引物组合的标记指数(MI)为2.185~11.068,平均为5.697。结果表明SRAP分子标记能检测出较多的白三叶遗传位点,获得多态性相对较好的PCR结果。
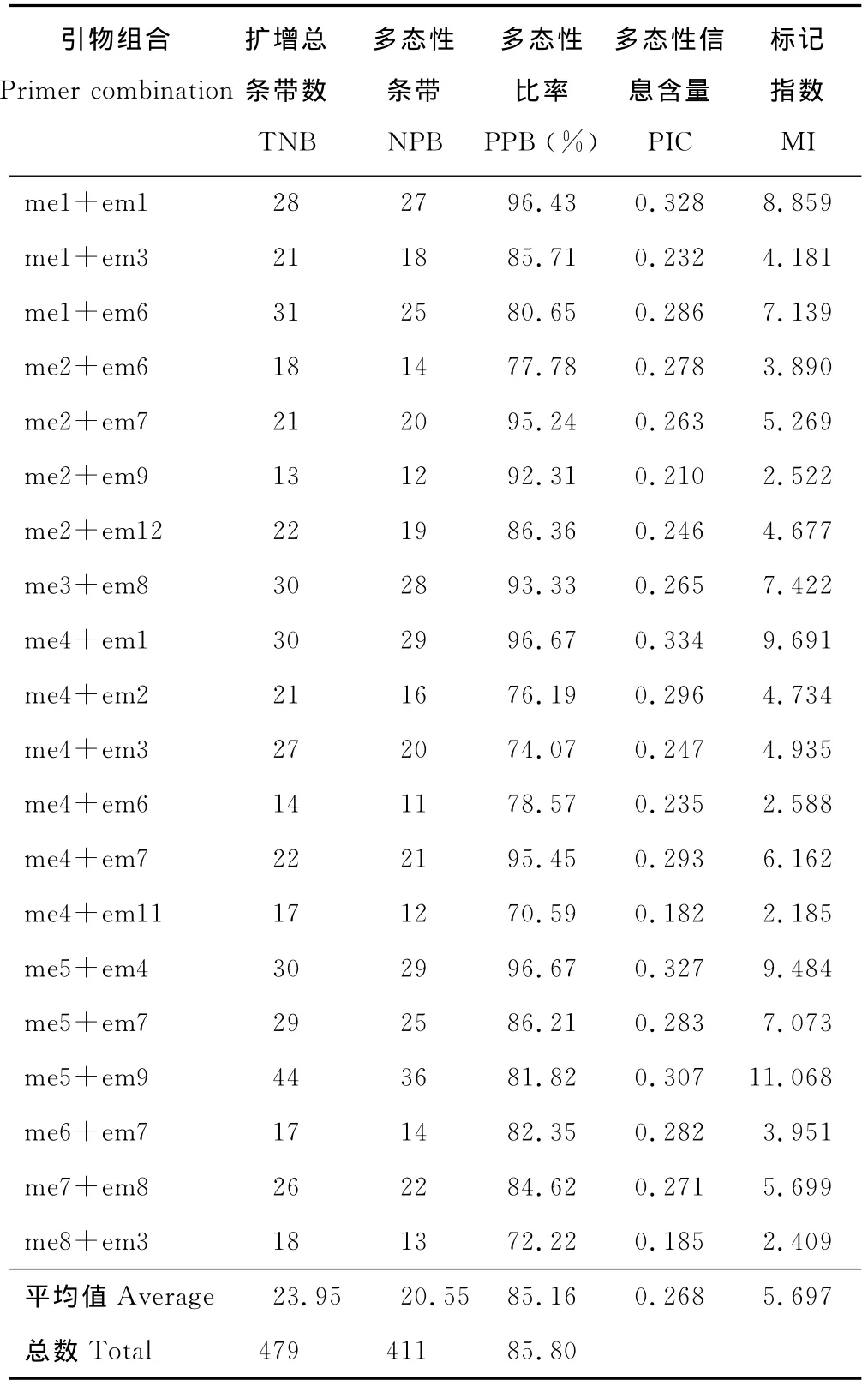
表3 白三叶SRAP分析的引物组合以及其序列扩增结果Table 3 Primer combinations and sequences used in SRAP analyses of T.repens
2.2 不同产地白三叶种质亲缘关系分析
对扩增结果用Nei-Li相似系数(GS)和遗传距离(GD)的计算方法,得到供试材料相似性矩阵。41份白三叶材料的 GS值为0.586 6~0.989 6,GS平均值为0.730 7,变幅为0.403,其遗传距离GD(1-GS)为0.010 40~0.413 40,平均为0.269 4。其中,来自非洲肯尼亚的PI516408与来自欧洲法国的PI294544之间的遗传距离最大,为0.413 4,表明它们之间的亲缘关系较远。而来自非洲南部的2份种质PI300155和PI300156之间的遗传距离最小,仅为0.010 4,表明这2份材料之间具有很近的亲缘关系。分析结果表明,供试材料之间差异明显,具有相对较远的亲缘关系。
2.3 不同产地白三叶种质的聚类分析
基于(Nei-Li)遗传相似系数,利用UPGMA法(非加权组平均法)构建了41份白三叶材料间的遗传关系聚类图(图1)。在遗传相似系数为0.71的水平上,可将供试白三叶种质分为3大类。其中,非洲、亚洲和大洋洲的20份材料聚为第Ⅰ类,该类大部分种质的形态及农艺性状表现为前期生长速度快、分蘖能力强、花期迟、完成生育期所需时间较短,植株相对高大,生态适应能力较强。该大类中源于非洲的8份材料,PI282379、PI300155、PI300156、PI226102、PI516408、PI278171、PI517515、PI322699优先聚为A亚类,然后源于大洋洲的5份材料,PI517508、PI190125、PI291844、PI291841、PI291849聚为B亚类,源于亚洲的7份材料,PI420014和PI420010,PI227874和PI239983以及PI221962、PI223297和PI269981分属于C、D、E亚类。来自欧洲和美洲的19份材料,PI237734、PI232112、PI294544、PI288084、PI288085、PI249873、PI221524、PI234489、PI516410、PI237292、PI315543、PI208567、PI282377、PI404930、NSL5459、G15242、PI306286、PI291826和PI308549聚为第Ⅱ类,该类主要特征表现为花期较早,植株低矮,叶片极小。而来自亚欧交界处的2份材料,PI209986和PI440745单独成为第Ⅲ类。这样的聚类结果揭示了供试材料的聚类与其形态特征、最初的地理来源以及地理分布存在一定相关性。
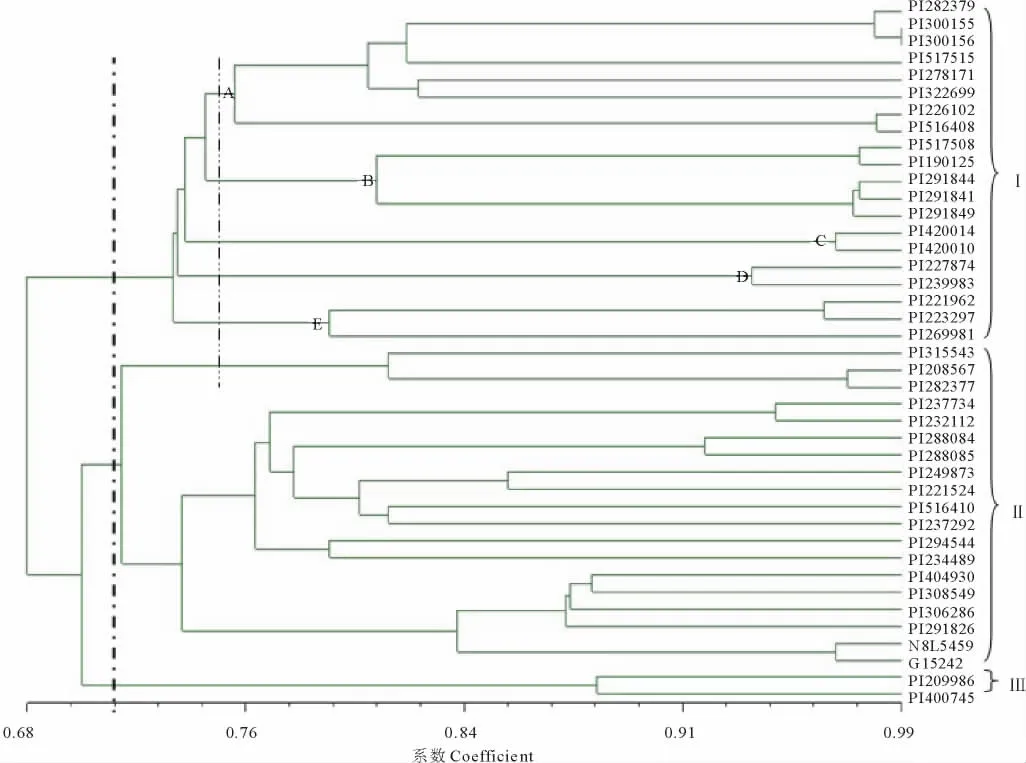
图1 41份白三叶种质基于Nei-Li相似系数的UPGMA聚类图Fig.1 UPGMA dendrogram for T.repens based on Nei-Li’s genetic similarity coefficients
2.4 供试材料的主成分分析
对41份白三叶材料的SRAP标记的原始矩阵进行主成分分析,前2个主成分所能解释的遗传变异分别为15.83%和8.16%,对41份种质做前2个主成分的三维排序图,位置靠近者表示关系密切,远离者表示关系疏远,将位置靠近的白三叶材料归为一类,可将供试材料分成3类,所形成的白三叶材料的位置分布图(图2)所示,主成分分析结果与聚类结果基本一致,同一地区的大部分白三叶材料基本能聚在一起,主成分分析的结果更直观地表明了不同白三叶材料之间的亲缘关系,是对聚类分析结果的直观解释和佐证。
3 讨论
3.1 SRAP分子标记对白三叶遗传多样性研究的有效性
本研究利用SRAP标记对41份白三叶种质进行遗传多样性的分析,结果表明,白三叶SRAP标记表现出较高的多态性,高于RAPD分子标记对三叶草属其他物种的研究,例如Kongkiatngam等[37]对不同地区红三叶栽培品种的RAPD分析研究中所选样本的PPB为69.6%,Ulloa等[38]对红三叶(Trifoliumpratense)的RAPD研究所得的PPB为74.2%,同时也高于同科植物紫花苜蓿的SRAP分析结果(PPB为83.88%)[39],这些差异可能是由于材料和研究方法的不同造成的。由此说明SRAP技术对白三叶的扩增具有较高的效率,适合对大规模白三叶种质的遗传变异检测,可作为白三叶新品种选育的早期选择及分子标记辅助育种的有力工具。

图2 41份白三叶种质基于Nei-Li相似系数的主成分分析Fig.2 The principal coordinate analysis(PcoA)of 41 T.repens based on Nei-Li’s genetic similarity coefficients
3.2 白三叶种质遗传变异与地理来源的相关性分析
遗传变异和地理环境之间的关系一直是植物遗传学研究中普遍关注的问题。本试验通过对41份来自世界各地不同大洲的白三叶材料的SRAP统计分析和聚类分析,证明供试白三叶种质呈现出一定地理来源分布规律和地域分布性规律,这也与Wilson等[40]的研究所得,种质的地理分布与分子标记间存在相关性的结论相符合。通过研究发现白三叶材料间存在着较高的遗传分化,而聚类分析把41份材料分为3大类,也揭示了3个与地理起源密切相关的遗传多样性资源群。从供试材料的聚类图可以看出,相似的生态环境或地理来源的白三叶种质能聚为一类,主要表现在来自美洲和欧洲的全部材料聚为第II类,这种聚类分析的结果可能与白三叶起源于欧洲,并由欧洲传入美洲有关,由于大陆间地形的相互阻隔造成了基因漂移的阻隔,加上相同起源地白三叶材料原有基因突变在物种进化过程中适应了各地域间海拔高度、土壤类型、气候特征和降水等方面存在的差异,从而使其固有的个别变异基因得以保存并延续下来,最终使不同来源地的白三叶材料间呈现出按起源地分布的规律,这一研究结果与谢国禄[41]的研究相一致。
与此同时第I类在GS为0.75时,来自非洲的全部材料和来自大洋洲的全部材料又分别聚为A、B 2个亚类,这说明白三叶种质资源呈现一定的地域分布规律,而造成这一结果可能是在白三叶材料的长期进化过程中由于所处生长环境的不同,地理类型、土壤酸碱度、年积温和年降水量、日照时数等生态环境因子的明显差异对白三叶生长期的自然选择造成一定影响,加上自然突变、人为选择等其他因素,使各方面都存在了一定的变异度,使得个体中发生的不定向变异导致群体遗传结果的定向变异,最终使同一地区材料的基因型趋近于相似。
另外部分聚类也非完全符合地理起源和地域性的分布规律,如来自亚洲的所有材料在GS为0.75时就分别聚成了C、D、E 3个亚类,造成这种聚类划分的现象可能有以下方面的原因:1)白三叶是异花授粉植物,花粉间的窜粉可能导致天然杂交现象的出现;2)本研究的材料来源于生境差别较大,其光照、降水、年均温等气候条件以及土壤、海拔、经纬度、洋流等生境条件存在差异,因此可能阻碍种质间的基因漂移,从而造成了较明显的遗传差异,这也符合聚类结果与生境表现出一定的相关性[42]的研究结论;3)由于自然选择所造成的选择压力也可能导致生境相距存在差异的种质产生遗传变异,加上人类活动以及利用方式的不同都可能导致其个别基因发生变异[43],从而形成遗传的多样性,这也符合聚类的结果反映出自然和人工选择的深刻影响[14]的研究结论。
这一研究结果为今后制定世界范围内白三叶资源遗传多样性原位保护措施、保护范围以及白三叶品种改良中亲本选择、发掘新的抗逆基因提供了重要参考。针对白三叶所潜藏的巨大的可选择利用的优异性状,应充分发掘其原生种质的遗传潜力,培育出更多适应性更强,农艺性状更优良的品种。
[1]姜树坤,马慧,刘君,等.利用SRAP标记分析玉米遗传多样性[J].分子植物育种,2007,5(3):412-416.
[2]张建成,王传堂,焦坤,等.SRAP标记技术在花生种子纯度鉴定中的应用[J].中国农学通报,2005,21(12):35-39.
[3]赵丽萍,柳李旺,龚义勤,等.萝卜品种指纹图谱SRAP与AFLP分析[J].植物研究,2007,27(6):687-684.
[4]Li G,Quiros C F.Sequence-related amplified polymorphism (SRAP),a newmarker system based on a simple PCR reaction:Its application tomapping and gene tagging in Brassica[J].Theoretical and Applied Genetics,2001,103:455-461.
[5]Barrett B,Griffiths A,Schreiber M,etal.A microsatellite map of white clover[J].Theoretical and Applied Genetics,2004,109(3):596-608.
[6]Ferriol M,Pico B,Nuze F.Genetic diversity of a germplasm collection ofCucurbitapepousing SRAP and AFLP markers[J].Theoretical and Applied Genetics,2003,107:271-282.
[7]Han X Y,Wang L S,Shu Q Y,etal.Molecular characterization of tree peony germplasm using sequence-related amplified polymorphism markers[J].Biochemical Genetics,2008,46:162-179.
[8]Guo D L,Luo Z R.Genetic relationships of some PCNA persimmons(DiospyroskakiThunb.)from China and Japan revealed by SRAP analysis[J].Genetic Resources and Crop Evolution,2006,53:1597-1603.
[9]Budak H,Shearman R C,Parmaksiz I,etal.Molecular characterization of buffalograss germplasm using sequence-related amplified polymorphism markers[J].Theoretical and Applied Genetics,2004,108:328-334.
[10]陈智华,苗佳敏,钟金城.野生垂穗披碱草种质遗传多样性的SRAP研究[J].草业学报,2009,18(5):192-200.
[11]陈宣,郭海林,薛丹丹.结缕草属植物耐盐性SRAP分子标记研究[J].草业学报,2009,18(2):66-75.
[12]郭海林,郑轶琦,陈宣.结缕草属植物种间关系和遗传多样性的SRAP标记分析[J].草业学报,2009,18(5):201-210.
[13]Vandemark G J,Ariss J J,Bauchan G A,etal.Estimating genetic relationships among historical sources of alfalfa germplasm and selected cultivars with sequence related amplified polymorphisms[J].Euphytica,2006,152:9-16.
[14]张建成,王传堂,焦坤,等.SRAP标记技术在花生种子纯度鉴定中的应用[J].中国农学通报,2005,12(21):35-39.
[15]董宽虎,沈益新.饲草生产学[M].北京:中国农业出版社,2003:78-79.
[16]陈宝书.牧草饲料作物栽培学[M].北京:中国农业出版社,2001:224.
[17]切彩.11分白三叶材料形态特征及其同工酶和种子贮藏蛋白遗传多样性研究[D].乌鲁木齐:新疆农业大学,2009.
[18]杨珍.高加索三叶草鱼白三叶草及其杂交胚立体培养技术的研究[D].呼和浩特:内蒙古农业大学,2008.
[19]杨珍,何丽君,王明玖.高加索三叶草×白三叶胚萌发条件的探索[J].草业科学,2009,26(1):50-54.
[20]Sharmas T R,Singh R K,Chahota R,etal.Analysis of genetic diversity in white clover(Trifoliumrepens)accessions using agro-morphological and RAPD markers[J].Journal of Genetics & Breeding,2005,59:3-4.
[21]Gustine D L,Huff D R.Genetic variation within and among white clover populations from managed permanent pastures of the Northeastern USA[J].Crop Science,1999,39:524-530.
[22]Joyce T A,Abberton M T,Michaelson-Yeates T P T,etal.Relationships between genetic distance measured by RAPD-PCR and heterosis in inbred lines of white clover(TrifoliumrepensL.)[J].Euphytica,1999,107(3):159-165.
[23]George J,Dobrowolski M P,Van-Zijll-de-Jong E,etal.Assessment of genetic diversity in cultivars of white clover(TrifoliumrepensL.)detected by SSR polymorphisms[J].Genome,2006,49:8.
[24]KÖlliker R,Hones E S,Jahufer M Z Z,etal.Bulked AFLP analysis for the assessment of genetic diversity in white clover(TrifoliumrepensL.)[J].Euphytica,2001,121:305-315.
[25]Saghai-Maroof M A,Soliman K M,Jorgensen R A.Ribosomal DNA pacer-length polymorphisms in barely:Ribosomal inheritance,chromosomal location,and population dynamics[J].Proceedings of the National Academy of Sciences of the United States of America,1984,81:801.
[26]王志勇,袁学军,刘建秀,等.狗牙根SRAP-PCR反应体系优化及引物筛选[J].草业学报,2008,3(17):79-85.
[27]薛丹丹,郑轶琦,王志勇,等.结缕草属植物SRAP-PCR体系的建立和优化[J].草业学报,2008,6(17):93-101.
[28]易杨杰,张新全,黄琳凯,等.野生狗牙根种质遗传多样性的SRAP研究[J].遗传,2008,30(1):94-100.
[29]许绍斌,陶玉芬,杨昭庆,等.简单快速的DNA银染和胶保存方法[J].遗传,2002,24(3):335-336.
[30]Roldan-Ruiz I,Dendauw J,Van Bockstaele E,etal.AFLP markers reveal high polymorphic rates in ryegrasses(Loliumspp.)[J].Molecular Breeding,2000,6:125-134.
[31]Archak S,Gaikwad A B,Gautam D,etal.Comparative assessment of DNA fingerprinting techniques(RAPD,ISSR and AFLP)for genetic analysis of cashew (AnacardiumoccidentaleL.)accessions of India[J].Genome,2003,46:362-369.
[32]Powell W,Morgante M,Andre C,etal.The comparison of RAPD,AFLP and SSR(microsatellite)marker for germplasm analysis[J].Molecular Breeding,1996,2:225-238.
[33]车永和,李立会,何蓓如.冰草属植物遗传多样性取样策略基于醇溶蛋白的研究[J].植物遗传资源学报,2004,5:216-221.
[34]冯宗云,李宏,张立立,等.西藏野生大麦醇溶蛋白的遗传多样性[J].四川大学学报,2004,41:440-445.
[35]车永和,李立会,何培茹.冰草属(AgropyronGaertn.)植物遗传多样性取样策略基于醇溶蛋白的研究[J].植物遗传资源学报,2004,5:216-221.
[36]Rohlf F J.NTSYS-pc.Numerial Taxonomy and Multivariate Analysis System (Version 2.0)[M].New York:Exter Softwere,1994.
[37]Kongkiatngam P,Waterway M J,Fortin M G,etal.Genetic variation within and between two cultivars of red clover(TrifoliumpratenseL.)-Comparisons of morphological,isozyme,and RAPD markers[J].Euphytica,1995,84:237-246.
[38]Ulloa O,Ortega F,Campos H.Analysis of genetic diversity in red clover(TrifoliumpratenseL.)breeding populations as revealed by RAPD genetic markers[J].Genome,2003,46(6):529-535.
[39]关潇.野生紫花苜蓿种质资源遗传多样性研究[D].北京:北京林业大学,2009.
[40]Wilson B L,Kitzmiller J,Rolle W,etal.Isozyme variation and its environmental correlates inElymusglaucusfrom the California Floristic Province[J].Canadian Journal of Botany-revue Canadienne de Botanique,2001,79:139-153.
[41]谢国禄.北美白三叶草收集种和品种的RAPD标记遗传变异[J].Crop Science,2002,42(2):342-347.
[42]安晓珂.三叶草属三种植物遗传多样性的RAPD分析[D].北京:中国农业科学院,2008.
[43]Bortolini F,Agnol M D,Schifino-Wittmann M T.Molecular characterization of the USDA white clover(TrifoliumrepensL.)core collection by RAPD markers[J].Genetic Resources and Crop Evolution,2006,53:1081-1087.

