籽粒苋幼苗对不同盐离子胁迫响应的比较研究
李洪燕,郑青松,姜超强,刘兆普,刘国红,辛本荣
(南京农业大学资源与环境科学学院 江苏省海洋生物学重点实验室,江苏 南京210095)
全世界盐渍土面积为9.54×108hm2,我国各类盐渍土总面积约0.99×108hm2[1]。盐胁迫对植物造成危害主要是离子毒害、渗透胁迫和营养不平衡[2,3]。一般认为NaCl是造成盐害的主要物质,离子毒害主要涉及Na+和Cl-,但在盐胁迫下,作物对Na+和Cl-的敏感程度不同。有研究表明NaCl对水稻(Oryzasativa)、大麦(Hordeumvulgare)等的胁迫作用主要是由 Na+引起的[4],而对柑橘(Citrusreticulata)、大豆(Glycinemax)等的胁迫作用主要由Cl-引起的[5,6]。目前,盐胁迫下植物生理及分子生物学研究多集中在Na+上,如Na+对植物离子平衡的影响以及其在植物体内吸收转运等[7-10],而关于植物必需的微量营养元素Cl-的研究很少[11],Cl-虽然是植物必需的微量元素之一,但在盐胁迫下其含量远超过植物正常生长所需,研究表明,盐渍下大豆幼苗呈现出的叶片枯萎和生物量显著降低就是由于Cl-过量诱导的毒害[6]。在绝大多数有关植物耐盐性的研究中,因为盐渍胁迫均包括Na+和Cl-离子,因此很难区分出不同的离子效应。
维持细胞内渗透调节(osmoregulation)、离子稳态(ion homeostasis)等是多数植物盐适应的重要机制[4,7,12,13]。近年来对盐胁迫下植物的生理代谢调节方面的研究表明,NaCl胁迫下保持植物叶片细胞中较高K+浓度是植物耐盐性的重要方式之一,植物耐盐性还与植株地上部对Na+和Cl-积累的限制力及高K+/Na+保持能力有关[3,14];盐碱胁迫下,紫花苜蓿(Medicagosativa)游离脯氨酸和可溶性糖等渗透调节物质增加,从而增强其渗透调节能力[15];叶绿素是重要的光合作用色素,其含量高低与光合作用密切相关,对盐胁迫下叶绿素含量的变化存在不同观点[16,17],光合作用为植物的生长发育提供物质和能量,是植物生长发育的基础,植物的生长和产量的高低与光合性能直接相关。因此,探讨盐分胁迫下植物的光合特性及植株离子吸收分布情况,对阐述植物的耐盐性具有重要意义。
籽粒苋(Amaranthusspp.)是苋科(Amaranthus)苋属(Amaranthceae)的一年生草本植物,起源于中南美洲及东南亚地区[18]。籽粒苋营养价值高、抗逆性强、适应性广、生长快、产量高,是目前世界上被誉为最有发展潜力的一年生粮食、饲料、蔬菜、绿肥、医药等多种用途的新型农作物[19-21]。目前国内外对籽粒苋的种植技术推广,食品和饲料营养价值,富钾机理等方面已有一些研究[22,23],但作为传统的耐盐牧草[24],籽粒苋对盐渍的适应性研究却很少。本研究着重探讨籽粒苋幼苗对不同盐离子处理下的生长、光合和离子分配等效应,以期为籽粒苋的盐土种植和发展滩涂海水灌溉农业等提供理论依据。
1 材料与方法
1.1 试验材料和试验设计
试验于2009年4-6月进行,籽粒苋(A.hypochondriacus)种子用0.1%HgCl2消毒5 min后,蒸馏水洗净并浸种24 h,然后放入垫有吸水纸的瓷盘内催芽,挑选露白一致的种子播种于装有石英砂下部有孔的塑料盆中,自然光照,用Hoagland培养液浇灌。籽粒苋幼苗长至2叶期时,进行疏苗,每盆保留1株,至4叶时转入不同处理。本试验设置3个等渗浓度(-0.096,-0.198,-0.437 MPa)的Na、Cl和NaCl溶液处理,处理设计参照文献[25,26],具体见表1,每个处理8盆,处理期间每2 d换1次营养液,每天以预定浓度的处理液浇灌,为减少砂培介质中NaCl浓度变化,处理液浇灌量为砂子持水量的4倍,约3/4的溶液流出,从而将积余的盐冲洗掉,以保持NaCl的浓度恒定。处理10 d测定各处理籽粒苋有关生理生化指标。试验处理期间,采用自然光照培养,最高日温25~30℃,最低夜温20~25℃。溶液渗透势用上海医大仪器厂生产的FM-8P型全自动冰点渗透压计测定。

表1 处理液配方Table 1 Treatment liquid formula
1.2 测定方法
1.2.1 植株生长速率测定 在处理前和处理10 d后测量每个处理的株高,生长速率为处理前后每天株高的增加量。
1.2.2 植株干物质量测定 将籽粒苋整株取出后先用自来水清洗,然后用去离子水洗净并用吸水纸吸干水分,烘箱105℃杀青5 min后于70℃烘箱烘至恒重,称重。
1.2.3 叶绿素含量测定 叶绿素按照文献[27]测定。取新鲜植物叶片0.5 g,加5 m L 80% 的丙酮溶液,仔细研磨成匀浆,快速过滤,以80% 的丙酮溶液反复冲洗研钵和滤纸,配制成25 m L溶液,置于暗处备用,以80% 的丙酮溶液作为对照,在663和645 nm下测定吸光值。
1.2.4 光合作用参数测定 在处理的第10天(晴天)9:30-11:30,用Li-6400光合仪(LI-COR,Inc.,USA)通过叶室夹住叶片进行活体测定,叶室温度为25℃,光强为1 000μmol/(m2·s),CO2浓度为400μmol/mol。测定叶片的净光合速率(Pn),气孔导度(Gs),胞间CO2浓度(Ci),蒸腾速率(Tr)等相关参数。水分利用效率(WUE)为Pn/Tr计算值[28],气孔限制值(Ls)为1-Ci/Ca(Ca为大气CO2浓度)[29]。
1.2.5 无机离子的测定 K+、Na+、Cl-含量的测定参照文献[30,31]。烘干至恒重的植株样品磨碎过0.3 mm筛,精确称取50 mg干样放入25 m L刻度带塞大试管中,加入20 m L去离子水,摇均后置沸水浴中1.5 h,冷却后过滤定容至50 m L容量瓶中备用。其中K+、Na+用上海分析仪器厂6400型火焰光度计测定,Cl-含量采用Ag NO3滴定法,用含4.2%(w/v)铬酸钾(K2Cr O4)和0.7%(w/v)重铬酸钾 (K2Cr2O7)的中性指示剂。离子吸收或运输的选择性(SK,Na)=库器官{[K+]/[Na+]}/源器官{[K+]/[Na+]}[32]。单位中FW 为鲜重,DW 为干重。
1.3 数据处理统计方法
运用SPSS软件对数据进行统计分析,以Duncan新复极差法对不同处理结果进行显著性检验。
2 结果与分析
2.1 NaCl、Na和Cl处理对籽粒苋幼苗干重及生长速率的影响
在不同的处理溶液渗透势下,不同盐胁迫对籽粒苋幼苗干重的影响各不相同(图1A)。-0.096和-0.198 MPa的NaCl和Na盐处理的幼苗干重与对照相比差异不显著,而-0.096和-0.198 MPa的Cl盐显著增加了籽粒苋幼苗的干物质量的积累,分别比对照增加40%和13%;-0.437 MPa的NaCl、Na和Cl盐处理下,籽粒苋幼苗干重均比对照显著降低,分别降低44%,46%和27%。-0.096 MPa的各处理液下,生长速率的变化与单株干重的变化趋势相同(图1B);-0.198 MPa的NaCl、Na盐处理,显著降低了籽粒苋幼苗的生长速率,NaCl、Na盐处理下,分别降低16%和41%,而Cl盐处理的籽粒苋幼苗生长速率与对照相比差异不显著;-0.437 MPa的各溶液处理下,其生长速率均比对照显著降低,NaCl、Na和Cl处理下,分别降低57%,69%和46%。
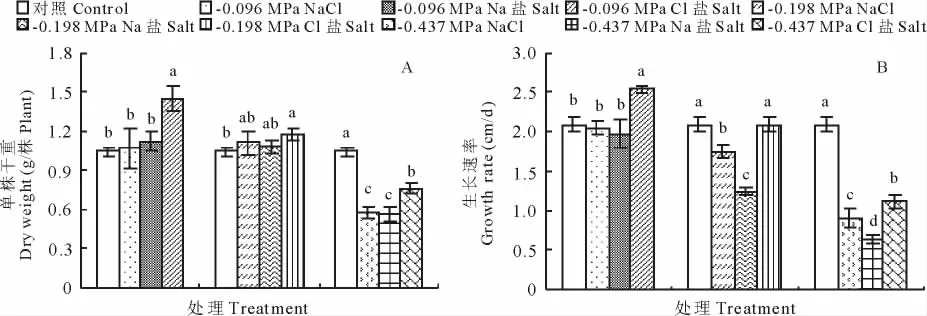
图1 等渗的NaCl、Na和Cl盐对籽粒苋幼苗单株干重(A)和生长速率(B)的影响Fig.1 Effects of iso-osmotic treatments of NaCl,Na-salt and Cl-salt on plant dry weight(A)and growth rate(B)of grain amaranth seedlings
2.2 NaCl、Na和Cl盐对籽粒苋幼苗叶绿素含量的影响
与对照相比,NaCl、Na和Cl盐胁迫均不同程度的降低了籽粒苋幼苗叶绿素的含量,其中在各渗透势下Na盐对叶绿素含量的影响最小,-0.096和-0.198 MPa Na盐处理的幼苗叶绿素含量与对照差异均不显著;而Cl盐的影响最大,-0.096,-0.198和-0.437 MPa Cl盐胁迫下,幼苗叶绿素含量与对照相比分别下降了44%,20%和36%。而-0.198和-0.437 MPa的不同盐处理下,籽粒苋幼苗叶绿素含量差异均不显著(图2)。
2.3 NaCl、Na和Cl盐对籽粒苋幼苗光合作用特性参数的影响
-0.096 MPa渗透胁迫下,Na盐处理促进其Pn,而NaCl和Cl盐处理的Pn和对照均不显著(表2);随着盐浓度的增加,-0.198 MPa下,所有盐处理的籽粒苋幼苗Pn与对照相比差异均不显著;在-0.437 MPa NaCl、Na和Cl盐处理下均显著降低,其Pn分别为对照的63%,43%和75%。-0.096和-0.198 MPa Cl盐显著提高籽粒苋幼苗的蒸腾速率(Tr),而-0.096和-0.198 MPa NaCl和Na盐以及-0.437 MPa Cl盐处理的Tr与对照差异不显著,-0.437 MPa NaCl和Na盐处理下,籽粒苋幼苗的Tr显著下降,分别降低16.8%和39.8%。-0.096 MPa渗透胁迫下,所有处理的幼苗的气孔导度(Gs)均与对照差异不显著,-0.198 MPa渗透胁迫下,所有处理的幼苗的气孔导度均显著下降,但盐处理间无差异,-0.437 MPa NaCl、Na和Cl盐处理下其Gs进一步显著下降,分别降低48.7%,66.8%和41.3%。除了-0.096 MPa Na盐处理下,其他所有盐处理的胞间CO2浓度(Ci)均显著下降,并随着渗透势的降低呈逐渐显著降低趋势。
2.4 NaCl、Na和Cl盐对籽粒苋幼苗水分利用效率(WUE)及气孔限制值(Ls)的影响
随着盐度的增加,不同盐处理下,水分利用率均呈下降趋势(图3A),就同一渗透势而言,-0.096和-0.198 MPa的NaCl和Na盐处理对籽粒苋幼苗的WUE影响均不显著,而Cl盐处理使其显著减小。-0.437 MPa的NaCl、Na盐、Cl盐处理均使籽粒苋幼苗的WUE显著降低,不同盐处理间差异不显著。Ls的变化与水分利用率不同(图3B),-0.096 MPa的NaCl和Cl盐处理下,Ls显著增加,随着盐度的增加,所有盐处理下的植株叶片Ls均显著增加。
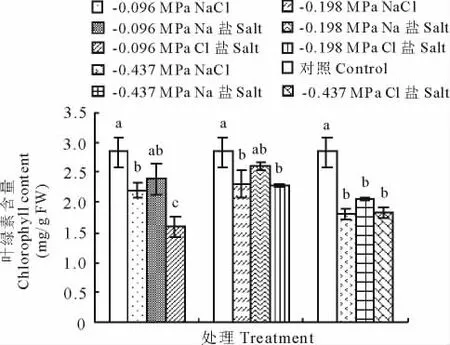
图2 等渗的NaCl、Na和Cl盐对籽粒苋幼苗叶绿素含量的影响Fig.2 Effects of iso-osmotic treatments of NaCl,Na and Cl salt on chlorophyll content of grain amaranth seedlings
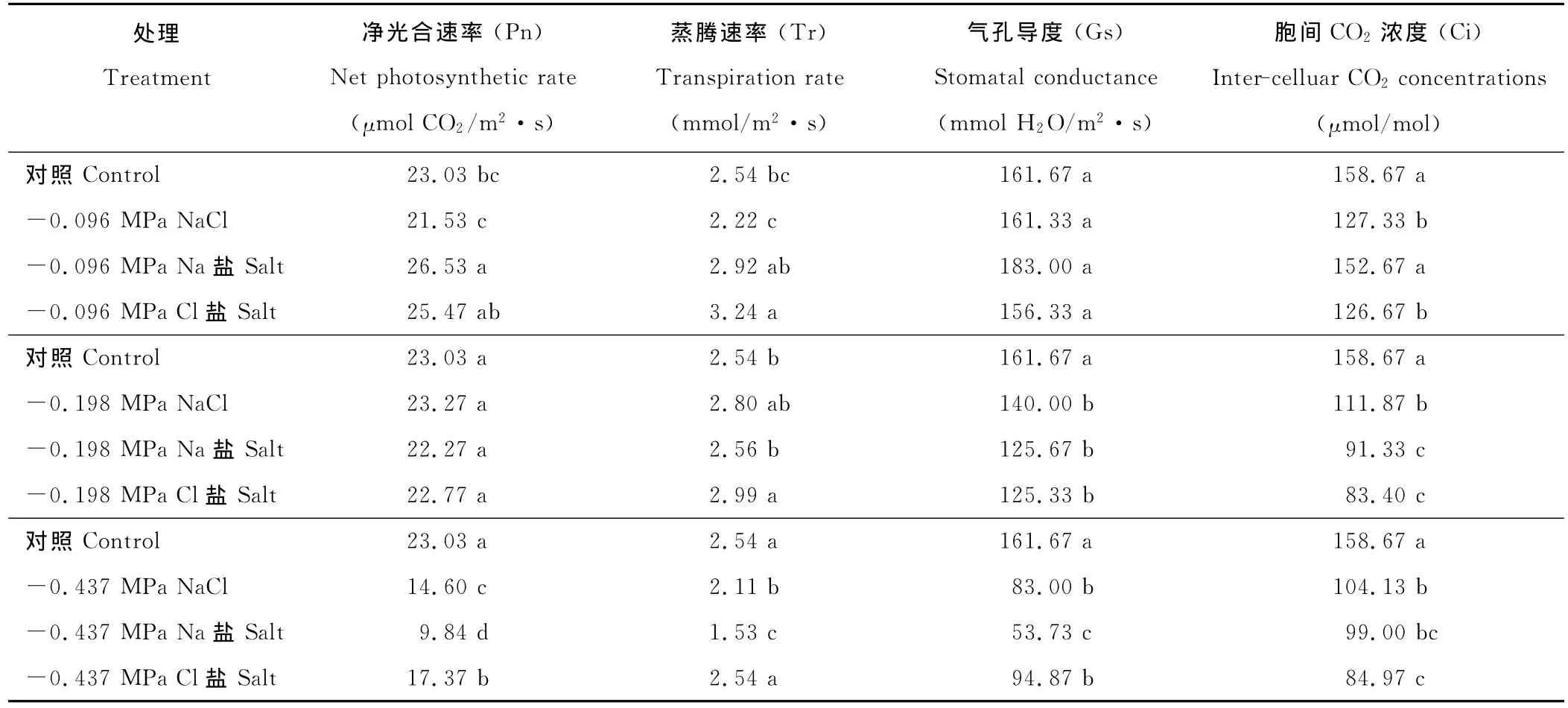
表2 等渗的NaCl、Na盐和Cl盐对籽粒苋幼苗光合作用特性参数的影响Table 2 Effects of iso-osmotic treatments of NaCl,Na and Cl salt on photosynthesis characteristics parameters of grain amaranth seedlings
2.5 NaCl、Na盐和Cl盐对籽粒苋幼苗K+、Na+、Cl-吸收分布的影响
不同盐胁迫下籽粒苋幼苗K+含量在各个器官中的分布不同,根部K+含量NaCl、Na盐胁迫下显著低于对照,而Cl盐胁迫下显著高于对照,茎和叶K+含量在各胁迫下均显著高于对照(表3);等渗条件下,根和茎中K+含量均以Cl盐胁迫下最高;NaCl、Na盐胁迫下,籽粒苋幼苗根、茎、叶中Na+含量均显著高于对照,并随着盐浓度的提高而增大;而Cl盐胁迫下,各器官中Na+含量多与对照差异不显著。-0.437 MPa NaCl处理下,根、茎、叶中 Na+含量分别为对照的6.7,8.8和3.8倍,Cl-含量分别为对照的4.3,6.9和1.8倍;-0.437 MPa Na盐处理下,根、茎、叶中 Na+含量分别为对照的6.6,10.0和4.8倍,-0.437 MPa Cl盐处理下,根、茎、叶中Cl-含量分别为对照的7.8,11.0和3.6倍。
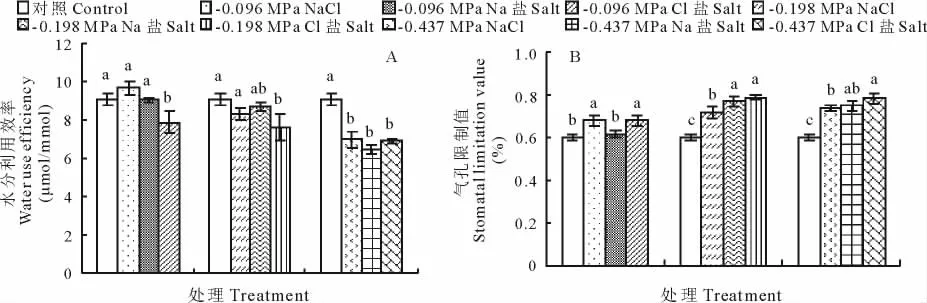
图3 等渗的NaCl、Na盐和Cl盐对籽粒苋幼苗WUE(A)和Ls(B)的影响Fig.3 Effects of iso-osmotic treatments of NaCl,Na and Cl salt on WUE(A)and Ls(B)of grain amaranth seedlings
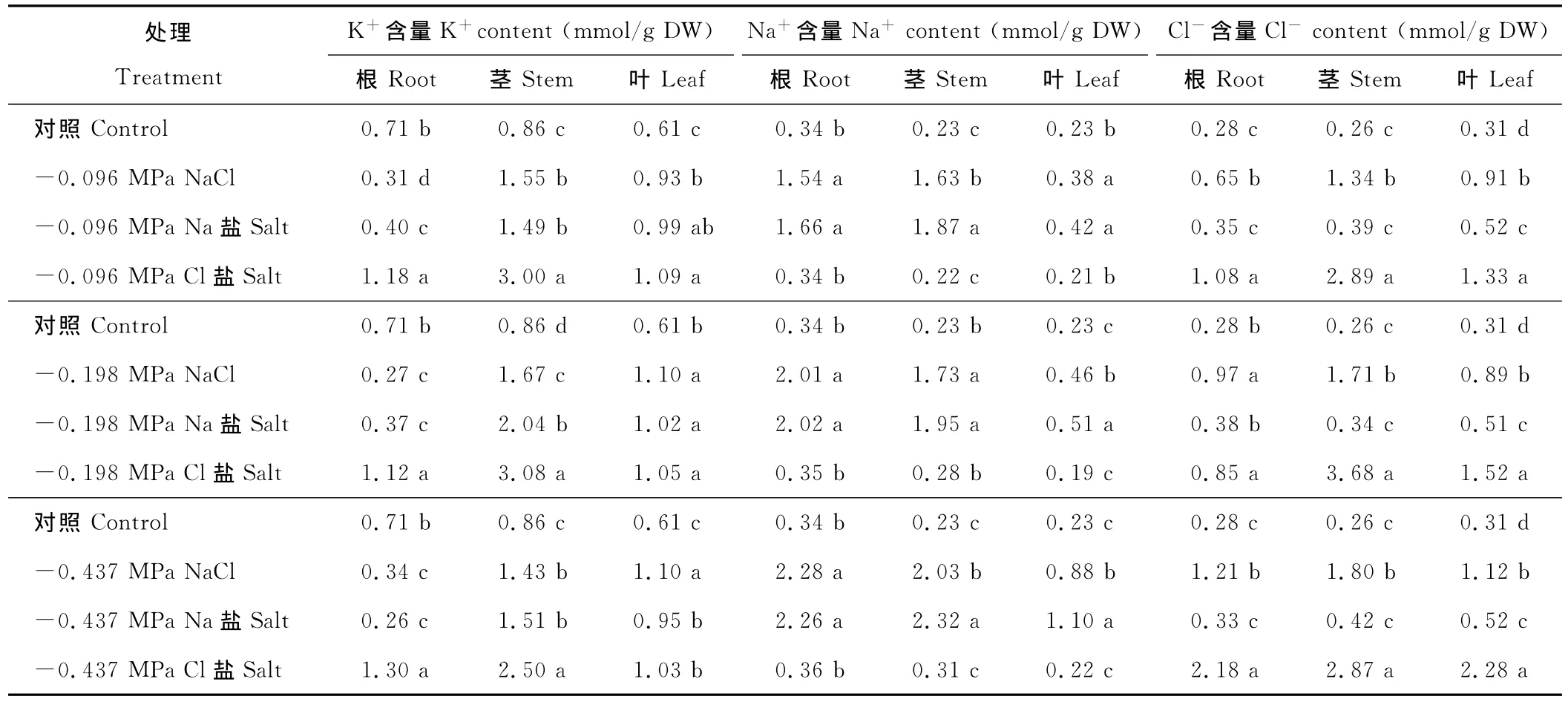
表3 等渗的NaCl、Na盐和Cl盐对籽粒苋幼苗K+、Na+、Cl-含量的影响Table 3 Effects of iso-osmotic treatments of NaCl,Na and Cl salt on K+ ,Na+ ,Cl- of grain amaranth seedlings
2.6 NaCl、Na盐和Cl盐对籽粒苋幼苗 K+/Na+和SK,Na的影响
与对照相比,不同渗透势下的NaCl、Na盐处理均显著降低籽粒苋幼苗根和茎的K+/Na+,而-0.096 MPa NaCl、Na盐和-0.198 MPa NaCl处理下的植株叶片 K+/Na+与对照差异均不显著,-0.198 MPa Na盐、-0.437 MPa NaCl、Na盐均显著降低叶片K+/Na+。而不同渗透势下的Cl盐处理均显著提高植株茎、叶的K+/Na+。不同渗透势下的NaCl、Na盐处理均显著提高根、茎、叶的SK,Na,且根的SK,Na随着盐度的增加呈增加趋势(表4)。
3 讨论
通常情况下,生长抑制是淡土植物(glycophyte)对盐渍响应最敏感的过程[32-34],低浓度盐分处理下,即-0.096和-0.198 MPa Cl盐可以明显提高籽粒苋幼苗的干物质积累量,且-0.096 MPa Cl盐显著提高其生长速率,说明作为植物生长必需的微量营养元素,适量的氯加入对籽粒苋幼苗的生长是有益的;而在高浓度下,即-0.437 MPa Cl盐则显著抑制籽粒苋的生长。上述结果与对番茄(Lycopersiconesculentum)[35]和向日葵(Helianthusannuus)[11]的研究结果很相似。高盐胁迫下,籽粒苋幼苗干重、生长率,净光合速率等受Na盐和NaCl的胁迫作用显著大于Cl盐胁迫的,因此籽粒苋苗期所受的离子胁迫主要是由Na+引起的。
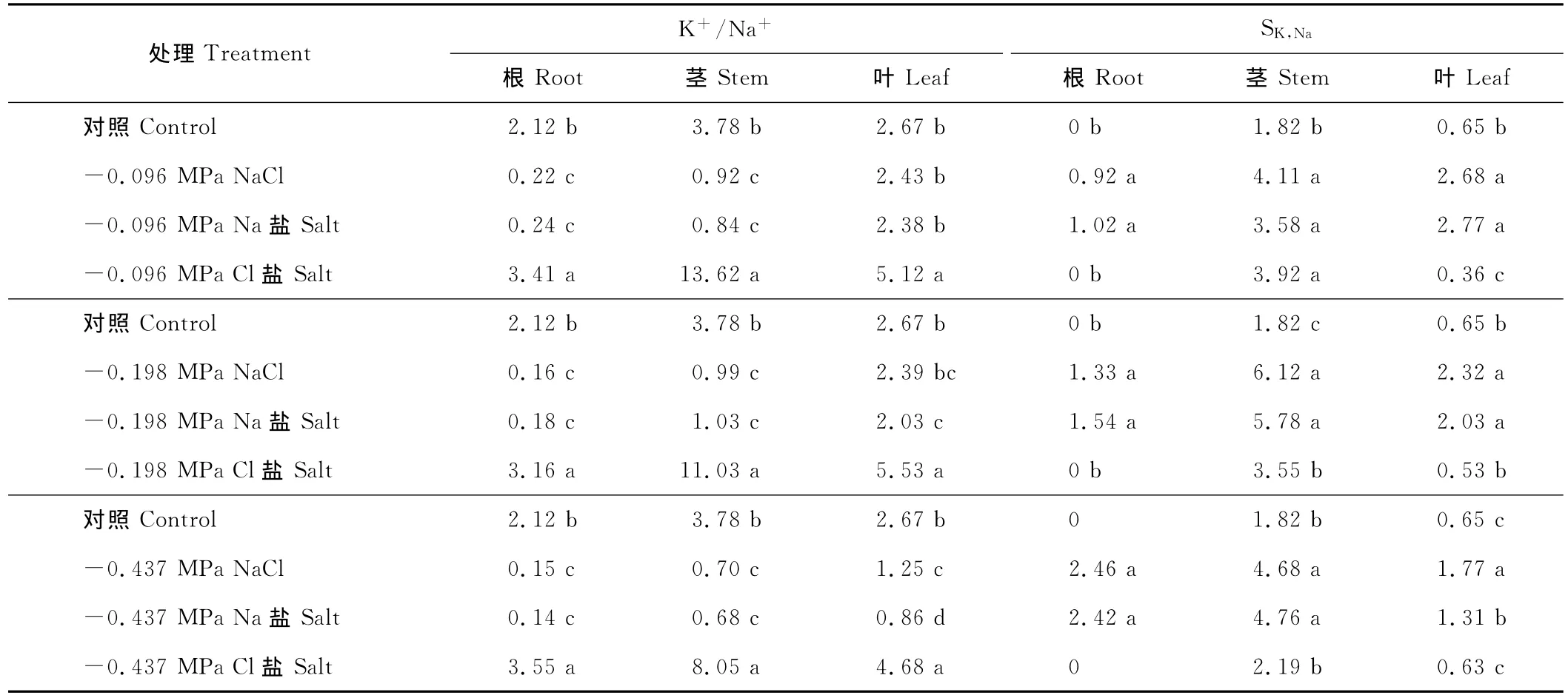
表4 等渗的NaCl、Na盐和Cl盐对籽粒苋幼苗K+/Na+和SK,Na的影响Table 4 Effects of iso-osmotic treatments of NaCl,Na and Cl salt on K+/Na+ and SK,Na of grain amaranth seedlings
光合作用是植物体内极其重要的生理过程,盐胁迫降低植物的光合作用,净光合速率(Pn)是反映植物对盐胁迫的响应以及鉴定植物抗盐能力的有效生理指标,直接反映了单位叶面积的光合同化能力[10]。本研究中,-0.437 MPa等渗胁迫对不同处理的Pn值抑制程度由大到小依次为:Na盐>NaCl>Cl盐,这一结果和高盐胁迫对其生长的抑制是一致的。进一步表明NaCl胁迫下,Na盐对籽粒苋幼苗造成的毒害大于Cl盐的。一般认为盐胁迫下导致光合速率降低的因子包括气孔限制和非气孔限制[36]。导致光合速率降低的原因主要归纳为两类:一类为气孔因素,主要受气孔导度的影响;另一类为非气孔因素,即内部的调控机制。随着胁迫的加重,Ci减少但是Ls值增大,说明籽粒苋盐胁迫下光合速率下降的主导因素为气孔限制。Maathuis和Amtmann[37]认为可用叶肉细胞CO2浓度和气孔限制值判断气孔导度是否是光合速率相应变化的主要原因。只有当Ci与Pn变化方向相同,两者都减小,且Ls值增大时,才可认为光合速率的下降主要是由于气孔导度的降低引起的,否则,如果Pn下降,Ci升高,Ls减少,便可以肯定光合速率下降的决定因素是叶肉细胞光合活性的降低而不是气孔导度的因素。本试验中,-0.437 MPa的不同盐胁迫下10 d,随着Pn下降的同时,Ci显著降低,Ls值显著增加,这表明籽粒苋在这个强度的盐胁迫下光合速率下降的主导因素为气孔限制。
高盐胁迫下植物细胞内离子平衡必然被打破,其中一个典型指标就是 K+/Na+的降低[4,32,37,38]。植物在盐胁迫下维持恒定的 K+含量以免受伤害,很可能是海篷子(Salicorniaeuropaea)、盐芥(Thellungiellasalsuginea)等盐生植物(halophyte)较为普遍的耐盐机制[10,39,40],而淡土植物一般是通过拒盐或者对K+的选择性吸收或运输,来维持体内一定的离子平衡[4,10,11]。盐胁迫下Na+显著优先积累于大麦(Hordeumvulgare)的下位老叶中,上位叶中Na+含量较低,从而维持上位叶中较高的K+含量和K+/Na+[39]。离子选择性吸收和运输系数反映的是植物体对离子吸收或向地上部分运输的选择性。盐胁迫下,K+-Na+选择性吸收和运输系数(SK,Na)越大,表示植株选择性地抑制 Na+、促进K+的吸收和运输能力越强[7,32,39]。盐渍中高羊茅(Festucaarundinacea)根系SK,Na较高,说明对K+的吸收具有较高的选择性[40],盐胁迫下较耐盐的向日葵幼苗的盐分均优先积累在根和茎中,且根、叶的SK,Na均极显著高于对照,从而维持较好的离子平衡[32]。本试验中,在NaCl和Na盐胁迫下,根、茎、叶的SK,Na均显著高于对照,籽粒苋幼苗植株根和茎中Na+含量均显著高于叶中Na+含量,从而保持植株中,尤其是叶片中较高的K+/Na+,是构成籽粒苋幼苗具有较强盐渍适应能力的重要因子之一。从整体水平上阐明籽粒苋耐盐生理机制尚待进一步深入研究。
[1]杨帆,丁菲,杜天真.盐胁迫下构树幼苗各器官中K+、Ca2+、Na+和Cl-含量分布及吸收特征[J].应用生态学报,2009,20(4):767-772.
[2]Ruizd M C.Demarcating specification(NaCl,Cl-,Na+)and osmotic effects in the response of two citrus rootstock to salinity[J].Scientia Horticulturae,1999,80:213-224.
[3]Zheng Q S,Liu L,Liu Z P,etal.Comparison of the response of ion distribution in the tissues and cells of the succulent plants Aloe vera and salicornia europaea to saine stress[J].Journal of Plant Nutrition and Soil Science,2009,172(6):875-883.
[4]刘友良,汪良驹.植物对盐胁迫的反应和耐盐性[A].余叔文,汤章城.植物生理和分子生物学[C].北京:科学出版社,1998:752-769.
[5]Moya J L,Gómez-Cadenas A,Primo-Millo E,etal.Chloride absorption in salt-sensitive Carrizo citrange and salt-tolerant Cleopatra mandarin citrus rootstocks is linked to water use[J].Journal of Experimental Botany,2003,54:825-833.
[6]Luo Q Y,Yu B J,Liu Y L.Differential sensitivity to chloride and sodium ions in seedlings ofGlycinemaxandG.sojaunder NaCl stress[J].Journal of Plant Physiology,2005,162:1003-1012.
[7]张宏飞,王锁民.高等植物Na+吸收、转运及细胞内Na+稳态平衡研究进展[J].植物学通报,2007,24(5):561-571.
[8]周玲玲,缪建锟,祝建波,等.大叶补血草Na+/H+逆向转运蛋白基因的克隆及序列分析[J].草业学报,2009,18(5):176-183.
[9]Zhao F,Song C P,He J Q,etal.Polyamines improve K+/Na+homeostasis in barley seedlings by regulating root ion channel activities[J].Plant Physiology,2007,145:1061-1072.
[10]高永生,王锁民,宫海军,等.盐胁迫下植物离子转运的分子生物学研究[J].草业学报,2003,12(5):18-25.
[11]郑青松,杨文杰,刘兆普,等.外源氯处理对向日葵幼苗生长、养分吸收及植株硝态氮含量的影响[J].植物营养与肥料学报,2007,13(6):1161-1165.
[12]Parida A K,Das A B.Salt tolerance and salinity effects on plants:A review[J].Ecotoxicology and Environmental Safety,2005,60(3):324-349.
[13]Moghaieb R E A,Saneoka H,Fujita K.Effect of salinity on osmotic adjustment,glycinebetaine accumulation and the betaine aldehyde dehydrogenase gene expression in two halophytic plants,SalicorniaeuropaeaandSuaedamaritime[J].Plant Science,2004,166:1345-1349.
[14]赵昕,赵敏桂,谭会娟,等.NaCl胁迫对盐芥和拟南芥K+、Na+吸收的影响[J].草业学报,2007,16(4):21-24.
[15]张永锋,梁正伟,隋丽,等.盐碱胁迫对苗期紫花苜蓿生理特性的影响[J].草业学报,2009,18(4):230-235.
[16]贾文庆,刘会超.NaCl胁迫对白三叶一些生理特性的影响[J].草业科学,2009,26(8):187-189.
[17]Romero-Aranda R,Soria T,Cuartero J.Tomato plant-water uptake and plant-water relationships under saline growth conditions[J].Plant Science,2001,160:265-272.
[18]张锡洲,李廷杆,王昌全.富钾植物籽粒苋研究进展[J].中国农学通报,2005,21(4):230-235.
[19]Pospisil A,Pospisil M,Varga B,etal.Grain yield and protein concentration of two amaranth species(Amaranthusspp.)as influenced by the nitrogen fertilization[J].European Journal of Agronomy,2006,25:250-253.
[20]张秀玲.盐碱植物籽粒苋的开发利用[J].安徽农业科学,2007,35(4):1074,1135.
[21]Akanbi W B,Togun A O.The influence of maize-stover compost and nitrogen fertilizer on growth,yield and nutrient uptake of amaranth[J].Scientia Horticulturae,2002,93:1-8.
[22]Erley G S,Kaul H P,Kruse M,etal.Yield and nitrogen utilization efficiency of the pseudocereals amaranth,quinoa,and buckwheat under differing nitrogen fertilization[J].European Journal of Agronomy,2005,22:95-100.
[23]李廷轩,马国瑞,张锡洲.富钾基因型籽粒苋主要根系分泌物及其对土壤矿物态钾的活化作用[J].应用生态学报,2006,17(3):368-372.
[24]秦嘉海.耐盐牧草籽粒苋对河西走廊草甸盐土改土培肥效应[J].土壤通报,2005,36(5):806-808.
[25]Kingsbury R W,Epstein E.Salt sensitivity in wheat[J].Plant Physiology,1986,80:651-654.
[26]罗庆云,於丙军,刘友良.NaCl胁迫下Cl-和Na+对大豆幼苗胁迫作用的比较[J].中国农业科学,2003,36(11):1390-1394.
[27]Wellburn A R.The spectral determination of chlorophylls a and b,as well as total carotenoids using various solvents with spectrophotometers of different resolution[J].Journal of Plant Physiology,1994,144:307-313.
[28]Sheng M,Tang M,Chen H,etal.Influence of arbuscular mycorrhizae on photosynthesis and water status of maize plants under salt stress[J].Mycorrhiza,2008,18:287-296.
[29]陈健妙,郑青松,刘兆普,等.麻疯树(JatrophacurcasL.)幼苗生长和光合作用对盐胁迫的响应[J].生态学报,2009,29(3):1356-1365.
[30]於丙军,罗庆云,刘友良.盐胁迫对盐生野大豆生长和离子分布的影响[J].作物学报,2001,27(6):776-780.
[31]陕西师范大学.农业化学常用分析方法[M].西安:陕西科学技术出版社,1980:283-284.
[32]郑青松,刘兆普,刘友良,等.盐和水分胁迫对海蓬子、芦荟、向日葵幼苗生长及其离子吸收分配的效应[J].南京农业大学学报,2004,27(2):16,20.
[33]Munns R.Comparative physiology of salt and water stress[J].Plant,Cell and Environment,2002,25:239-250.
[34]刘一明,程凤枝,王齐,等.四种暖季型草坪植物的盐胁迫反应及其耐盐阈值[J].草业学报,2009,18(3):192-199.
[35]郑青松,杜爽,刘兆普,等.外源氯对番茄幼苗生长及养分吸收、利用的影响[J].园艺学报,2006,33(4):849-852.
[36]Farquhar G D,Sharkey T D.Stomatal conductance and photosynthesis[J].Annual Review of Plant Physiology,1982,33:317-345.
[37]Maathuis F J M,Amtmann A.K+nutrition and Na+toxicity:The basis of cellular K+/Na+ratios[J].Annals of Botany,1999,84:123-133.
[38]郑青松,华春,董鲜,等.盐角草幼苗对盐离子胁迫生理响应的特性研究[J].草业学报,2008,17(6):164-168.
[39]张金林,陈托兄,王锁民.苄氨基嘌呤(BA)和脱落酸(ABA)对大麦Na+、K+选择性和游离脯氨酸分配的调节[J].草业学报,2006,15(5):63-69.
[40]李品芳,杨志成.NaCl胁迫下高羊茅生长及 K+、Na+吸收与运输的动态变化[J].草业学报,2005,14(4):58-64.

