缺氧条件下活性污泥中PHB的生物合成
李金娟,赵 林,谭 欣,黄 宇,德吉央宗,齐 云
缺氧条件下活性污泥中PHB的生物合成
李金娟,赵 林,谭 欣,黄 宇,德吉央宗,齐 云
(天津大学环境科学与工程学院,天津 300072)
在序批式反应器(sequencing batch reactor,SBR)中驯化活性污泥,富集聚β-羟基丁酸酯(poly-βhydroxybutyrate,PHB)积累菌,并研究驯化后活性污泥的PHB合成能力.污泥驯化采用好氧动态供料法,为期3个月.PHB合成实验在缺氧条件下进行(通气量为80.L/h,溶解氧为0.mg/L),温度为20.℃,活性污泥初始质量浓度为1.200.mg/L,乙酸钠质量浓度为931.5.mg/L(以C计).结果表明,驯化后活性污泥中PHB积累菌占优势,具有PHB合成的能力.投加乙酸钠931.5.mg/L(C),在缺氧条件下,活性污泥中PHB含量于feast(底物丰富)阶段末达最高值45.4%.feast阶段内乙酸钠消耗94%,其中53.4 %的乙酸钠被转化为PHB,2.7%乙酸钠用于合成污泥活性生物量,供污泥生长.因此,好氧动态供料法驯化后的活性污泥具有较强的PHB合成能力,生长缓慢.
生物降解塑料;聚β-羟基丁酸酯;活性污泥;好氧动态供料法
聚β-羟基丁酸酯(poly-β-hydroxybutyrate,PHB)是一种可以被生物降解的高分子聚合物,属于聚羟基脂肪酸酯(poly-β-hydroxyalkanoate,PHA)类.PHB具有化学合成塑料的理化性质,可纺丝、压膜和注塑等,并且具有生物可降解性和生物相容性,在医药及工农业领域具有广泛的应用[1-2].现阶段PHB的合成大多是利用纯菌种微生物发酵法和基因工程法,生产成本较高.利用污水处理技术积累PHA[3],同时实现污泥的资源化,成为一个新的研究热点.
PHB是许多原核微生物在不平衡生长条件下合成的一种胞内能源和碳源储藏性物质.研究发现,PHB在污水生物处理中是一种重要中间产物[4],普遍存在于有机废水处理活性污泥中.目前国内对于活性污泥合成PHB的研究主要采用厌氧-好氧/生物除磷工艺[5].国外研究大多以活性污泥为混合菌群,采用动态供料法使活性污泥处于非稳态生长,合成PHB,但其都集中在好氧、厌氧条件下PHB的合成研究[6-8],对于缺氧条件的研究较少.笔者利用好氧动态供料法驯化活性污泥,并在缺氧的条件下研究活性污泥利用乙酸钠合成PHB的能力.
1 实验方法
1.1实验装置及活性污泥驯化
实验装置由序批式反应器(sequencing batch reactor,SBR)主体(有效容积8.L)、进出水系统、搅拌曝气系统、数据采集及控制系统4部分组成.进出水系统由水泵、电磁排水阀及管路构成;搅拌曝气系统由电动搅拌机、空气压缩机、空气扩散器、气体流量计及管路构成;数据采集及控制系统由溶解氧(dissolved oxygen,DO)、pH电极及其控制器、数字式污水处理自动程序控制器和PC机组成.
活性污泥取自天津市纪庄子污水处理厂,采用好氧动态供料方法在SBRⅠ中对其进行驯化培养.周期运行方式为:进水—曝气+搅拌—加碳源—沉淀—瞬时出水,周期为12.h.进水采用自配水,主要成分质量浓度见表1.通过添加硫脲(20.mg/L)抑制硝化作用[9].碳源(CH3COONa·3H2O)通过蠕动泵加入,使反应器中CH3COONa·3H2O的质量浓度约为300.mg/ L.通过预设程序对循环周期内各阶段进行自动控制.每周期在好氧结束后排出400,mL活性污泥混合液,维持污泥龄为10,d.每周期活性污泥沉淀1.h排出3,L上清液.
表1 进水成分Tab.1 Component of synthetic wastewater
1.2活性污泥中PHB的合成
取驯化后的活性污泥,加入到SBRⅡ反应器,初始混合液悬浮固体(mixed liquor suspended solid,MLSS)质量浓度为1,200,mg/L.进水后曝气搅拌1,h,瞬时投加碳源CH3COONa·3H2O,4,g/L,调节曝气量80,L/h,温度20,℃左右,pH值为7.5~8.5.实验过程中定时取样分析水样乙酸钠、MLSS、挥发性悬浮固体(volatile suspended solid,VSS)和PHB含量.
1.3分析测试与计算
采用总有机碳分析仪(岛津TOC-VCPH) 测定乙酸钠,分析结果以C计.MLSS和VSS测定采用干重法[10].pH值、DO值利用pH电极、DO电极进行在线监测.PHB定性观察采用苏丹黑染色法[11].
PHB含量的测定采用气相色谱法[12-13].分别取PHB标准品(Aldrich,美国)20,mg、冷冻干燥的活性污泥50.mg置于螺口试管中,加入2,mL氯仿、2,mL含3%硫酸以及2,mL含苯甲酸的甲醇溶液,100,℃水浴4 h;取出后在试管中加入2,mL去离子水并剧烈振荡,待溶液静止分层后取下层有机相,用无水硫酸钠干燥,进行气相色谱分析.气相色谱条件为:采用Agilent 19091J-413型气相色谱仪和火焰离子化检测器(flame ionization detector,FID),色谱柱为HP-IN NO WAX型石英毛细管柱(30,m×250.µm×0.25.mm).进样口温度为220,℃,检测口温度为250,℃,N2流量为45,mL/min,H2流量为40,mL/min,空气流量为450.mL/min,进样量为1,µL,分流比为20∶1.采用程序升温,升温速度为15,℃/min;初温为130,℃,保持2,min;终温220,℃,保持2.min.
乙酸钠比消耗速率、PHB比合成速率和乙酸钠的PHB转化率的计算参考文献[6] .
2 结果与分析
2.1污泥驯化
驯化过程中,瞬时投加少量碳源,使微生物处于底物丰富与匮乏的交替状态(feast and famine state),进行非稳态生长. 在这种动态生长环境下,具有PHB存储能力的微生物在活性污泥系统中因更有竞争力而成为优势菌种.
污泥驯化周期内乙酸钠(以C计)和PHB的变化如图1所示.由图可以看出,投加乙酸钠后,水相中C含量瞬时升高(由10.2,mg/L升高至62.8 mg/L).在好氧条件下,活性污泥迅速利用有机碳源,C含量降低,1,h降至17,mg/L.活性污泥中PHB含量升高,1,h达到最高值,占活性污泥干重的12.4%.1,h后PHB迅速降解,2,h降至7.1%,3,h降至6.4%.
污泥驯化周期内DO的变化见图2.在好氧动态供料工艺中DO浓度变化明显.从图中可以看出,DO在加入碳源后很快减小,约在15,min时达到最低点.之后,由于曝气复氧速率大于活性污泥耗氧速率,DO迅速上升.1,h后,活性污泥没有可以利用的胞外碳源,开始代谢PHB,此时活性污泥耗氧速率约等于曝气复氧速率,DO基本达稳态.2 h后,大部分PHB被消耗,活性污泥代谢缓慢,DO迅速升高.因此通过在线监测DO的变化,可辨别底物丰富和匮乏阶段的拐点.

图1 乙酸钠浓度和活性污泥中PHB含量Fig.1 Acetate and PHB contents in activated sludge

图2 DO的变化Fig.2 Change of DO
活性污泥染色显微照片如图3所示.可以看出,PHB积累菌经苏丹黑染色后为黑色,聚集为絮状,在活性污泥系统中占优势地位.原因在于,在SBR反应器中,微生物可以获得胞外底物的时间相对比较短,底物被消耗后,没有胞内合成物的微生物很快进入内源呼吸期,生长缓慢;具有PHB储藏能力的微生物在底物存在的情况下合成PHB,胞外底物消失后,则分解利用PHB继续生长,因此要比没有该能力的微生物更具竞争力,使得PHB积累菌在活性污泥系统中占优势.
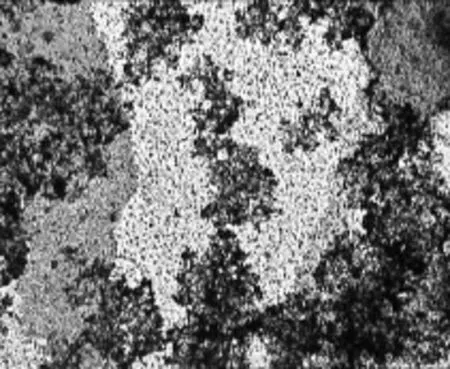
图3 活性污泥的苏丹黑染色显微照片(10×10)Fig.3 Micrograph of activated sludge stained by Sudan black(10×10)
2.2活性污泥中PHB的合成
PHB合成阶段中DO含量与乙酸钠变化趋势见图4.投加乙酸钠后,活性污泥吸收利用乙酸钠,消耗氧气.由于活性污泥的耗氧速率大于曝气复氧速率,溶解氧迅速耗尽,5,h内一直处于未检测出的状态.在此阶段内,活性污泥处于缺氧状态,通过氧化分解部分有机基质来获得能量,积累PHB.5,h后,有机碳源耗尽,活性污泥进行内源代谢,曝气复氧速率大于活性污泥耗氧速率,溶解氧含量迅速上升.通过溶解氧的变化,即可判定5,h内活性污泥处于底物丰富阶段,5,h后活性污泥处于底物匮乏阶段.

图4 DO和乙酸钠的变化Fig.4 Change of DO and acetate
PHB合成阶段MLSS、VSS及PHB含量变化分析如下.在底物丰富阶段,活性污泥储存PHB;在底物匮乏阶段,活性污泥消耗PHB,用作碳源和能源进行生长.本文只讨论底物丰富阶段内PHB的合成.由图5可以看出,底物丰富阶段内(5,h内)活性污泥质量浓度和PHB含量均呈增长趋势.初始活性污泥质量浓度MLSS为1,200,mg/L,PHB含量为109,mg/L,占污泥干重的9.1%;5,h时MLSS增长至2,080,mg/L,PHB含量增长至945,mg/L,占污泥干重的45.4%.图6为VSS成分,VSS是挥发性固体,通常用于表示污泥中有机物含量,包括污泥活性生物量和储藏物质PHB两部分.由图6可以看出,在5,h内,VSS和PHB呈增长趋势:初始VSS质量浓度为944.1,mg/L,5,h时VSS为1,813.7,mg/L;5,h内VSS增长量为869.6,mg/L,而PHB的增加量为836,mg/L,因此VSS的增加主要是由PHB的合成引起的.而污泥活性生物量变化很小,初始为835.1,mg/L,5,h时为869.1,mg/L,5,h内活性生物量增长量为34,mg/L.

图5 MLSS及PHB含量的变化Fig.5 Change of MLSS and PHB
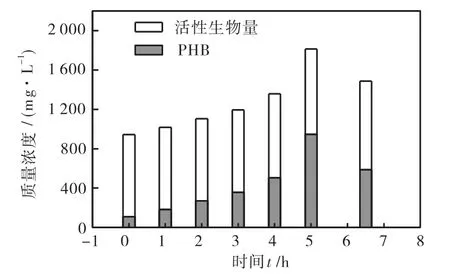
图6 VSS的成分Fig.6 Component of VSS
乙酸钠的消耗和PHB的合成关系见图7.可以看出,乙酸钠的消耗主要在5,h内进行,乙酸钠质量浓度(以C计)从初始的931.5,mg/L减少到56.7,mg/L,5,h内乙酸钠消耗量为874.8,mg/L,消耗速率为174.9,mg/(L·h),比消耗速率为464,mg/ (mg·h).在此阶段,活性污泥主要利用乙酸钠合成PHB,PHB的质量浓度(以C计)从初始的60.8,mg/L升高至527.4, mg/L,PHB的增长量为466.6,mg/L,所以PHB的合成速率为93.32,mg/(L·h),比合成速率为0.248,mg/(mg·h).因此,底物丰富阶段内,乙酸钠的PHB转化率为53.4%.在本实验中,乙酸钠一部分被氧化分解,产生能量,供活性污泥利用,一部分用于储藏PHB,只有很小一部分活性污泥自身生长(污泥活性生物量合成).
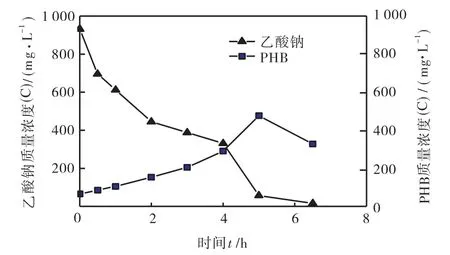
图7 乙酸钠浓度和PHB含量的变化Fig.7 Change of acetate and PHB
乙酸钠去除及PHB合成、污泥活性生物量合成三者关系如图8所示.5,h内乙酸钠消耗量为874.8,mg/L(C),其中PHB合成量为466.6,mg/L(C),占乙酸钠消耗量的53.4%;污泥细胞成分合成量为23.9,mg/L(C),占乙酸钠消耗量的2.7%.

图8 乙酸钠的去除Fig.8 Removal of acetate
3 结 论
(1)好氧动态供料法驯化活性污泥,使活性污泥处于底物丰富与匮乏的交替状态,长时间的底物匮乏使PHB合成菌在活性污泥中更具竞争力,得到富含PHB合成菌的活性污泥.
(2)反应周期内,底物丰富阶段活性污泥利用胞外碳源乙酸钠合成PHB,PHB含量升高;底物匮乏阶段活性污泥降解利用PHB.所以,PHB含量于底物丰富阶段末达最高值.通过在线观察DO的变化,可辨别底物丰富和底物匮乏阶段的拐点,确定PHB合成的最佳时间.
(3)在高浓度乙酸钠(以C计,931.5,mg/L)条件下,溶解氧成为活性污泥代谢的限制因素,在低通氧量的条件下,活性污泥主要进行储藏物的合成,进行非平衡生长,污泥活性生物量增长缓慢.在底物丰富阶段内,活性污泥消耗乙酸钠874.8,mg/L,合成PHB 466.6,mg/L,合成污泥活性生物量45,mg/L.所以在缺氧条件下,乙酸钠主要用来合成PHB,乙酸钠的PHB转化率为53.4%.
[1] 李铁骑,齐 昆. 微生物聚酯的合成和应用研究进展[J]. 现代化工,1994,14(9):14-17.
Li Tieqi,Qi Kun. Progress on the biosynthesis and application of microbial polyesters[J]. Modern Chemical Industry,1994,14(9):14-17(in Chinese).
[2] 刘 春,张小凡. PHB在生产可降解塑料方面的应用及其微生物累积的研究进展[J]. 塑料工业,2005,33(8):1-3,18.
Liu Chun,Zhang Xiaofan. Application of PHB used in production of degradable plastics and research progress in microbial synthesized PHB[J]. China Plastics Industry,2005,33(8):1-3,18(in Chinese).
[3] 吴光学,管运涛,蒋展鹏,等. 高氨氮工业废水处理的初步研究[J ]. 工业水处理,2004,24(10):33-36.
Wu Guangxue,Guan Yuntao,Jiang Zhanpeng,et al. Primary study on the treatment of high strength ammonia-nitrogen industrial wastewater[J]. Indus Water Treatment,2004,24(10):33-36(in Chinese).
[4] Lee S Y. Plastic bacterial progress and prospects for polyhydroxyalkanoate production in bacteria[J]. Trends Biotechnol,1996,14:431-443.
[5] 郑裕东,钟青华,马文石,等. 厌氧-好氧驯化活性污泥生物合成PHA的研究[J]. 环境科学研究,2001,14(2):41-44.
Zheng Yudong,Zhong Qinghua,Ma Wenshi,et al. Biosynthesis of PHA from anaerobic-aerobic activated sludge process[J]. Research of Environmental Sciences,2001,14(2):41-44(in Chinese).
[6] Beun J J,Dircks K,Van Losdrecht M C M,et al. Poly-βhydroxybutyrate metabolism in dynamically fed mixed microbial cultures[J]. Water Research,2002,36(5):1167-1180.
[7] Dionisi D,Majone M,Papa V,et al. Biodegradable polymers from organic acids by using activated sludge enriched by aerobic periodic feeding[J]. Biotechnology and Bioengineering,2004,85(6):569-579.
[8] Majone M,Massanisso P,Ramadori R. Comparison of carbon storage under aerobic and anoxic conditions[J]. Water Science and Technology,1998,38(9):77-84.
[9] Dionisi D,Majone M,Vallini G. Effect of the applied organic load rate on biodegradable polymer production by mixed microbial cultures in a sequencing batch reactor[J]. Biotechnology and Bioengineering,2006,93(1):76-87.
[10] 国家环保局《水和废水监测分析方法》编委会. 水和废水监测分析方法[M]. 3版. 北京:中国环境科学出版社,1989.
State Environment Protection Bureau. Standard Methods for Water and Wastewater Analysis[M]. 3rd ed. Beijing:China Environmental Science Press,1989(in Chinese).
[11] Denis P,Marie-Noelle P,Motta M. Characterization of PHB storage in activated sludge extended filamentous bacteria by automated colour image analysis[J]. Biotechnology Letters,2007,29:1263-1269.
[12] Comeau Y,Hall J K,Oldham W K. Determination of poly-3-hydroxybutyrate and poly-3-hydroxyvalerate in activated sludge by gas-liquid chromatography[J]. Applied and Environmental Microbiology,1988,54(9):2325-2327.
[13] Wang J,Yu J. Kinetic analysis on formation of poly(3-hydroxybutyrate)from acetic acid by Ralstonia eutropha under chemically defined conditions[J]. Journal of Industrial Microbiology and Biotechnology,2001,26(3):121-126.
Biosynthesis of Poly-β-Hydroxybutyrate in Activated Sludge Under Anoxic Oxygen Condition
LI Jin-juan,ZHAO Lin,TAN Xin,HUANG Yu,DEJI Yang-zong,QI Yun
(School of Environmental Science and Engineering,Tianjin University,Tianjin 300072,China)
Activated sludge has been domesticated by aerobic dynamic feeding for 3 months in sequencing batch reactor (SBR),which is rich in poly-β-hydroxybutyrate(PHB)-accumulating microorganisms,and its PHB biosynthesis capacity has been studied. The PHB synthesis experiments were conducted under anoxic oxygen condition(air flow rate 80 L/h,dissolved oxygen 0 mg/L)at 20.℃ with the initial concentration of mixed liquor suspended solid (MLSS) and acetate being1 200 mg/L and 931.5 mg/L(C) respectively. Experiment results indicate that PHB-accumulating microorganisms with PHB synthesis capacity predominate in the activated sludge after domestication. After feeding of acetate dosage of 931.5 mg/L(C),PHB content in the sludge reached the maximum value of 45.4% at the end of feast(external substrate accessibility)period under anoxic oxygen condition. During the feast period,94% of acetate was consumed,in which 53.4% of acetate was transformed to PHB and 2.7% of acetate was used to synthesize cell structural materials for sludge growth. It is thus concluded that the activated sludge after domestication by aerobic dynamic feeding has a high PHB synthesiscapacity and grows slowly.
biodegradable plastics;poly-β-hydroxybutyrate;activated sludge;aerobic dynamic feeding
X703
A
0493-2137(2010)01-0050-05
2008-11-25;
2009-03-18.
李金娟(1981— ),女,博士研究生,jinjuanli1981@yahoo.com.cn.
赵 林,zhaolin@tju.edu.cn.

