犬体细胞克隆研究
王伦学,李 力,谷颖乐,徐永莉,张月云,赵成坚
(中国医学科学院药用植物研究所 广西分所;广西药用植物园,广西 南宁 530023)
犬体细胞克隆研究
王伦学,李 力,谷颖乐,徐永莉,张月云,赵成坚
(中国医学科学院药用植物研究所 广西分所;广西药用植物园,广西 南宁 530023)
克隆是由英文单词“clone”音译而来,来自希腊语“klon”,本意是扦插枝条,即无性繁殖。现在所说的克隆多是指动物体细胞核移植(somatic cell nuclear transfer,SCNT),即把动物体细胞核移植入去核的动物卵母细胞中,构建新的重组胚胎,进而使重构胚胎发育为与供体核细胞基因型相同后代的技术过程。动物体细胞克隆可以使动物不需要经过有性繁殖,即不需要雄性动物的精子和雌性动物的卵母细胞的受精过程而产生动物后代。
1997年英国罗斯林研究所Wilmut等成功获得世界首例体细胞克隆绵羊(Dolly),打破了长期以来认为成年动物体细胞不具备发育全能性的假说。克隆羊“多莉”的诞生使人们相信,高度分化的成年动物体细胞可以在体外通过核移植技术实现其发育成新个体的潜能。在此理论基础上,自1997年以来,相继在羊[1-3]、牛[4,5]、猪[6]、小鼠[7-9]、兔[10]、马[11]等物种上成功得到克隆动物后代。
目前,动物体细胞克隆技术的主要环节包括:供体细胞的培养和准备、受体卵母细胞的体外成熟及去核、供体细胞核移植入去核卵母细胞中、重构胚胎的融合和激活、重构胚胎的体外发育以及重构胚胎移植入受体动物中并妊娠产仔。在2006年,世界首例体细胞克隆犬获得成功[12,13]。他们把重构胚胎经过融合激活后不经过体外发育而直接移植入受体母犬中妊娠,进而发育成新个体[12,13]。
综合各种动物克隆方法和效率,犬体细胞克隆效率较低,难度大。如犬卵母细胞体外成熟效率低,犬卵母细胞核相(胚胎细胞核)观察效率低,体外胚胎培养体系不完善,重构胚胎很难进行体外发育。以下详细介绍目前影响犬体细胞克隆的因素。
1 影响犬体细胞克隆的因素
1.1 超数排卵和卵母细胞质量
犬卵母细胞体外成熟(IVM)效率比其它哺乳动物和实验动物低[14-25]。至目前无利用体外成熟卵母细胞获取克隆犬报道。为充分利用宝贵资源,使用更多成熟卵母细进行克隆犬研究,科学家使用激素诱导母犬发情,超数排卵以获取体内成熟的卵母细胞[12,13]。其中,GJang等已找出了成熟的超排方法。
G Jang等超排获取卵母细胞,在显微镜下观察,依据形态学标准,即卵周缝(PVS)大小及第1极体存在与否,来判断卵母细胞成熟状态。从图1可以看出,未成熟卵母细胞的细胞质黑但不均匀致密,成熟卵母细胞的细胞质黑而均匀致密,而早期老龄化卵母细胞、中等老龄化卵母细胞及严重老龄化卵母细胞中卵周隙逐渐增大,透明带和卵丘细胞也逐渐老化。另外,上述研究发现,超数排卵72 h后,从犬输卵管中冲洗出卵母细胞,此期卵母细胞质量最高,用此时期卵母细胞做受体构建的重构胚在代孕受体中妊娠率会较高。

图1 排卵后约72 h从输卵管中冲出的体内成熟的各时期卵母细胞
1.2 融合、激活、胚胎移植
G Jang等对犬重构胚融合、激活及胚胎移植方法进行了探索。在重构胚激活方面,他们发现化学激活法比电激活法优越。经过融合和激活的重构胚直接移植入受体中而未进行体外培养。另外,随体外手术经验积累,从输卵管中获取卵母细胞及胚胎移植所需时间已大大缩短,胚胎移植部位和方法也得到较大改进。
1.3 胎儿流产、畸形
G Jang等用超声波观察妊娠代孕母犬,从妊娠第23天直至出生都无发生流产现象,所生犬仔体重正常,生长及活动正常。他们认为这与采用体内成熟卵母细胞作核受体有关。而在猪、牛、羊等大动物克隆中,多数都采用从屠宰场卵巢中获取卵母细胞,卵母细胞体外成熟,去核作为核受体,克隆胎儿较高发生流产和胎儿畸形等症状。建议此研究需比较体内外来源犬卵母细胞克隆效率产生差异,并找出确切原因,为其它动物体细胞克隆研究做参考。
2 克隆犬效率和方法
目前,通过体细胞克隆技术成功获得克隆犬的分别是WooSuk Hwang和GJang(见图2)。在克隆犬效率上(产仔数与受体数比值),G Jang高于WooSuk Hwang(25.00%∶1.6%)。

图2 已获得的体细胞克隆犬及供体犬和代孕犬
下面简要介绍两者克隆方法异同点:(1)供体细胞:WooSuk Hwang采用雄性阿富汗猎犬耳朵成纤维细胞,细胞体外培养72 h。GJang采用2月龄成年雌性阿富汗猎犬耳朵成纤维细胞,其中1~3代细胞放置在液氮中冷冻,3~8代细胞用于核移植。(2)卵母细胞来源:两者都采用超排成年母犬(排卵点开始计算)一段时间(G Jang采用超排72 h)后从犬输卵管中收集卵母细胞。在超排效率上,G Jang从23只母狗中获取167枚卵母细胞,平均每只母犬获取726枚卵母细胞。Woo Suk Hwang平均每只母犬获取12枚卵母细胞。前者明显低于后者。(3)去核和显微注射方法:都是通过显微注射方法把供体细胞注入已去核受体犬卵母细胞中。(4)初生体重和妊娠:两者所生犬仔体重正常,妊娠期都在60 d左右。(5)克隆后代:从两者照片可以发现,WooSuk Hwang所克隆的雄性阿富汗猎犬外表华贵,而G Jang克隆的雌性阿富汗猎犬外表普通。表明阿富汗猎犬品种较多。Woo Suk Hwang所生的第2只克隆犬仔在第1周患呼吸道病,于出生后22天死亡,但解剖后没发现组织结构异常。(6)检测手段:为了检测所生克隆犬仔是否与供体犬具有相同基因组,WooSuk Hwang对克隆犬和供体雄性犬进行了基因组DNA微卫星检测,共检测了8对犬特异性微卫星位点,最后确认克隆犬与供体犬基因组一致。GJang比较了供体犬、克隆犬和代孕母犬成纤维细胞和血液细胞基因组是否相同,共检测14个犬特异性标记,发现供体犬和克隆犬扩增片段大小相同,表明克隆犬基因组完全来自供体犬。表1具体比较两者采用方法及效率。
3 异种克隆
异种体细胞核移植技术又称异种克隆。是把一种动物体细胞核移植到另一种动物去核卵母细胞中,构建异种重构胚,异种重构胚中的细胞核和细胞质分别来自两个不同的物种,异种重构胚体外发育并移植入受体动物中产下与供核基因组相同动物。异种克隆在研究细胞核质关系,拯救濒危野生动物及人类胚胎干细胞方面具有特殊意义。
异种细胞核移植技术最早在鱼类和两栖类上开展研究[26-28],最近几年在哺乳动物上研究才有报道。DominkoT等把野牛、绵羊、猪、猴和大鼠的体细胞作供体移入牛去核卵母细胞中[29],重构胚均能发育至囊胚,前四种动物异种重构胚的囊胚率分别达到17.3%,13.9%,14.3%和16.6%,并且绵羊和野牛体细胞作供体重构胚移植入受体均能发育至妊娠阶段。陈大元利用大熊猫体细胞作核供体,移入去核猫和兔卵母细胞中,重构胚胎在体外均能发育至囊胚期。用猫作为代孕受体能在子宫中附植并能发育,但不能产下克隆后代[30]。因此需深入研究异种克隆机理以提高异种克隆效率。
1758年著名博物学家林奈在他的《自然系统》一书中把犬从狼和其他犬属动物分列出来,视其为一个驯化了的种,称为家犬。而美国科学家研究发现,所有犬种都是由一种东亚狼进化而来。并且在2002年,中国和瑞典科学家已有研究证实,全世界犬具有相同遗传基因,都起源于东亚,之后才逐渐扩散到世界各地。因此,有关狼与犬在进化和种间关系存在争议,需做进一步阐明。在2005年韩国科学家用狼体细胞做供体,以犬卵母细胞作受体成功克隆出狼,间接表明狼和犬遗传物质相似性。此研究为保护濒危动物提供了新方法。
2005 年,Murakami等比较了狗(Canis familiaris)- 牛 (Bos taurus)、牦牛 (Bos grunniens)- 牛(Bos taurus)、牛(Bos taurus)- 牛(Bos taurus)3 种异种重构胚体外发育能力[31]。发现用犬卵丘细胞作为核供体移植入牛卵母细胞中,75%重构胚能体外融合并发育至2细胞和8细胞时期,其比例分别达到73.9%和52.6%。而桑葚胚率和囊胚率仅为1.3%和0.4%。由此研究可得出犬异种重构胚体外发育停滞在8细胞期。因此需要深入研究8细胞停滞原因,并克服8细胞停滞现象,探索出优良的胚胎培养体系以提高异种克隆胚胎囊胚率。
综上所述,犬体细胞克隆及异种克隆研究相对匮乏,在克隆机理方面更需深入研究。目前研究已表明,犬卵母细胞能够支持供体细胞发育成动物个体,为犬异种克隆研究奠定了坚实基础。
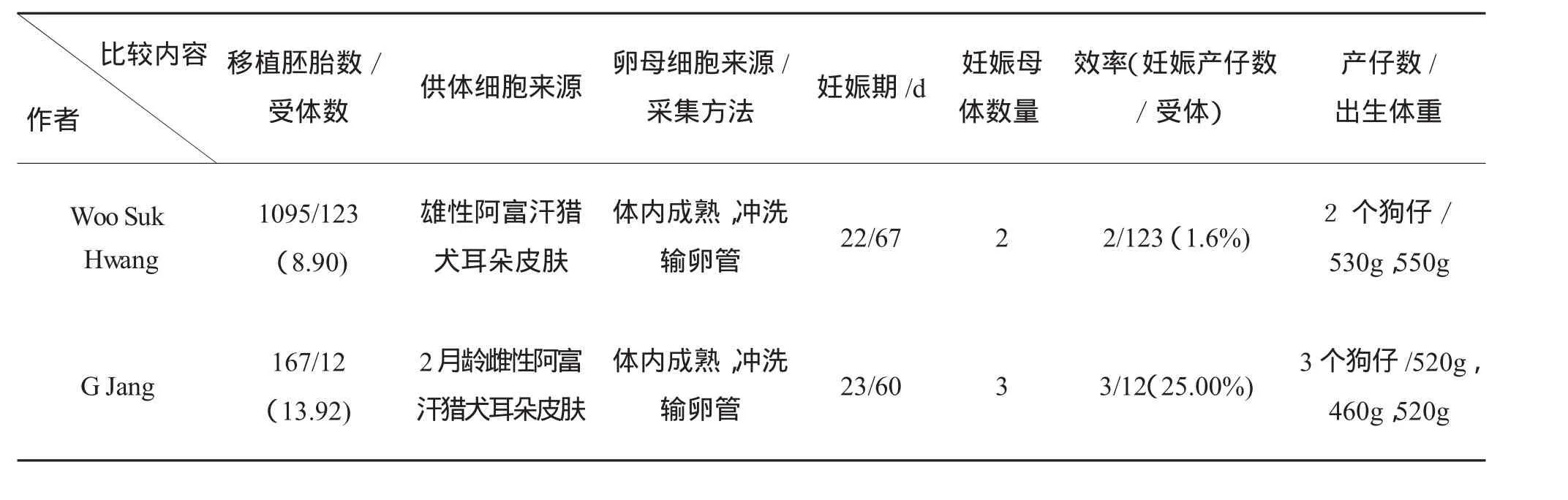
表1 狗体细胞克隆方法效率比较
4 克隆犬发展前景
犬是犬科动物中较早被驯化的,与人类关系亲近。根据考古学记载,自1万5 000年以前,犬就与人类结下不解之缘。2005年12月8日美国科学家在《自然》杂志上宣布[32],研究人员成功破解犬的全部基因密码,并发现在1.93万个犬的基因中,至少有1.8 473万个与已经识别的人类基因相同,这表明人与犬不但有共同祖先,而且亲缘关系较近,犬中多数遗传疾病与人类遗传疾病相似。因此,体细胞核移植技术在犬上有以下几个方面应用前景:(1)利用动物克隆技术可以拯救濒危犬科动物。(2)利用体细胞核移植技术生产转基因克隆犬,生产具有重要药用价值的活性物质。(3)利用优良犬品种体细胞作核供体克隆优秀子代动物,可以避免自然条件下选种所受动物生殖周期和生育效率限制,大大缩短育种年限,提高育种效率。(4)疾病模型和机理研究。利用体细胞核移植技术,转入与肿瘤和癌发生有关基因,生产转基因动物,研究基因表达和调控规律,为肿瘤和癌症治疗提供依据。
[1]Wilmut I,Schnieke A E,McWhir J.et al.Viable offspring derived from fetal and adult mammalian cells[J].Nature,1997,385:810-813.
[2]BaguisiA,BehboodiE,MelicanDTetal.Productionofgoats bysomaticcellnucleartransfer[J].NatBiotechnol,1999,17:456-461.
[3]Keefer C L,Baldassarre H,Keyston R,et al.Generation of dwarf goat(Capra hircus)clones following nuclear transfer with transfected and nontransfected fetal fibroblasts and in vitromaturedoocytes[J].BiolReprod,2001,64:849-856.
[4]Cibelli.,J.B,Stice,S.Glueke,P.J.,et al..Cloned transgenic calves produced from Non-quiescent fetal fibroblasts[J].Science,1998,280:1256-1258.
[5]Wells D N,Misica P M,Tervit H R.Production of cloned calves following nuclear transfer with cultured adult mural granulosacells[J].Biol Reprod,1999,60:996-1005.
[6]Polejaeva I A,Chen S H,Vaught T D,et al.Cloned pigs produced by nuclear transfer from adult somatic cells[J].Nature,2000,407:86-90.
[7]T.Wakayama.,et al.Full-term development of mice from nucleated oocyte injected with cumulus cellnuclei[J].Nature,1998,394:369-374.
[8]Wakayama T,Shinkai Y,Tamashiro KL,et al.Cloning of micetosixgenerations[J].Nature,2000,407:318-319.
[9]Ono Y,Shimozawa N,Ito M,et al.Cloned mice from fetal fibroblast cells arrested at metaphase by a serial nuclear transfer[J].BiolReprod,2001,64:44-50.
[10]Chesne P,Adenot P G,Viglietta,et al.Cloned rabbits produced by nuclear transfer from adult somatic cells[J].Nat Biotechnol,2002,20(4):366-369.
[11]Xihe Li,Lee H A,Allen W R.2002.In vitro development of horse oocytes reconstructed with the nuclei offetal and adult cells[J].BiologyofReproduction,66:189-193.
[12]Byeong Chun Lee,Woo Suk Hwang et al.Dogs cloned from adultsomaticcells[J].Nature436,641(2005).
[13]G Jang,B C Lee.Birth of viable female dogs produced by somaticcellnucleartransfer[J].Theriogenology2006.
[14]MahiCA,YanagimachiR.Maturation and spermpenetration of canine ovarian oocytes in vitro[J].J Exp Zool 1976;16:189-93.
[15]Yamada S,Shimazu Y,Kawano Y,et al.Maturation,fertilizationanddevelopmentofoocytesinvitro[J].BiolReprod 1992;46:853-8.
[16]Yamada S,Shimazu Y,KawanoY,et al.In vitromaturation andfertilizationofpreovulatorydogoocytes[J].JReprod Fertil 1993;47(Suppl).:227-9.
[17]Nickson DA,Boyd JS,Eckershall PD,et al.Molecular biological methods for monitoring oocyte maturation and in vitro fertilization in bitches[J].J Reprod Fertil 1993;44(Suppl).:231-40.
[18]HewittDA,EnglandGCW.Theeffectofoocytesizeandbitch age upon nuclear maturation in vitro[J].Theriogenology 1998;49:957-66.
[19]Hewitt DA,England GCW.Synthetic oviductal fluid and oviductal cell coculture for canine oocyte maturation in vitro[J].AnimReprodSci1999;55:63-75.
[20]Metcalfe SS.Assisted Reproduction in the Bitch.Thesis for the degree ofMaster ofScience.Victoria,Australia:Monash University;1999.160.
[21]Otoi T,Fujii M,Tanaka M,et al.Effect of serum on the in vitro maturation of canine oocytes[J].Reprod Fertil Dev 1999;11:387-90.
[22]Otoi T,Fujii M,Tanaka M,et al.Canine oocyte diameter in relation to meiotic competence and sperm penetration[J].Theriogenology2000;54:535-42.
[23]Otoi T,Ooka A,Muramaki M,et al.Size distribution and meiotic competence ofoocytes obtained frombitch ovaries al variousstagesoftheestruscycle[J].Reprod FertilDev2001;13:151-5.
[24]N.Songsasen,I.YU,SP Leibo.Nuclear Maturation ofCanine OocytesCultured in Protein-Free Media.Molecular ReproductionAndDevelopment,2202,62:407-415.
[25]Monica De los Reyes,Johanna de Lange,Pedro Miranda,Jaime Palominos,ClaudioBarros.Effect ofhuman chorionic gonadotrophin supplementation during different culture periods on in vitro maturation of canine oocytes[J].Theriogenology,64(2005)1-11.
[26]童第周,吴尚勤,等.细胞核的移植.动物学报,1963,15(1):151.
[27]童第周,等.鱼类不同亚科间的细胞核移植[J].动物学报,1973,19:201.
[28]Briggs R,KingTJ.Transplantation oflivingcell nuclei from blastulacellsintoenucleatedfrog'seggs[J].ProcNatlAcadSci USA,1952,38:455-463.
[29]Dominko T,Mitalipova M,Haley.Bovine oocyte cytoplasm support development of embryos produced by nuclear transfer of somatic cell nuclei from various mammalian species[J].BiolReprod,1999,60:1496-1502.
[30]陈大元,孙青原,刘冀珑.大熊猫供核体细胞在兔卵胞质中可去分化而支持早期重构胚发育[J].中国科学,C辑,1999,29(3):324-330.
[31]Masao Murakami,Takeshige Otoi,Pimprapar Wongsrikeao etal.DevelopmentofInterspeciesClonedEmbryoinYakand Dog[J].CLONINGANDSTEMCELLS.Volume7,Number 2,2005.
[32]朱翔.美科学家成功绘制犬类基因组图谱.北京科技报.2005,12,14,第 13版.
S829.2
B
1005-2739(2010)02-0008-04
2009-11-02
王伦学,男,博士,助理研究员。

