尾叶桉Eucalyptus urophylla对8 种乡土树种的化感作用*
方碧真 , 余世孝 , 王永繁 , 褚朝军, 蔡楚雄 , 刘世平
(1.中山大学生命科学学院,广东 广州 510275;2.广州大学地理科学学院,广东 广州 510006;3.东莞植物园,广东 东莞 523079)
目前我国南方地区已成为桉树大量引种、桉树人工林广泛分布的地区。然而,桉树人工林面积的不断扩大,已经引起了严重的生态环境退化问题,如林地地力衰退,群落稳定性下降,生物多样性减少等[1-3]。与天然林相比,桉树人工林对当地动植物区系和土壤微生物区系均有不良的影响[1,4],这被认为是桉树的化感作用所导致[5-6]。有关桉树的化感作用,多数研究均以草本植物或速生的豆科植物为测试对象[7-11],我们在前面的研究中[12],以尾叶桉为供体植物,测试对象是10种乔木植物(包括7种本地种和3种引进种),结果发现,尾叶桉的化感物质因含量变化所产生的影响不同,而不同的受体植物也有相应不同的反应。作为前面研究的补充[12],本文同样采用了室内生物测试方法,通过采集新鲜完整的尾叶桉叶片,测试了叶片水提取液、叶片挥发物对另外8种受体植物种子萌发和幼苗根茎生长的影响,以期为桉树人工林的改造提供理论依据。
1 材料与方法
1.1 实验材料
本研究所采用的尾叶桉叶片采自广东省东莞市水濂山公园。8种受体植物中,只有小叶青冈Cyclobalanopsismyrsinaefolia和拐枣Hoveniadulcis的种子采自广东省黑石顶自然保护区,其余的采自广东省鼎湖山自然保护区。
在8种受体植物中,只有荷木的种子属于正常型种子,可以干藏。其他植物的种子都属于顽拗型种子,不适宜冷藏和干藏[13],需要根据不同种子的生理生态学特点进行相应的处理,包括去除假种皮、种皮蜡质层、种皮外层胶质等,再经水选阴干,混湿沙贮藏于大瓦缸中,置于阴凉处[14]。
实验前,荷木种子只需取出来,挑选饱满的籽粒,直接进行实验;其余的种子则需定时检查,同批种子中若出现发芽迹象,则需及时从湿沙中取出,剔除已发芽种子,其他的则进行充分的清洁和浸泡,并用w=0.5%高锰酸钾溶液消毒20~30 min,再用清水冲洗3次[12]。
1.2 测试方法与数据分析
本测试包括两部分:叶片水提取液的母液和1∶4、1∶7、1∶10稀释液的测试,以及在50、150、250、350 g叶片量处理中叶片挥发物的测试。叶片水提取液的母液的制备方法与文献[12]相同,其稀释液则按1∶4、1∶7、1∶10的比例,将蒸馏水加入部分母液中稀释而成。两部分测试的方法及所取得数据的分析方法都与我们前面的研究[12]相同。
所有测试都在东莞市植物园的实验室进行,测试时间为2006年2~7月,其中火力楠的测试实验失败,后于2009年3-4月重新采集了足够数量的种子,补做了测试。
2 结果与讨论
2.1 水提取液对种子萌发的影响
在种子萌发方面,不同受体植物的种子发芽率不同(见表1)。从表1可知,与对照相比,母液和3种稀释液对所有受体植物都没有表现出显著的影响(Z<1.96)。
检测化感物质对受体植物种子萌发的影响是化感物质活性研究的一种常见方法[15-16]。文献[17]在实验中得出尾叶桉叶片水提取液对江南头菜Brassicajunceavar.napiformis和芥兰头Brassicaoleraceavar.caulorapa种子发芽率的抑制分别达到了69.58%和60.72%;而其他研究则一致认为,尾叶桉叶片水提取液对受体植物种子萌发均不产生显著影响[11,18-19]。这可能与水提取液的制备方法及其浓度大小有关,也与受体植物的不同以及种子本身的生物生理学特点紧密相关。而文献[10]通过在野外桉树林下的实地测试表明,高浓度的叶片水提取液对柱花草Stylosanthesguianensis的种子萌发是有影响的,低浓度的则没有影响。可见水提取液的浓度高低是化感作用能否对种子萌发产生显著影响的重要因素。
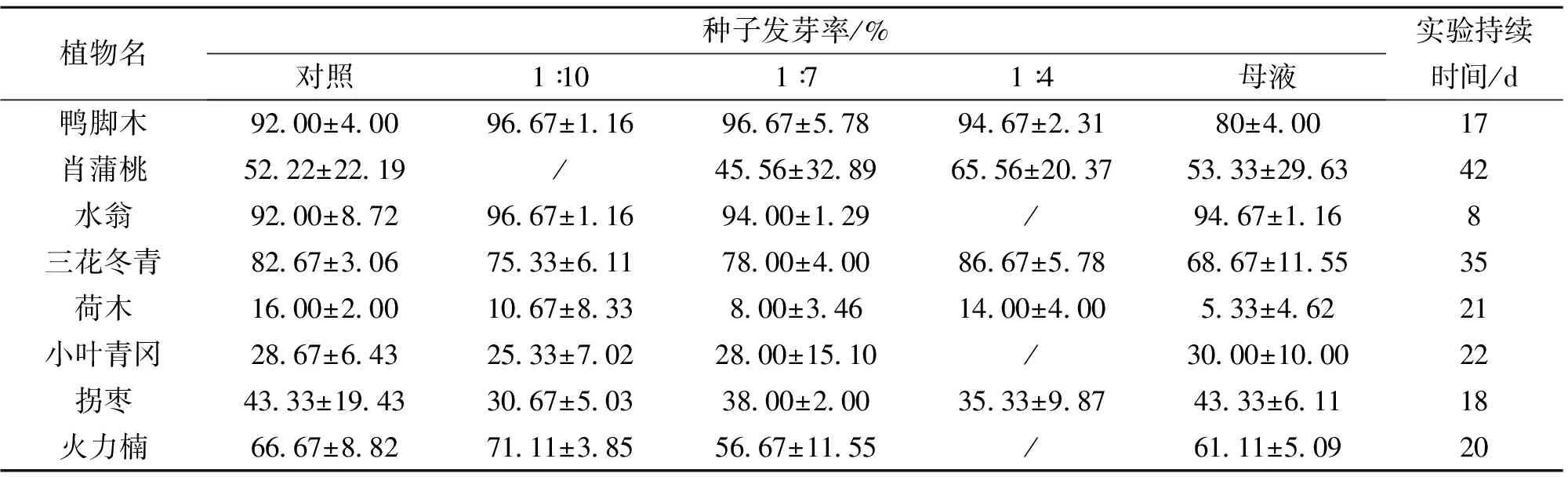
表1 叶片水提取液对受体植物种子发芽率的影响1)
1) / 表示数据缺失
2.2 水提取液对幼苗根茎生长的影响
在幼苗根生长方面,水提取液的影响结果见图1。从图可见,母液只对其中4种受体植物产生了显著(P<0.05)或极显著(P<0.01)的影响,其中鸭脚木和三花冬青的根长分别减少了75.28%和43.67%,抑制作用达到极显著水平(P<0.01),肖蒲桃的根长减少了31.42%,抑制作用达到显著水平(P<0.05),但小叶青冈的根长则增加了133.91%,促进作用达到了极显著水平(P<0.01)。对另外4种植物则影响不显著(P>0.05),3种稀释液对所有受体植物均无显著影响(P>0.05)。

图1 叶片水提取液对受体植物幼苗根长的影响
水提取液对幼苗茎生长的影响与根的情况略有不同(图2)。由图可知,母液只对其中2种植物产生了显著(P<0.05)或极显著(P<0.01)的影响,其中使肖蒲桃的茎长减少了34.31%,产生了显著(P<0.05)的抑制作用,但却使拐枣的茎长增加了62.86%,表现了极显著(P<0.01)的促进作用,而对另外6种植物则影响不显著(P>0.05)。3种稀释液只对鸭脚木产生了极显著影响(P<0.01),对其余7种的影响都不显著(P>0.05)。
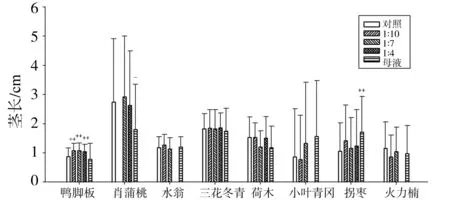
图2 叶片水提取液对受体植物幼苗茎长的影响
由上可见,尾叶桉叶片水提取液对受体植物幼苗的根茎生长的影响有抑制也有促进。其中分别有3和2种植物分别受到了母液显著抑制和显著促进,分别占受体植物总种数的37.5%和25%;只有1种植物受到了3种稀释液的显著促进,占总种数的12.5%。这说明,尾叶桉的叶片水提取液只对部分受体植物的根茎生长具有显著的化感作用,较高浓度的母液可对部分植物产生抑制或促进,但较低浓度的稀释液则完全没有显著抑制的表现。
已有的研究都认为,尾叶桉叶片水提取液对受体植物产生了抑制作用[11,18-19]。这与所选择的受体植物密切相关。本实验的受体植物全是本土阔叶树种,不同植物种对水提取液的反应各不相同,占62.5%的植物种的幼苗根茎生长表现出不受显著抑制,其中25%的植物种受到了显著促进。
2.3 挥发物对种子萌发的影响
尾叶桉叶片挥发物对8种受体植物种子萌发的影响见表2。从表中数据可见,在50 g 和150 g处理中,所有植物的种子发芽率都没有受到显著抑制作用,其中只有拐枣在150 g处理中的发芽率(57.33%)比对照增加了72.01%,显示出受到了显著的促进作用(Z>1.96);在250g处理中,荷木的种子发芽率为2.67%,比对照下降了85.70%,抑制作用达到了极显著(Z>2.58)水平;在350 g处理中,肖蒲桃和荷木的种子发芽率分别为37.78%和0,分别比对照下降了50%和100%,抑制作用达到了极显著水平(Z>2.58)。这与文献[11,18-19]的研究结果基本一致。

表2 叶片挥发物对受体植物种子发芽率的影响1)
1) * 表示受到显著抑制或促进(Z>1.96),** 表示受到极显著抑制或促进(Z>2.58);/ 表示数据缺失
2.4 挥发物对幼苗根茎生长的影响
尾叶桉叶片挥发物对受体植物的幼苗根生长的影响见图3。在 50、150、250和350 g处理中都受到显著(P<0.05)或极显著(P<0.01)抑制作用的只有三花冬青1种;在50 g处理中影响不显著,但在150、250和350 g处理中都受到显著(P<0.05)或极显著(P<0.01)抑制作用的种有荷木、拐枣和火力楠,共3种植物;在50 g和150 g处理中不受显著影响,但在250 g和350 g处理中受到显著(P<0.05)或极显著(P<0.01)抑制作用的种有鸭脚木、肖蒲桃和水翁,共3种植物;在50 g、250 g处理中不受抑制,只在350 g处理中受到显著(P<0.05)抑制作用的只有小叶青冈1种。
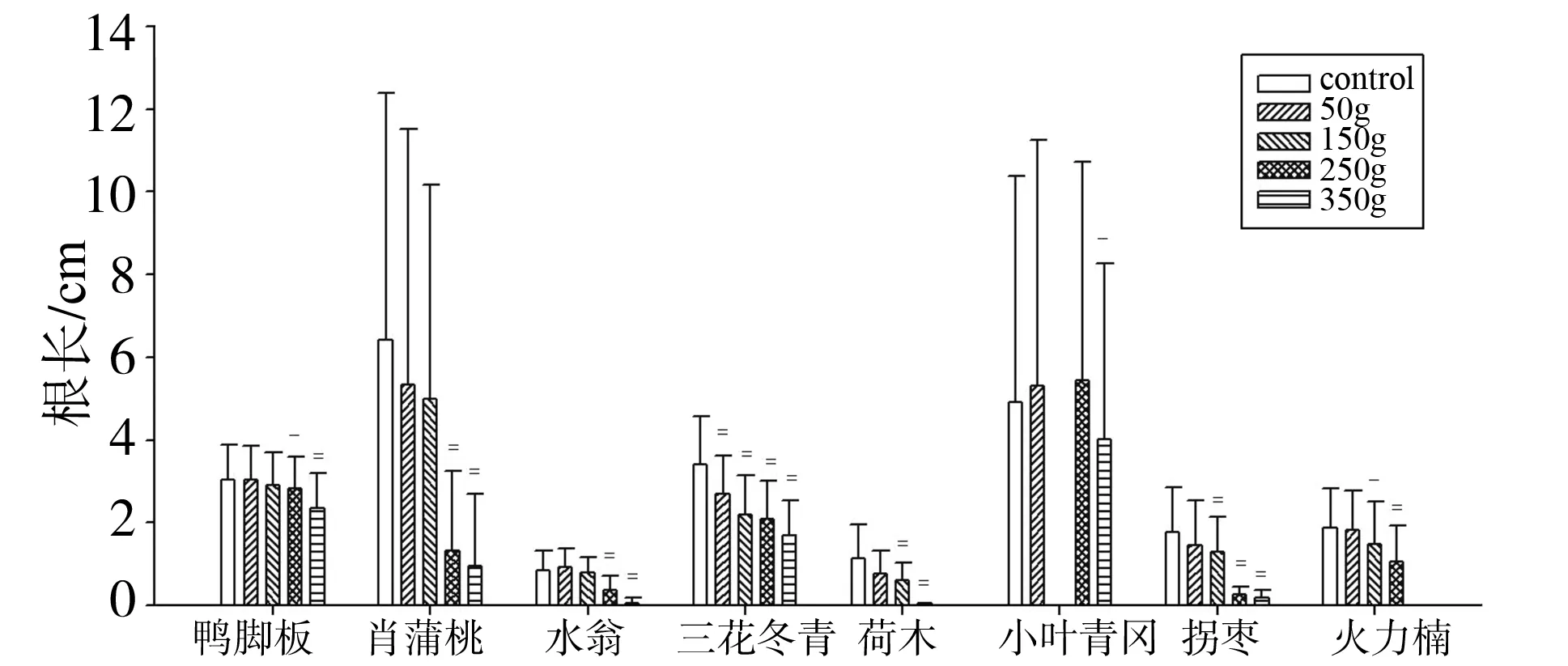
图3 叶片挥发物对受体植物幼苗根长的影响
尾叶桉叶片挥发物对受体植物的幼苗茎生长的影响见图4。在 50、150、250和350 g处理中都受到显著(P<0.05)或极显著(P<0.01)抑制作用的有肖蒲桃、荷木、拐枣和火力楠,共4种植物;在50 g处理中影响不显著(P>0.05),但在150、250和350 g处理中都受到了极显著(P<0.01)抑制作用的只有三花冬青1种植物;在50~250 g处理中不受抑制,只在350 g处理中受到显著(P<0.05)或极显著(P<0.01)抑制作用的有鸭脚木和小叶青冈2种植物,其中鸭脚木在50 g和150 g处理中还受到显著的促进作用(P<0.05);完全不受显著影响(P>0.05)的只有水翁1种。
由此可见,尾叶桉叶片挥发物对受体植物幼苗根茎生长的影响,总体上表现为随着挥发物浓度的增加,抑制作用逐渐增强,受抑制的植物种数逐渐增多。而已有的研究[11,18-19]都认为,尾叶桉叶片挥发物对受体植物的幼苗生长产生了抑制作用,本实验的研究结果,支持了这一观点。

图4 叶片挥发物对受体植物幼苗茎长的影响
3 结 语
尾叶桉叶片水提取液对所有受体植物的种子萌发都没有显著影响,但对部分植物的幼苗根茎生长具有显著的化感作用,其中较高浓度的母液可对37.5%和25%的受体植物产生显著的抑制和促进作用,但较低浓度的稀释液则完全没有产生显著抑制作用的表现,只对个别植物产生促进作用。
尾叶桉叶片挥发物对受体植物生长的影响,表现出随着浓度的增加,抑制作用逐渐增强的趋势。在种子萌发方面,挥发物在较高浓度(如350 g处理)时,可对25%的受体植物产生显著的抑制作用,但在较低浓度(如50 g处理)时,对所有受体植物都没有显著影响;在幼苗根茎生长方面,挥发物在较高浓度(如350 g处理)时,可对100%的受体植物产生显著的抑制作用,但在较低浓度(如50 g处理)时,只对50%的受体植物产生了显著抑制。
总体而言,尾叶桉具有化感作用,其强度因化感物质含量不同而变化,而不同的受体植物产生的反应不同。尾叶桉叶片挥发性化感物质的化感作用强度要比水提取液的高,而幼苗根茎生长比种子萌发更易受化感物质的抑制。
参考文献:
[1] 余雪标,李维国. 桉树人工林的若干生态问题及其研究进展[J]. 热带林业科学,1997(4): 60-68.
[2] 王震洪,段昌群,起联春,等. 我国桉树林发展中的生态问题探讨[J]. 生态学杂志,1998,17(6): 64-68.
[3] 谢耀坚.中国桉树人工林可持续经营战略初探[J]. 世界林业研究,2003,16(5): 59-64.
[4] 陈秋波. 桉树人工林土壤生物多样性问题研究[J]. 热带农业科学,2002,22(1):66-76.
[5] LISANEWORK N,MICHELSEN A. Allelopathy in agroforestry systems: the effect of leaf extract ofCupressuslusitanicaand threeEucalyptusspp. on four Ethiopian crops[J]. Agroforestry Systems,1993,21: 63-74.
[6] BEHERA N,SAHANI U. Soil microbial biomass and activity in response toEucalyptusplantation and natural regeneration on tropical soil[J]. Forest Ecology and Management,2003,174: 1-11.
[7] FLORENTINE S K,FOX J E D. Allelopathic effects ofEucalyptusvictrixL. on Eucalyptus species and grasses[J]. Allelopathy Journal,2003,11(1): 77-84.
[8] BATISH D R,SETIA N,SINGH H P,et al. Phytotoxicity of lemon-scented eucalypt oil and its potential use as a bioherbicide[J]. Crop Protection,2004,23(12): 1209-1214.
[9] MALIK M S. Effects of aqueous leaf extracts ofEucalyptusglobuluson germination and seedling growth of potato,maize and bean[J]. Allelopathy Journal,2004,14(2):213-220.
[10] 杨小波,李东海,李跃烈. 桉树人工林土壤环境对植物种子发芽和生长的影响[J]. 林业科学,2006,42(12):148-153.
[11] 丘娴,余世孝,方碧真,等. 尾叶桉对四种豆科植物的化感作用[J]. 中山大学学报:自然科学版,2007,46(3):88-92.
[12] FANG Bizhen,YU Shixiao,WANG Yongfan,et al. Allelopathic effects ofEucalyptusurophyllaon ten tree species in south China[J]. Agroforestry Systems,2009,76: 401-408.
[13] ROBERTS E H. Predicting the storage life of seeds[J]. Seed Sci Technol,1973,1: 499-514.
[14] 冉春燕,陶建平,宋利霞. 亚热带常绿阔叶林几种乔木种子萌发特性研究[J]. 西南农业大学学报:自然科学版,2005,27(6):753-756.
[15] 曾任森. 化感作用研究中的生物测定方法综述[J]. 应用生态学报,1999,10(1): 123-126.
[16] 杨期和,叶万辉,廖富林,等. 植物化感物质对种子萌发的影响[J]. 生态学杂志,2005,24(12): 1459-1465.
[17] 黄卓列,林韶湘,谭绍满,等. 尾叶桉等植物叶提取液对几种植物插条生根和种子萌发的影响[J]. 林业科学研究,1997,10(5): 546-550.
[18] 曾任森,李蓬为. 窿缘桉和尾叶桉的化感作用研究[J]. 华南农业大学学报,1997,18(1): 6-10.
[19] 曾杰,翁启杰,郑海水. 几种桉树生化他感作用的生物测定[J]. 林业实用技术,2004(6):4-5.

