昆明市3种草坪草根际镰孢菌的分离鉴定
张成霞
(西南林业大学园林学院,云南昆明 650224)
镰孢菌是真菌的一个重要类群,分布广泛,是最重要的病原菌之一,引起植物根腐、根颈腐烂、立枯、萎蔫等多种病害[1-3];侵染寄主植物引起的萎蔫病是生产上最难防治的重要病害之一[4]。近10年,对镰孢菌侵染植物寄主并造成植物萎蔫的致病机理、病原菌在植物体内的扩展动态规律以及利用分子生物学技术研究镰孢菌的遗传变异等,国内外作了大量的研究报道[5]。自1999年世界园艺博览会在昆明召开以来,昆明市草坪种植面积大幅增加,草坪病害也随之不断增加。如今,镰孢菌引起的病害是昆明地区草坪草的主要病原菌之一[6]。然而,镰孢菌的分类学是镰孢菌生物学的各个领域研究的基础,也是当今世界上的一大难题,从1809年Link建立镰孢菌属以来,大约有50多种不同种类的镰孢菌株得到定名[7];迄今为止,用于镰孢菌属的种类划分已经有10种不同的分类系统[8],以往的镰孢菌分类中,负仑委贝(Wollenweber)系统和施奈德(Snyder)系统应用可以说是代表了种的观念上的两个对立面,前者采取小种化的作法,后者抱大种化的立场,两种极端,各有弊病;Booth以 Wollenweber系统为基础,吸收了Snyder系统的合理部分,推出了44种分类系统,受到了人们的普遍欢迎,也得到我国镰刀菌工作者的充分肯定[9,10]。采用Booth的分类系统,对云南省昆明市主要种植的3种草坪草根际土壤镰孢菌进行分离培养,并对其进行鉴定,以期能为该地区草坪草病害防治奠定一定的基础。
1 材料和方法
1.1 标本的采集
2009年7月16日,分别采集昆明市高羊茅、多年生黑麦草和草地早熟禾根际样品,装入无菌封口聚乙烯袋,带回室内即分离植物根际土壤真菌。
1.2 方法
1.2.1 镰孢菌的分离及纯化 选用马铃薯蔗糖培养基(PSA)[11],采用洗根法分离根际真菌[12],对分离所得菌株进行筛选,并采用单孢分离[13,14],将单孢菌株在柏斯条件下进行培养[9,10]。
1.2.2 培养性状的测定及形态鉴定 培养5 d后,测定菌落直径,并对镰孢菌的小型分生孢子形状,大小,着生方式;产孢细胞的类型,大小;大型分生孢子形状,数量,着生方式,大小,分隔;子实体类型,分生孢子座,粘孢团;厚垣孢子等进行观察和显微照相。
2 结果与分析
2.1 高羊茅根际镰孢菌形态
2.1.1 黄色镰孢 5 d后菌落直径48 mm,菌落白色,微显黄褐色,气生菌丝较繁茂,絮状,稍有结团现象,菌背淡黄褐色,中部有褐色小点,菌丝无色。产孢梗长短不等,上部丛生成。大型分生孢子纺锤型,镰刀型,弯曲,端部尖细,一般 2~5隔,大小 14.8~32.1×2.42~4.84(23.6×4.43)μ m;小型分生孢子椭圆形,卵形,瓜子形,大小 8.8~19.8×2.2~4.4(14.3×3.3)μ m(图 1)
2.1.2 茄病镰孢[Fusariun solani(Mart)Sacc]5 d后菌落直径35 mm,菌落白色,中等繁茂,生长均匀,较稀疏,菌背略呈白色,后期底部由内到外变桃红色。产孢梗单瓶梗,多分枝。大型分生孢子极少,小型分生孢子特别多,无色,棒状,两端圆,大小差异大,大小4.6~16.6×1.56~4.8(6.3×3.18)μ m 。
2.2 多年生黑麦草根际镰孢菌形态
2.2.1 茄病镰孢[Fusariun solani(Sacc)Booth]5 d后菌落直径31 mm,菌落白色,中等繁茂,菌落上层细密,生长均匀,中部厚边缘薄,中部有一灰兰圈环,内部有灰兰色细点,菌背环内有放射状兰绿色小点。产孢梗单瓶梗,在菌丝顶端形成,长短不等;大型分生孢子棒状,直或弯曲,两端稍圆,2~7隔(多3~4隔),大小18.82~37.63×4.12~5.88(30.10×4.89)μ m;小型分生孢子椭圆形,肾形,1~2隔,大小7.06~19.99×2.35~4.70(11.66×3.57)μ m(图1~3)。
2.2.2 尖孢镰孢 5 d后菌落直径44 mm,菌落白色,生长快,棉絮状,繁茂,有少量团絮;菌底桃红—紫红色,有些内部有黄色斑块或黄色放射状条纹。产孢梗单瓶梗;大型分生孢子美丽型,3~4隔,大小 9.9~22.2×2.2~4.4 μ m小型分生孢子长椭圆形,香蕉形,短杆状,0~1隔,大小4.70~16.46×2.53~3.53 μ m 。
2.3 草地早熟禾根际镰孢菌形态
2.3.1 茄病镰孢[Fusarium solani(Mart)Sacc]5 d后菌落直径25 mm,菌落白色至淡灰绿色,平坦,繁茂,细绒状,菌背略呈现淡蓝绿色放射线及轮纹,菌丝无色,上生许多孢子球。大型分生孢子较少,多数美丽型,少数为马特型,多1~2隔,大小 16.46~25.87×2.94~4.70 μ m;小型分生孢子较多,长椭圆形,短杆状,大小 8.5~16 ×2.7~3.5 μ m;产孢梗直 ,很长 ,二分杈,顶生孢子及孢子球。
2.3.2 雪腐镰孢 5 d后菌落直径46 mm,菌落土黄色,稀薄,平铺,细绒状,菌背土黄色,菌丝无色。大型分生孢子弯月形,两端尖,大多有一格,少数无格,大小11.47~14.11×2.39~2.46 μ m;小型分生孢子很少,椭圆形,大小 3.57~8.63×1.96~2.55 μ m;孢子球很多,未见产孢梗。(图1~6)。
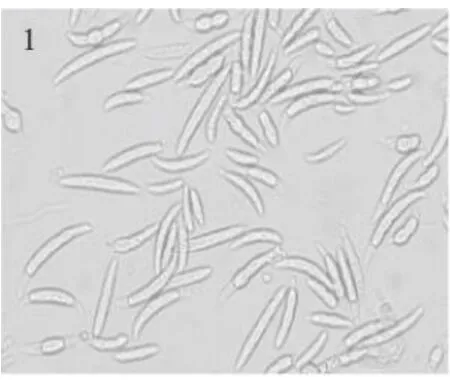
图1 黄色镰孢Fig.1 Fusariumeulmorum
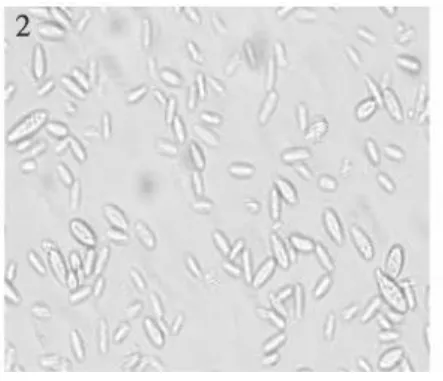
图2 茄病镰孢Fig.2 Fusarium solani
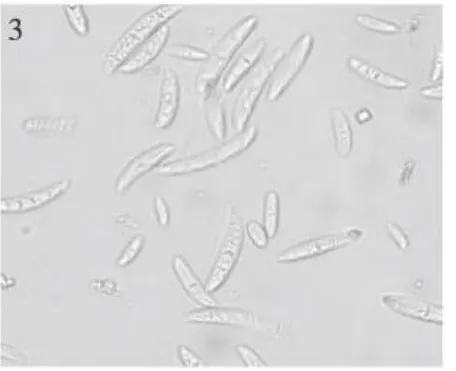
图3 茄病镰孢Fig.3 Fusarium solani
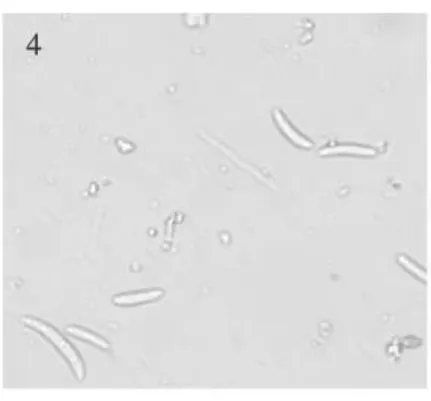
图4 尖孢镰孢Fig.4 Fusariumoxysporum
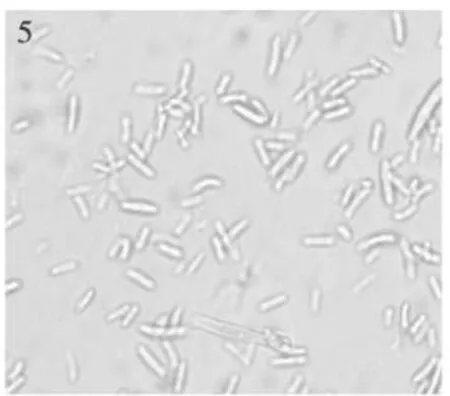
图5 茄病镰孢Fig.5 Fusarium solani

图6 雪腐镰孢Fig.6 Fusarium nivale
3 讨论
在传统的真菌分类学研究中,孢子的性状一直都是比较和研究的重点,镰孢菌也不例外,其分生孢子的长度和宽度被认作是分种的主要依据。镰孢菌是一类较难鉴定的真菌,柏斯分类鉴定系统是目前世界较普遍使用的方法之一。他对分生孢子梗的性状,鉴定培养基、培养方法及条件标准化的做法都较稳定。根据柏斯鉴定系统,在3种草地中共鉴定出4种镰孢菌,他们分别是茄病镰孢、黄色镰孢、尖镰孢和雪腐镰孢,其中茄病镰孢在高羊茅、多年生黑麦草、草地早熟禾草根际的孢子大小及单孢分离性状等有差异,他们可能为该种的不同专化型,有待继续研究鉴定;另外,不同的菌株,即使是在相同的条件下,他们之间也还会存在一定的差异。张祖新等研究发现,草坪草镰孢菌腐烂病的病原至少有 6种:F.acuminatum、F.roseum、F.tricinctum 、F.graminearuin、F.culmorum 和 F.rookwellenseum等[17]。许多研究表明,土壤中镰孢菌的多样性水平非常高,而且土壤中镰孢菌多样性水平对其中致病菌的种群动态及寄主的抗性表现也会产生一定的影响[18]。近年来,rDNA ITS序列分析已用于镰孢菌的分子鉴定,在形态鉴定的基础上用分子系统学澄清了该属许多种间、种内系统发育关系、有性型与无性型的联系,而且使得分类系统学本身得也到了进一步的发展[19-21],因此,对于镰孢菌的鉴定应该同时采取多项分类法。本研究通过形态学观察,从昆明市各草坪根际分离镰孢菌菌株鉴定出4个种,对于昆明市植物检疫、植物镰孢菌病害防治和镰孢菌资源的利用,具有一定的参考价值。
[1]Nyvall R F,Percich J A,Mirocha C J.Fusarium head blight of cultivated and natural wild rice(Zizania palustris)in Minnesota caused by Fusarium graminearum and associated Fusarium spp.[J].Plant Disease,1999,83:159-164.
[2]Wingfield M J,Hammerbacher A,Ganley R J,et al.Pitch canker caused by Fusarium circinatum-a growing threat to pine plantations and forests worldwide[J].Australasian Plant Pathology,2008,37:319-334.
[3]Morgavi D,Riley R T.An historical overview of field disease outbreaks known or suspected to be caused by consumption of feeds contaminated with Fusarium toxins[J].Animal Feed Science and Technology,2007,137:201-212.
[4]Kistler H C,Alabouvette C,Baayen R P.etal.Systematic Numbering of Vegetative Compati-bility Groups in the Plant Pathogenic Fungus Fusarium oxysporum[J].Phytopathology,1999,88:30-32.
[5]王建明,郑经武,贺运春,等.西瓜枯萎病在植株体内的存在状态、数量分布及扩展规律的研究[J].中国农业科学,1993,26:69-74.
[6]刘素青.昆明城区草坪常见病害调查与防治[J].云南农业科技,2005(4):30-32.
[7]Kvas M,Marasas W F,Wingfield B D,et al.Diversity and evolution of Fusarium species in the Gibberella fujikuroi complex[J].Fungal Diversity,2009,34:1-21.
[8]林清洪,黄志宏.镰刀菌研究概述[J].亚热带植物通讯,1996,25(1):51-56.
[9]布斯.镰刀菌[M].陈其英,译.北京:农业出版社,1988.
[10]Booth C.The genus Fusarium[M].Commonwealth mycological institute,1971.
[11]魏景超.真菌鉴定手册[M].上海:上海科学技术出版社出,1979.
[12]中国科学院南京土壤研究所.土壤微生物研究方法[M].北京:科学出版社,1985.
[13]钱存柔,黄仪秀.微生物学实验教程[M].北京:北京大学出版社,1999.
[14]龚国淑,徐琴,张敏,等.一种简便的病原真菌单孢分离方法研究[J].玉米科学,2010,18(1):126-127,134.
[15]郭明霞,贺运春,洪坚平,等.山西省忻州地区土壤镰刀菌(Fusarium)种类鉴定[J].山西农业大学学报,2006,26(2):171-173.
[16]张俊忠,陈秀蓉,杨成德,等.东祁连山高寒草地土壤5种镰孢菌的形态鉴定和ITS rDNA分析[J].草原与草坪,2010,30(2):33-37.
[17]张祖新,郑巧兰,王文丽,等.草坪病虫草害的发生及防治[M].北京:中国农业科技出版社,1999.
[18]Alves-Santos F M,Benito E P,Elsava A P,etal.Genetic Diversity of Fusarium oxysporum Strain from Common Bean Fields in Spain[J].Applied and Environmental Microbiology,1999,65:3335-3340.
[19]Suga H,Hasegawa T,Mitsui H,et al.Phylogenetic analysis ofthe phytopathogenic fungus Fusarium solani based on the rDNA-ITS region[J].Mycologica Research,2000,104(10):1175-1183.
[20]Tomasz K,Gabriel F,Agnieszka P,et al.Development of PCR assay based on ITS rDNA polymorphism for the detection and differentiation of Fusarium sporotrichioides[J].FEMS Microbiology Letters,2004,239:181-186.
[21]Mattila T,M ach R L,Alekhina I A,et al.Phylogenetic relationship of Fusarium langsethiae to Fusarium poaeand Fusarium sporotrichioidesas inferred by IGS,ITS,βtubulin sequences and UP-PCR hybridization analysis[J].International Journal of Food Microbiology,2004,95(3):267-285.

