BCB筛选后的绵羊卵母细胞中母源基因mRNA表达量的差异性分析
王 静 ,石庆华 ,林嘉鹏 ,陈 博 ,汪立芹 ,赵云程 ,黄俊成
(1.新疆农业大学农学院,乌鲁木齐 830052;2.新疆畜牧科学院农业部家畜繁育生物技术重点开放实验室,新疆畜牧科学院生物技术中心,乌鲁木齐 830000)
许多研究证明,卵母细胞的核成熟和胞质成熟对于受精后正常的胚胎发育是至关重要的[1],尤其是对于体外胚胎生产、动物克隆、转基因、胚胎干细胞等胚胎生物技术的研究,胞质的成熟直接关系到能否使供体核实现彻底的再程序化及重构胚能否维持正常的分裂发育[2]。常用的鉴别卵母细胞质量的方法,是根据包裹于卵母细胞上颗粒细胞的多少和紧密程度、卵母细胞质色泽及均匀度等,但这种方法主观性太强。Mangia等[3-4]通过对小鼠的研究发现,葡萄糖6磷酸脱氢酶(G6PDH)在生长中的卵母细胞中表现为活性状态;处于生长期之后的卵母细胞中,其G6PDH显著下降,而G6PDH活性的不同,亮甲酚蓝染色(BCB)呈现不同程度的着色原理,筛选出细胞质着蓝色的卵母细胞为阳性组(BCB+),细胞质不着蓝色的为阴性组(BCB-),在对猪[5-7]、山羊[8-10]、牛[11-14]、鼠[15]、犬[16]的研究证实,BCB+卵母细胞体外培养效率显著高于BCB-卵母细胞,但很少见到BCB在绵羊卵母细胞上研究的报道。
卵母细胞发育过程中积累的母源mRNA及其编码蛋白至少可支持从卵母细胞至1细胞胚胎期间的发育,同时这些母源物质可能还参与合子基因组的激活,促使胚胎进一步发育[17],所以母源基因表达模式对于早期胚胎发育的重要性引起人们的关注。目前已发现大约100多种与小鼠早期胚胎发育相关的卵母细胞基因,但是研究透彻的还比较少[18],尤其关于绵羊卵母细胞结合BCB染色的研究则更少。其中Mater、Zar1、Dnmt1和Gdf9四个母源基因是目前发育生物学领域研究的热点。Gdf9主要在哺乳动物的卵巢卵母细胞中特异表达[19],Gdf9基因敲除的小鼠,卵泡发育停滞在初级卵泡阶段,使卵母细胞生长和减数分裂及颗粒细胞的分化受阻[20];Mater是一种卵胞质特异表达蛋白,Mater基因敲除后,小鼠胚胎发育阻断在2细胞期[21];Zar1在卵母细胞及小鼠1细胞期胚胎中大量表达,主要定位于胞浆,Zarl缺失的小鼠胚胎大多停留在1细胞期,且不能受孕[22];Dnmt1是胚胎发生中保持基因甲基化的关键酶,Dnmt1失活对小鼠胚胎的发育有致命性影响[23]。
以往在对BCB筛选卵母细胞的研究中,通常只用体外培养的途径证明其有效性,本文即通过检测母源基因的表达差异,证明BCB对绵羊卵母细胞的筛选作用。从而判断4种母源基因是否与卵母细胞的胞质成熟有关,为哺乳动物卵母细胞成熟和早期胚胎发育分子机理的研究提供参考。
1 材料与方法
1.1 卵母细胞的获取 本实验所用卵巢取自当地一屠宰场,从半小时内宰杀的绵羊体内剪下卵巢,放入温度为30℃左右的加有青霉素(1 000 u/mL)和链霉素(1 000 u/mL)的灭菌生理盐水保温杯内,运回实验室后,卵巢用灭菌生理盐水清洗3次,抽吸卵巢表面直径为2~6 mm的卵泡,在显微镜下挑选出含有完整颗粒细胞层、胞质均匀的卵母细胞。(抽卵液成分为:TCM199-hepes(Sigma)+1mg/mL PVA(Sigma)+0.7 mg/mL 肝素钠(Sigma)
1.2 BCB染色液 卵母细胞在38℃水浴内用浓度为26μmol/L的亮甲酚蓝染色液染色90min后,细胞质着蓝色的卵母细胞为阳性组(BCB+),细胞质不着蓝色的为阴性组(BCB-)。
1.3 卵母细胞体外成熟培养 分级后的卵母细胞用成熟培养液洗涤3次,按20~30枚/滴的密度将卵母细胞放入覆盖矿物油(Sigma)的50μL成熟液滴,在38.6℃、5%CO2、饱和湿度的培养箱内培养24h。
成熟培养液的成分为TCM199-HCO3(Sigma)+10%FBS(v/v)(GIBCO)+0.05 u/mL FSH(Sigma)+0.05u/mL LH(Sigma)+1μg/mL estradiol (Sigma)+24.2mg/L sodium pyruvate(Sigma)+0.1mM cysteamine (Sigma)+10 ng/mL EGF(Sigma)。
1.4 卵母细胞体外受精 将体外成熟24h的卵母细胞在0.1%透明质酸酶液内轻轻吹吸,除去大部分颗粒细胞,用受精液充分洗涤3次后,按20~30枚/滴的密度放入平衡好的50μL受精液滴内。
使用上游方法分离精子。从液氮内取出冻精放入39℃水浴内试管中解冻,把解冻的精液等分轻轻加入已平衡好的装有0.5mL受精液的两个离心管底部,放入38.6℃、5%CO2、饱和湿度的培养箱中上游20 min,按2×106个/mL的精子密度将稀释好的精子混悬液加入受精液滴,与卵母细胞在38.6℃、5%CO2的饱和湿度的培养箱内共同孵育18h。
受精液成分为:SOF+20%发情羊血清+6 u/mL肝素钠+100 u/mL庆大霉素。
1.5 胚胎体外培养 体外受精18h后,在胚胎培养液内用小口径吸管轻轻吹吸假定受精胚,脱去颗粒细胞,洗涤3次后,将50~80枚胚胎放入500μL培养液的四孔板内,在 38.6℃、5%CO2、5%O2,90%N2、饱和湿度的密封气袋内培养。

1.6 卵母细胞总RNA提取与RT-PCR 将收集的卵母细胞用 PBS(GiBco without Ca2+、Mg2+)洗 3 遍,放入 DEPC水处理过的1.5mL离心管中,10 000 r/min离心1 min,小心吸去上清液,按照RNeasy Micro Kit(QIAGEN)试剂盒介绍的方法提取卵母细胞总RNA。
RT-PCR体系:将1μg总RNA与1μL随机六聚物引物混合后,RNase free water补足至 14.5μL,70℃ 10 min,冰浴 10 min,瞬时离心后加入 RNA inhibitor 0.5μL,5 ×buffer2μL,10mmol/L dNTP 2μL,AMV 1μL(TaK aRa),42 ℃ 40 min。
1.7 标准曲线的制作 分别把Mater、Zar1、Dnmt1、Gdf 9基因和18S rRNA与pMD20-T载体进行连接,用限制性内切酶EcoRⅤ将各个基因的质粒线性化,并将各个基因线性化的质粒进行浓度稀释后制作标准曲线。
分别根据GeneBank 中绵羊 Mater、Zar1、Dnmt1、Gdf 9和18S rRNA序列,用Oligo 6.0软件设计上述基因的PCR扩增的上下游引物。
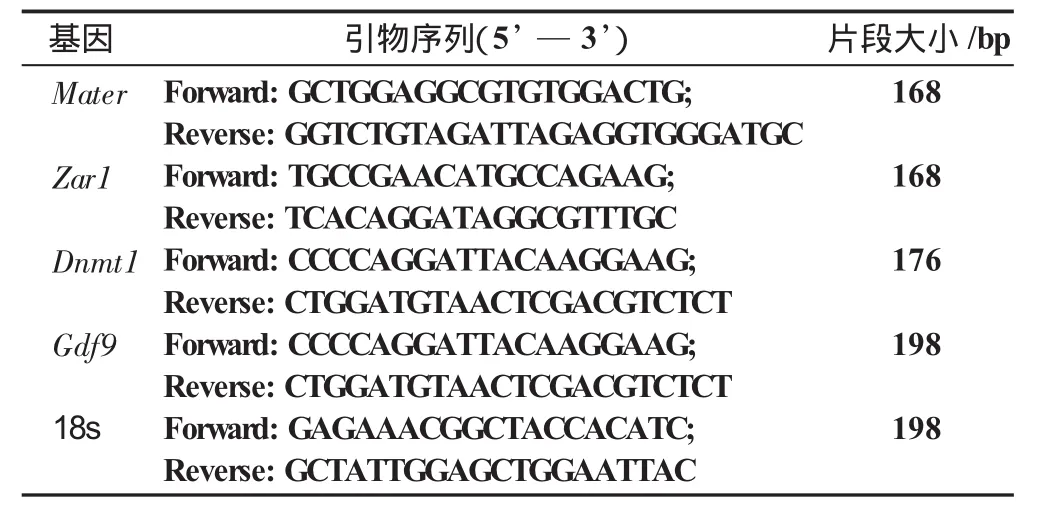
表1 实时定量引物序列
1.8 Quantitative RT-PCR检测 Quantitative RT-PCR反应体系:2 μL标准质粒和样品cDNA,上下游引物各5 pM,2 ×FastStart DNA Master SYBR Green I 10 μL(QIA GEN),加 RNase free water至 20 μL。反应条件:95 ℃预变性10 min,55个循环中包括95℃10 s,60℃20 s以及72℃20 s。熔解曲线从40~99℃,每秒增加2℃,并收集荧光信号。为减小误差,将quantitative RT-PCR重复一次,以平均值参与分析。
1.9 数据统计与分析 体外培养成熟率:BCB染色后经体外培养排出第一极体的卵母细胞数占总卵母细胞数的百分比统计为体外培养成熟率。数据采用平均数±标准差表示。
卵裂率:BCB染色后的卵母细胞经体外受精后,发生卵裂的卵母细胞数占总卵母细胞数的百分比记为卵裂率。数据采用平均数±标准差表示。
囊胚率:受精当天设为第0天,第7天统计囊胚率(囊胚数/卵数)。数据采用平均数±标准差表示。
根据LightCycler1.5软件给出的相对定量表达结果,利用SAS 9.0软件,采用t检验进行分析处理。
2 结果与分析
2.1 BCB筛选对体外培养效率的影响 表2显示了BCB筛选后的卵母细胞体外成熟率、受精率及后期发育率的差异。BCB+卵母细胞成熟率、卵裂率、囊胚率依次为86.16%、85.29%、34.4%,分别高于BCB-卵母细胞组的50.94%、36.19%、6.73%,差异极显著(P<0.01)。

表2 经BCB选择的卵母细胞体外受精后发育率的比较(重复3次)
2.2 经BCB筛选后的卵母细胞中Gdf9、Mater、Zar1、Dnmt1基因表达水平的变化 从图1可知,4个母源基因趋势一致,经亮甲酚蓝染色筛选后的阳性卵母细胞母源mRNA相对表达量比阴性的低(P<0.01)。

图1 经BCB筛选的BCB-卵母细胞和BCB+卵母细胞成熟培养24h后母源基因mRNA表达量的差异
3 讨论
卵母细胞体内外成熟过程中最主要的差异是成熟环境的不一致,这种不一致可能会导致卵母细胞成熟度出现差异,最终影响受精结果和胚胎发育能力。而卵母细胞细胞质成熟是体外受精和早期胚胎发育所必需的。在体内成熟时,卵泡对核成熟提供抑制因子,如卵母细胞成熟抑制因子(OMI)、环腺一膦(cAMP)、嘌呤及其衍生物,从而使得核成熟和胞质成熟之间存在着最佳的平衡,核成熟与胞质成熟同步[24],这种同步化对卵母细胞的囊胚发育潜能起非常重要的作用。但在体外培养时,卵母细胞离开了卵泡的抑制环境,核质成熟出现了不同步,细胞核成熟的完成并不能保证细胞质的完全成熟,从而影响卵母细胞后期发育,并且降低卵裂率和囊胚率。本实验利用BCB染色,通过卵母细胞胞质中葡萄糖6磷酸脱氢酶(G6PDH)在成熟卵母细胞和未成熟卵母细胞胞质的活力来检测卵母细胞胞质成熟情况,从而观察这4种母源基因在卵母细胞胞质成熟与未成熟时的表达差异。通过本实验结果可知,这4种母源基因在阴性实验组中的表达量极显著高于阳性实验组(P<0.01)。
通过BCB染色原理我们可以知道,BCB+组中的胞质是成熟的,即在生长期间,各种类型的RNA合成旺盛,并进行蛋白质积累,细胞内转录已完成,在体外具有自发核成熟能力,而BCB-组中的卵母细胞可能来源于小卵泡[25]。虽然在体内有一部分RNA的合成,但未能适时适量地合成某些参与调控成熟分裂恢复的有关蛋白因子,故此卵母细胞的胞质是未成熟的。由此可知BCB+的卵母细胞由于胞质已经具备自发核成熟能力,所以BCB+的实际成熟时间要短于BCB-,由于卵母细胞成熟一旦结束,则母源RNA就开始降解[26]。这与Wang Q等[27]研究早期胚胎中的转录因子(母源性蛋白)在卵母细胞成熟过程中其含量的变化模式一致。本实验在研究这4种母源 mRNA(Mater、Zar1、Gdf9、Dnmt1)在绵羊卵母细胞及早期胚胎中的表达时发现,随着卵母细胞的成熟和胚胎的发育,表达量逐渐降低[28],而且绵羊卵母细胞的质量与这4种母源基因的表达量成反比。所以两者都成熟24h时,BCB+组比BCB-组卵母细胞的母源基因要降解的多,BCB-组比BCB+组的母源基因含量高,并且差异极显著(P<0.01)。
综上所述,通过检测母源基因的表达差异,可证明BCB对绵羊卵母细胞筛选这一方法的可行性和可靠性。从而也可判断4种母源基因与卵母细胞的胞质成熟有关,为哺乳动物卵母细胞成熟和早期胚胎发育分子机理的研究提供参考。
[1]Krisher R L,Bavister B D.Responses of oocytes and embryos to the culture environment[J].Theriogenology,1998,49:103-114.
[2]Fair T,Hyttel P,Greve T.Bovine oocyte diameter in relation to maturational competence and transcriptional activity[J].Mol Reprod Dev,1995,42(4):437-442.
[3]Mangia F,Epstein C J.Biochemical studies of growing mouse oocytes:preparation of oocytes and analysis of glucose-6-phosphate dehydrogenase and lactate dehydrogenase activities[J].Dev Biol,1975,45(2):211-20.
[4]Yanagimachi R,Knobil E,Neill J D.The physiology of reproduction[M].New York:Raven press,1988:135-85.
[5]Ericsson S A,Boice M L,Funahashi H,et al.Assessment of porcine oocytes using brilliant cresyl blue[J].Theriogenology,1993,39:214.
[6]Roca J,Martí nez E,Vázquez J M,et al.Selection of immature pig oocytes for homologous in vitro penetration assays with the brilliant cresyl blue test[J].Reprod Fertil Dev,1998,10:479-85.
[7]Shahinaz H El Shourbagy,Emma C Spikings,Mariana Freitas,et al.Mitochondria directly influence fertilisation outcome in the pig[J].Reproduction,2006,131:233-245.
[8]E Rodrí guez-González,M Lá pez-Béjar,E Velilla,et al.Selection of prepubertal goat oocytes using the brilliant cresyl blue test[J].Theriogenology,2002,57:1397-1409.
[9]Elisabeth Rodríguez-González,Manel López-Bejar,Dolors Izquierdo,et al.Developmental competence of prepubertal goat oocytes selected with brilliant cresyl blue and matured with cysteamine supplementation[J].Reprod Nutr Dev,2003,43:179-187.
[10]Aixa Urdaneta,Ana-Raquel Jiménez-Macedo,Dolors Izquierdo,et al.Supplementation with cysteamine during maturation and embryo culture on embryo development of prepubertal goat oocytes selected by the brilliant cresyl blue test[J].Zygote,2003,11:347-354.
[11]Marc Pujol,Manel Lopez-Bejar,Maria-Teresa Paramio.Developmental competence of heifer oocytes selected using the brilliant cresyl blue(BCB)test[J].Theriogenology,2004,61(4):735-744.
[12]H Alma,H Torner,B Lo hrkea,et al.Bovine blastocyst development rate in vitro is influenced by selection of oocytes by brillant cresylblue staining before IVM as indicator for glucose-6-phosphate dehydrogenase activity[J].Theriogenology,2005,63:2194-2205.
[13]S Bhojwani,H Alm,H Tomer,et al.Se lection of devel opmentally competentoocytesthrough brilliantcresylblue stain enhances blastocystdevelopmentrate afterbovine nucleartransfer[J].Theriogenology,2007,67:341-345.
[14]B M Manjunatha,P S P Gupta,M Devaraj,et al.Selection of developmentally competent buffalo oocytes by brilliant cresyl blue staining before IVM[J].Theriogenology,2007,68:1299-1304.
[15]Wu Y G,Liu Y,Zhou P et al.Selection of oocytes for in vitro maturation by brilliant cresyl blue staining:a study using the mouse model[J].Cell Res,2007,17(8):722-31.
[16]B A Rodrigues,P Rodriguez,AEF Silva,et al.Preliminary study in immature canine oocytes stained with brilliant cresyl blue and obtained from bitches with low and high progesterone serum profiles[J].Reproduction in Domestic Animals,2009,44(2):255-258.
[17]Elis S,Batellier F,Couty I.Search for the genes involved in oocyte maturation and early embryo development in the hen[J].BMC Genomics,2008,9:110.
[18]Wilmut l,schnieke A E,McWhir J.Viable offspring derived from fetal and adult mammalian cells[J].Nature,1997,385:810-813.
[19]Fitzpatrick S L,Sindoni D M,Shughrue P J.Expression of growth differ entiation factor-9 messenger ribonucleic acid in ovarian and nonovar ian rodentand human tissues[J].Endocrinology,1998,139(5):2571-2578.
[20]Takahashi Y,First N.In vitro development of bovine one cell embryos:influenceofglucose,lactate,pyruvate,aminoacidsand vitamins[J].Theriogenology,1992,37:963-978.
[21]Tong Z B,Gold L,Pfeifer K E.Mater,a maternal effect gene required for early embryonic development in mice[J].Nat.Genet,2000,26(3):267-268.
[22]Wu X,Viveiros M,Eppig J J.Zygote arrest 1(Zar1)is a novel maternal-effect gene critical for the oocyte-to-embryo transition[J].Nat Genet,2003,33(2),187-191.
[23]张莹,张秋芳,刘平.母性效应基因 Mater、Zarl的结构与功能[J].生殖与避孕,2009,29(1):59-63.
[24]Nogueira D,Cortvrindt r,De Matos D D,et al.Effect of phosphodiesterase type 3 inhibitor on developmental comptence of immature oocytes in vitro[J].Biol Reprod,2003,69:2045-2052.
[25]Yoon K W,Shin T Y,Park J I,et al.Development of porcine oocytes from preovulatory follicles of different sizes after maturation in media supplemented with follicular fluids[J].Reprod Fertil Dev,2001,12(4):133-139
[26]Sehult Z R M.Regulation of zygotic gene activation in the mouse[J].Bioessays,1993,15(8):531-538.
[27]Wang Q,Latham K E.Translation of maternal messenger ribonucleic acids encoding transcription factors during genome activation in early mouse embryos[J].Biol Reprod,2000,62(4):969-978.
[28]侯敏,林嘉鹏,黄俊成.母源基因 Gdf9,Zar1,Mater,Dnmt1 mRNA在绵羊卵母细胞和早期胚胎中的表达[J].中国草食动物,2010,30(2):5-10.

