鸡传染性鼻炎三价灭活疫苗安全性试验和效力检验初报
龚玉梅,张培君*,朱文革,孙惠玲,王宏俊,贺云霞,邵庆红,徐 慧
(1.北京市农林科学院畜牧兽医研究所,北京 100097;.2.北京信得威特科技有限公司,北京 101302)
鸡传染性鼻炎三价灭活疫苗安全性试验和效力检验初报
龚玉梅1,张培君1*,朱文革2,孙惠玲1,王宏俊1,贺云霞1,邵庆红2,徐 慧1
(1.北京市农林科学院畜牧兽医研究所,北京 100097;.2.北京信得威特科技有限公司,北京 101302)
利用Page A、B、C型副鸡禽杆菌,研制鸡传染性鼻炎(IC)三价灭活疫苗。用6批IC疫苗进行了大剂量单次接种和单剂量多次接种的安全性试验,结果表明,IC三价灭活疫苗安全无副作用;用3批疫苗进行SPF鸡和普通鸡的免疫效力试验,结果对A、B、C型副鸡禽杆菌攻毒的保护率≥80%;商品鸡42日龄首免,110日龄二免,二免后约9个月对A、B、C型副鸡禽杆菌攻毒的保护率≥80%;用4℃~8℃保存一年的3批疫苗进行了SPF鸡的近期免疫效力试验,结果对A、B、C型副鸡禽杆菌攻毒的保护率≥80%。
鸡传染性鼻炎;三价灭活疫苗;安全性试验;效力试验
鸡传染性鼻炎(Infectious coryza IC)是由副鸡禽杆菌[(Avibacterium paragallinarum,Apg),以前称副鸡嗜血 杆菌 (Haemophilus paragallinarum,Hpg)]引起的上呼吸道传染病[1-2],主要影响蛋鸡的产蛋(产蛋下降10%~40%)和肉鸡的肉质[2]。本病存在于世界各国,给养鸡业造成较大经济损失。
副鸡禽杆菌有A、B、C 3个血清型。我国于1986年由冯文达分离到A型副鸡禽杆菌[3-8],1995年林毅分离到C型副鸡禽杆菌[9-11],2002年和2005年,张培君和孙惠玲分别分离到B型副鸡禽杆菌[12-14]。以前有报道认为B型副鸡禽杆菌不致病,但张培君和孙惠玲的报道[12-14]表明B型副鸡禽杆菌有较强的致病性。
为有效防控鸡传染性鼻炎,参照鸡传染性鼻炎(A型)油佐剂灭活疫苗[15]、鸡传染性鼻炎(A+C型)-新城疫二联油佐剂灭活疫苗的研究方法和制作工艺[16],研制了9批鸡传染性鼻炎三价(A+B+C)油乳剂灭活疫苗,现将有关批次疫苗的安全性试验、效力检验、保存期试验和免疫持续期试验报道如下。
1 材料与方法
1.1 材料
1.1.1 制苗和攻毒用菌株 A型菌为C-Apg-8(CVCC254株),B型菌为北京株(分离株),C型菌为Apg-668株。这3个菌株均保存在北京市农林科学院畜牧兽医研究所。
1.1.2 培养基 鸡血清鸡肉汤,鸡血清鸡肉汤琼脂,半合成培养基等均参照本实验室以前的配方[15-16],并添加一定含量的还原型辅酶I(NADH)。
1.1.3 试剂 司本-80和吐温-80,为上海申宇医药化工有限公司产品;硬脂酸铝,为上海远航试剂厂产品;白油为杭州炼油厂10号白油。
1.1.4 SPF鸡 购自北京实验动物中心。
1.1.5 父母代商品鸡 购自北京华都集团峪口祖代种鸡场。
1.2 方法
1.2.1 疫苗制备 将上述3个菌株分别接种鸡血清鸡肉汤琼脂平皿,放37℃体积分数为5%的CO2条件下培养16 h~18 h,挑取典型菌落分别接种半合成培养基,培养16 h~48 h,纯检,加入2.5 mL/L的福尔马林灭活,离心集菌,与油乳剂按照1∶1制备成疫苗[15-16],此疫苗约含A型菌6.0×108cfu/mL,B型菌1.0×109cfu/mL,C型菌8.0×108cfu/mL。9批疫苗的批号为 200601、200602和 200603;200701、200702和200703;200801、200802 和 200803。
1.2.2 安全性试验 130只18日龄SPF鸡,饲养在北京信得威特科技有限公司的SPF鸡隔离器内,观察3 d,将鸡随机分成13组,每组10只,第1组至第6组为大剂量注射组,分别注射200601、200602和200603;200701、200702和200703六批疫苗,每只鸡胸部肌肉注射疫苗2.0 mL,注射后观察14 d。第7至第12组为单剂量多次注射组,分别注射上述6批疫苗,每只鸡胸部肌肉注射0.5 mL,3 d后进行第2次注射,再3 d后进行第3次注射,于第3次注射后再观察14 d。主要观察接种鸡的精神状态、饮水和采食等情况。第13组为非接种对照组,其观察时间与第7至第12组相同。
1.2.3 SPF鸡近期效力试验
1.2.3.1 免疫 120只28日龄SPF鸡,饲养在北京市农林科学院畜牧兽医研究所SPF隔离器内,观察14 d,至42日龄时随机分成4组,每组30只鸡,试验组用在 4℃~8℃保存 3个月的三批疫苗200801、200802和200803免疫接种,每只鸡分别胸部肌肉注射0.5 mL疫苗,第4组为非免疫对照组。
1.2.3.2 攻毒 免疫30 d后,试验组和对照组各取10只鸡分别攻击A、B、C型副鸡禽杆菌,每只鸡的攻毒剂量为A型5.0×105cfu/0.2 mL,B型2.0×105cfu/0.2 mL,C型5.0×105cfu/0.2 mL,攻毒部位为眶下窦内注射。攻毒后观察7 d[15-17]。
1.2.4 普通鸡二免持续期试验
1.2.4.1 首次免疫 200只1日龄海兰褐父母代雏鸡,购自无鸡传染性鼻炎病史的祖代鸡场,饲养在北京市农林科学院畜牧兽医研究所的实验动物舍,14日龄免疫接种法氏囊活疫苗,21日龄免疫接种新城疫活疫苗,28日龄第2次免疫接种法氏囊活疫苗,42日龄时随机分成4组,每组50只鸡,第1~3组为免疫组,分别用4℃~8℃保存4个月的3批疫苗(200801、200802和200803)进行首次免疫接种,每只鸡胸部肌肉注射接种0.5 mL疫苗。第4组为非免疫对照组。所有200只鸡同时被接种鸡新城疫和禽流感(H9亚型)二联灭活疫苗0.5 mL(本所姜北宇研究员馈赠)。
1.2.4.2 二免 首免后76 d(118日龄)[15-16],用上述4℃~8℃保存200 d的3批疫苗对第1~3组鸡进行第2次免疫,每只鸡胸部肌肉接种0.5 mL疫苗。所有200只鸡同时第二次接种鸡新城疫和禽流感(H9亚型)二联灭活疫苗0.5 mL。
1.2.4.3 攻毒 第二次免疫接种后35 d和200 d,3个试验组和对照组各取15只鸡分别攻击A、B、C型副鸡禽杆菌,余下的鸡只(养殖过程中,有几只鸡因产蛋难憋死)于第2次免疫后270 d,分别攻击A、B、C型副鸡禽杆菌。攻毒剂量均为每只鸡A型5.0×105cfu/0.2 mL,B型 2.0×105cfu/0.2 mL,C型5.0×105cfu/0.2 mL。3次攻毒剂量相同,攻毒部位为眶下窦内注射。攻毒后观察7 d[15-17]。
1.2.5 保存期试验 120只42日龄SPF鸡,随机分成4组,第1~3组用4℃~8℃保存1年的3批三价疫苗(200801,200802和200803)免疫接种,每只鸡胸部肌肉内接种0.5 mL疫苗,免疫接种后30 d,所有120只鸡分别攻击A、B、C型副鸡禽杆菌。攻毒剂量为每只鸡A型5.0×105cfu/0.2 mL,B型2.0×105cfu/0.2 mL,C型5.0×105cfu/0.2 mL。攻毒部位为眶下窦内注射,攻毒后观察7 d[15-17]。
2 结果
2.1 安全性试验
在试验结束时,所有130只鸡均健康存活。除大剂量接种组(第1~6组)在接种的当天有部分鸡只采食减少外无其他不良反应;大剂量接种组第4~6组部分鸡只在试验结束时疫苗没有被完全吸收。单剂量多次接种组(第7~12组)没有任何不良反应(表1,表2)。
2.2 SPF鸡近期效力试验
攻毒后的第 2日,A型和B型对照组鸡只均10/10发病,表现为眶下窦肿胀明显,流鼻液,免疫组均10/10保护;C型对照组8/10发病,症状比A型和B型对照组轻,免疫接种组为10/10、10/10和9/10保护。攻毒后的第2日和第3日,A型和B型对照组有部分鸡只呈一过性失明。C型对照组为9/10发病。免疫组有1只~2只鸡只发病。观察至第7日,详细结果见表3。
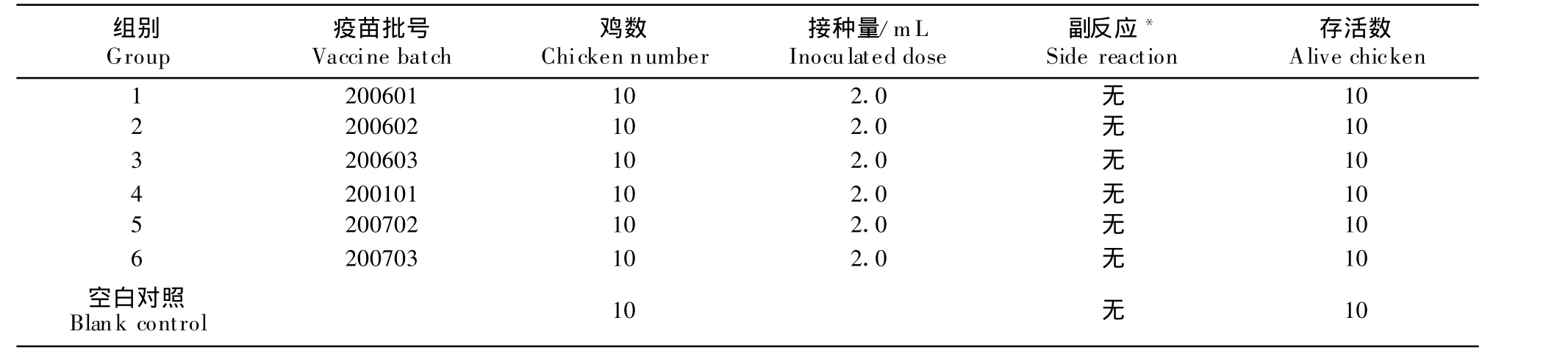
表1 大剂量接种组Table 1 High dose inoculated groups
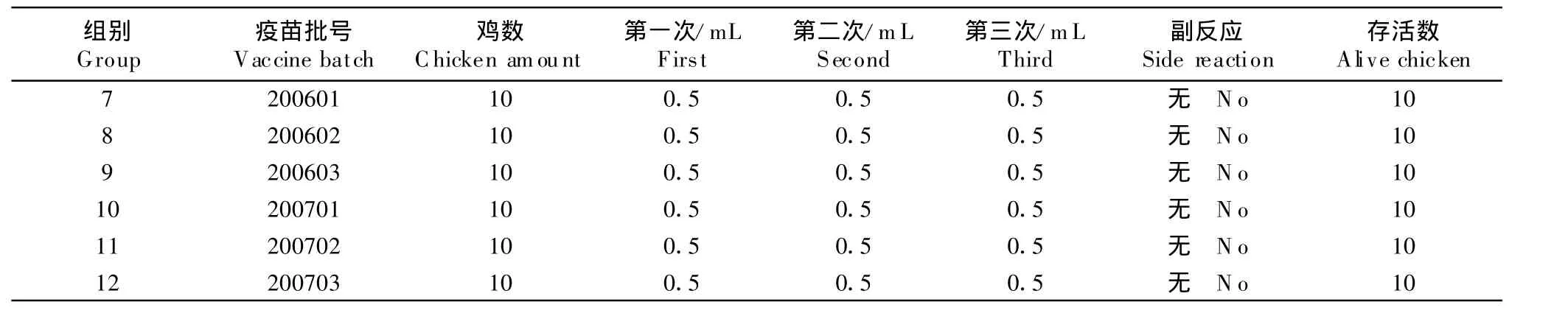
表2 单剂量多次接种组Table 2 T he groups inoculated with sing le dose for 3 times
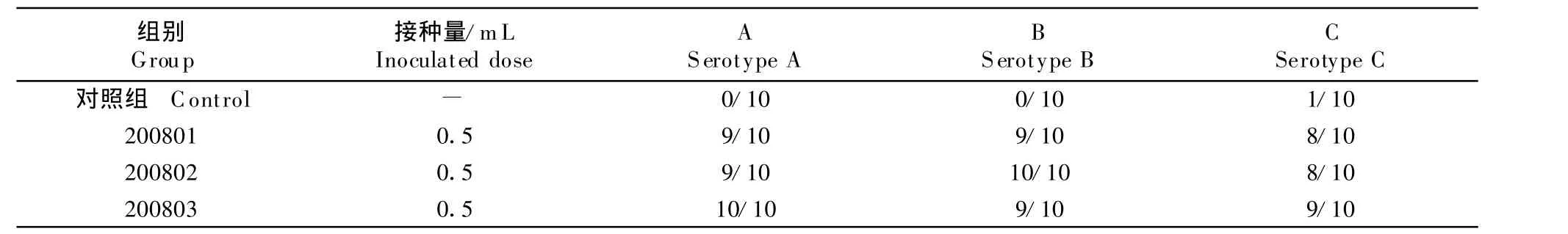
表3 IC三价灭活疫苗SPF鸡近期效力试验Table 3 T he potence test of vaccine in SPF chicken
2.3 普通鸡二免持续期试验
2.3.1 普通鸡二免后35 d攻毒结果 二免后35 d,每组取15只鸡分别用A、B、C型Apg进行攻毒,攻毒后观察7 d。在攻毒24 h后,所有15只对照鸡均呈现明显的鸡传染性鼻炎临床症状(眶下窦和面部肿胀,鼻道分泌物为黏液性,鼻液多),不食、饮水量比免疫鸡明显减少。攻毒后48 h和72 h,所有非免疫对照鸡只的临床症状与攻毒后24 h相同。整个观察期间,3个免疫组的鸡只对A型为15/15(100%)保护,而对B型和C型菌株的攻击,每组均有1只鸡发病,其症状比非免疫对照组明显为轻(表4)。
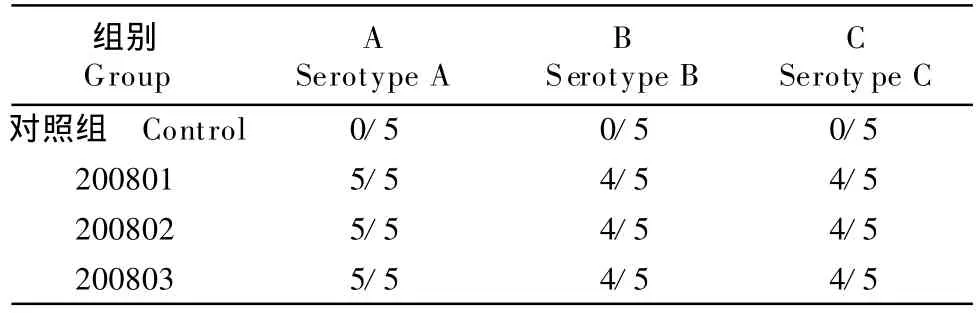
表4 普通鸡二免后35 d攻毒结果Table 4 Challenge test 35 days after second immunization in chickens
2.3.2 普通鸡二免后200 d和270 d攻毒结果 二免后200 d,每组取15只鸡分别用A 、B、C型Apg进行攻毒,攻毒后观察7 d;二免后270 d,每组余下的鸡只分别用A、B、C型Apg进行攻毒,攻毒后亦观察7天。结果表明,普通鸡只在42日龄接种IC三价灭活疫苗0.5 mL,110日龄再次接种IC三价灭活疫苗0.5 mL,二免后 200 d和270 d,对A 、B、C 型Apg均能够获得良好保护(表5,表6)。

表5 普通鸡二免后200 d攻毒结果Table 5 Challenge test 200 days after second immunization in chickens
2.4 三价灭活疫苗的保存期试验
用4℃~8℃保存1年的3批IC三价灭活疫苗免疫接种42日龄SPF鸡只,免疫接种后30 d,所有鸡只分别用A、B、C型Apg进行攻毒,攻毒剂量和部位同前述。攻毒后观察7 d(表7)。结果表明,IC三价灭活疫苗在4℃~8℃保存1年后免疫接种鸡只,其免疫效力不变。
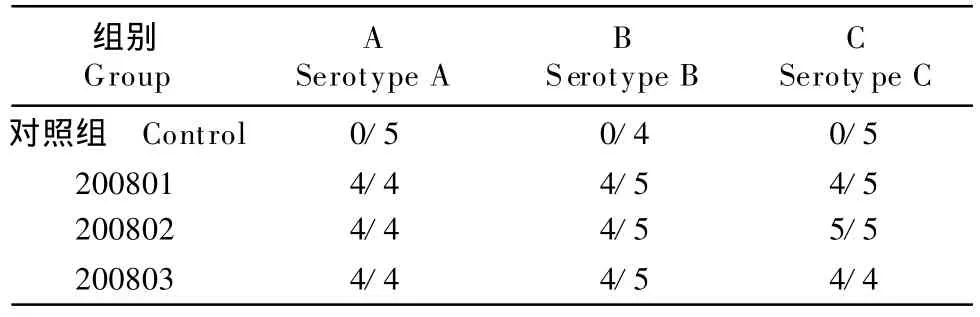
表6 普通鸡二免后270 d攻毒结果Table 6 Challenge test 270 days after second immunization in chickens

表7 疫苗保存期试验Table 7 The storage period test of the vaccines
3 讨论
疫苗的安全性和有效性是评价疫苗的两个重要指标,本试验按照农业部有关新制品的研制要求进行了安全性试验,3批疫苗(200601,200602,200603)在实验室制备,3批疫苗(200701,200702,200703)在符合GMP标准的车间制备,此6批疫苗无论是大剂量接种还是单剂量多次接种,对鸡只没有副反应,表明鸡传染性鼻炎三价油乳剂灭活疫苗安全性良好。第4~6组部分鸡只在试验结束时疫苗没有被完全吸收,可能与疫苗的黏度较大吸收缓慢有关。
鉴于副鸡禽杆菌的生物学特性和鸡只的个体差异,不能保证每一次试验非免疫鸡只人工感染后100%发病(表3和表7攻击C型的对照鸡就有1/10和2/10的鸡没有发病),也不能保证每一次试验免疫鸡只人工感染后100%获得保护(我们所获得的B型和C型菌株有限,现有菌株的免疫原性很难达到非常理想状态)。为科学地评价IC灭活疫苗的免疫效力,在A、B、C型副鸡禽杆菌对SPF鸡只致病力试验的基础上(有关论文将另外发表),结合有关IC疫苗的数据[15-17],我们拟订了IC灭活疫苗的效检标准,42日龄以上鸡只免疫1个月后攻毒,攻毒剂量为A型5.0×105cfu/0.2 mL,B型2.0×105cfu/0.2 mL,C型5.0×105cfu/0.2 mL,攻毒部位为眶下窦内注射,攻毒后观察7 d~14 d[9],非免疫对照鸡只发病率≥4/5(8/10)、免疫鸡只发病率≤1/5(2/10),疫苗判为合格。
依据上述判定标准,200801、200802和200803三批疫苗对SPF鸡只的近期免疫效力,普通鸡只二免后35、200、270 d的攻毒结果,免疫鸡攻击 A型仅有3只鸡发病,总保护率达到99/102(97%),进一步证明A型菌株C-Apg-8(CVCC254株)免疫原性良好,免疫鸡对B型和C型菌株的攻毒保护率也均达到≥8/10或≥4/5,表明疫苗免疫效果良好。
保存期试验结果表明,IC三价灭活疫苗在4℃~8℃保存1年,其免疫原性不受影响。
IC三价灭活疫苗的安全性和免疫原性有待于田间进一步验证。
初步试验结果表明,我们研制的IC三价灭活疫苗安全性和免疫原性良好。
[1]Blackall P J,Christensen H,Beckenham T,et al.Reclassification ofPasteurellagallinarum[Haemophilus]paragallinarum,Pasteurella aviumandPasteurella volantiumasAvibacteriumgallinarumgen.nov., comb.nov.,Avibacteriumparagallinarumcomb.nov.,Avibacterium aviumcomb.nov.andAvibacterium volantiumcomb.nov[J].Int J Syst Evol Microbiol,2005,55:353-362.
[2]卡尔尼克B W K.禽病学[M].10版.高 福,苏敬良,译.北京:中国农业出版社,1999:218-227.
[3]冯文达.北京鸡传染性鼻炎病原菌的分离鉴定[J].微生物学通报,1987(5):216-219.
[4]Chen X,Zhang P,Blackall P J,et al.Characterization ofHaemophilus paragallinarumisolates from China[J].Avian Dis,1993,37:574-576.
[5]Chen X,Miflin J K,Zhang P,et al.Development and application of DNA probes and PCR tests forHaemophilus paragallinarum[J].Avian Dis,1996,40:398-407.
[6]Chen X,Chen Q,Zhang P,et al.Evaluation of a PCR test for the detection ofHaemophilus paragallinarumin China[J].A-vian Pathol,1996,27:296-300.
[7]Zhang P,Blackall P J,Yamaguchi T.et al.A monoclonal antibody blocking ELISA for the detection of serovar-specific antibodies toHaemophilus paragallinarum[J].Avian Dis,1999,43:75-82.
[8]Miao D,Zhang P,Gong Y,et al.T he development and application of a blocking ELISA kit fo r the diag nosis of infectious coryza[J].Avian Pathol,2000,29:217-223.
[9]林 毅,张道永,王文贵,等.鸡传染性鼻炎的病原分离鉴定及防制[J].中国兽医科技,1995,25(1):20-21.
[10]张培君,苗得园,龚玉梅,等.鸡传染性鼻炎流行病学调查Ⅰ[J].中国兽药杂志,1998,32(4):28-32.
[11]张培君,苗得园,龚玉梅,等.鸡传染性鼻炎流行病学调查Ⅱ[J].中国兽药杂志,2001,35(1):21-23.
[12]Zhang P J,Miao D,Sun H,et al.Infectious coryza due toHaemophilus paragallinarumserovar B in China[J].Aust Vet J,2003,81:96-97.
[13]张培君,苗得园,龚玉梅,等.B型副鸡嗜血杆菌的分离鉴定[J].中国预防兽医学报,2003,25(1):56-58.
[14]孙惠玲,苗得园,王艳平,等.B型副鸡嗜血杆菌北京株的分离与鉴定[J].中国兽医杂志,2005,41(2):28-29
[15]冯文达,陈小玲,张培君.鸡传染性鼻炎灭活疫苗的研究[J].中国兽医杂志,1998,14(8):53-55.
[16]张培君,龚玉梅,樊玉珍,等.鸡传染性鼻炎和新城疫二联油佐剂灭活疫苗的研究[J].中国兽药杂志,1996,30(3):9-12.
[17]中国兽药典委员会.中国兽药典[M].3部.北京:中国农业出版社,2005:64.
Safety and Efficacy Study on Trivalencs Inactivated Vaccines Against Infectious Coryza
GONG Yu-mei1,ZHANG Pei-jun1,ZHU Wen-ge2,SUN Hui-ling1,WANG Hong-jun1,HE Yun-xia1,SHAO Qing-hong2,XU Hui1
(1.Institute of Animal Husbandry and Veterinary Science,Beijing Academy of Agricultural and Forestry Science,Beijing,100097,China;2.Beijing Sinder Vet-Technology CO.,L TD.Shunyi,Beijing,101302,China)
Using Page's serovar A,B and C ofAvibacterium paragallinarum,trivalent inactived oil-emulsion vaccine against infectious coryza was prepared.Six batches of vaccines used for safety test.2.0 mL/chicken was injected at a time and 0.5mL/chicken at a time for three times.Any side effects were not found.The results showed the vaccines were safeThe vaccine efficacy experment with three batches of vaccines in SPF chicken,30 days after immunization,the chickens were challenged with Page's serovar A,B and C ofAvibacterium paragallinarum.The protection rate≥80%in immunized chickens.The commodity chicken were immunized at 42 days old and 110 days old.Nine months after second immunization,the chickens were challenged,the protection rate≥80%in immunized chickens.The SPF chickens were immunized with three batch of vaccines which were stored at 4-8℃for 12 months,30 days after immunization,the chickens were challenged with Page's serovar A,B and C ofAvibacterium paragallinarum,The protection rate≥80%in immunized chickens.
Infectious coryza;trivalence inactived vaccine;safety test;potency test
S852.613
A
1007-5038(2010)03-0039-05
2009-09-14
北京市科委产业化重点项目(Z07010501780701)
龚玉梅(1961-),女,湖南华容人,高级兽医师,主要从事动物疫病诊断与预防工作。*通讯作者

