PRRSV云南A06株ORF5和ORF7基因的克隆与序列分析*
曾少灵,林庆燕,花群义,张彩虹,阮周曦,杨俊兴,孙 洁,秦智锋,曹琛福,陈 兵,吕建强
(深圳出入境检验检疫局动植中心,广东深圳 518010)
PRRSV云南A06株ORF5和ORF7基因的克隆与序列分析*
曾少灵,林庆燕,花群义*,张彩虹,阮周曦,杨俊兴,孙 洁,秦智锋,曹琛福,陈 兵,吕建强
(深圳出入境检验检疫局动植中心,广东深圳 518010)
设计2对引物分别扩增PRRSV的ORF5和ORF7基因,对从云南某猪场分离到的毒株A06进行RT-PCR检测,得到2条特异性扩增带,克隆至pMD18-T载体并测序。将A06株的ORF5和ORF7基因及其推断氨基酸序列分别与PRRSV欧洲型代表株LV、美洲型代表株VR 2332和7株中国分离的美洲型毒株相应基因进行核苷酸和氨基酸序列比对分析。结果显示,A06株属于美洲型,其ORF5和ORF7基因及推断氨基酸与我国2006年分离的4株HP-PRRSV代表株的相似性高达98%~99%,与欧洲型代表株LV的相似性只有56%~64%。分别构建了以上毒株ORF5和ORF7基因的亲缘关系图谱,反映了A06株ORF5和ORF7基因的进化位置,完成2个基因的遗传变异分析。
PRRSV;ORF5基因;ORF7基因;亲缘关系图谱
猪繁殖与呼吸综合征病毒(Porcine reproductive and respiratory syndrome virus,PRRSV)引起猪繁殖与呼吸综合征(PRRS),俗称猪蓝耳病。目前,世界上流行的PRRSV基因型主要有以LV株为代表的欧洲型和以VR2332株为代表的美洲型。过去,PRRS在我国各省市均有不同程度的发生,2006年我国部分地区还暴发了高致病性猪蓝耳病,给我国养猪业造成了巨大的经济损失[1-2]。
PRRSV是单股正链 RNA病毒,基因组长约15 kb,含有ORF1a、ORF1b和ORF2~7共 8个开放阅读框[3-5]。其中,ORF5基因全长603 bp,编码糖基化囊膜蛋白GP5,诱导机体产生特异性中和抗体,因此很多PRRS新型疫苗均以GP5为靶抗原进行研制[4]。ORF7基因全长372 bp,编码核衣壳蛋白N,是病猪最先产生的抗体,抗体存在持续半年,因此无论在感染早期还是晚期都可作为PRRSV抗体的检测抗原,具有重要的诊断学意义[3-5]。
本文从某猪场病料中分离的PRRSV毒株A06中扩增得到2个特异性片段,克隆至pMD18-T载体,经测序,表明分别源自 PRRSV的 ORF5和ORF7基因。基因序列和推断氨基酸序列分析表明,A06株属于美洲型PRRSV,同时构建了这2个基因的亲缘关系图谱 ,反映了A 06株ORF 5和ORF7基因的进化位置。而研究某地流行毒株的基因变异情况,才能有效地选择适合当地的毒株制备疫苗和施行有效的免疫程序,对于有效预防和控制当地PRRSV的发生和传播,具有重大意义。
1 材料与方法
1.1 材料
1.1.1 毒(菌)株与质粒 深圳出入境检验检疫局动物中心实验室从云南某猪场猪病料中分离到的PRRSV毒株A06,为本室保存。质粒pMD18-T为宝生物工程(大连)有限公司产品,大肠埃希菌转化受体菌JM101为本室保存。
1.1.2 试剂 病毒RNA/DNA快速纯化试剂盒、一步法反转录PCR试剂盒、DNA凝胶回收试剂盒、pMD18-T克隆载体连接试剂盒、质粒DNA小量纯化试剂盒和DNA标准等生化试剂均为宝生物工程(大连)有限公司产品。引物由上海英骏生物技术有限公司负责合成。DNA测序由宝生物工程(大连)有限公司完成。
1.2 方法
1.2.1 引物设计 在GenBank上搜集并下载PRRSV多个毒株的ORF5和ORF7基因序列,经分析比较,选择两个基因相对保守的首尾序列及其邻近序列,利用软件DNA Star中的Primer Select设计引物。
1.2.2 目的基因片段的扩增与回收 使用病毒RNA/DNA快速纯化试剂盒提取病毒RNA。使用一步法反转录PCR试剂盒和自行设计的引物进行RT-PCR扩增,以15 g/L琼脂糖凝胶电泳对扩增产物进行检测。使用DNA凝胶回收试剂盒回收目的扩增片段。
1.2.3 基因的克隆与测序 将回收的目的扩增片段连接到pMD18-T载体上,按《分子克隆实验指南》完成转化与重组菌筛选培养等步骤[6]。使用质粒DNA小量纯化试剂盒提取重组质粒,并送宝生物工程(大连)有限公司进行序列测定。
1.2.4 基因序列与推断氨基酸序列分析 测序结果在NCBI网站上进行Blaster分析,由基因序列得到的推断氨基酸序列在 Expasy网站上利用Prot-Param工具进行基本理化性质分析[7-8]。
1.2.5 基因亲缘关系图谱的构建 在GenBank上收集PRRSV有关代表株与这些代表株的ORF5和ORF7基因序列和推断氨基酸序列,利用DNA Star中Meglign软件排列比对,选择Clustal V Method进行计算,分别构建ORF5和ORF7基因的亲缘关系图谱[7-8]。
2 结果
2.1 扩增全长ORF5基因和ORF7基因的引物
本文设计了一对引物 PRRSV-GP5-F和PRRSV-GP5-R扩增ORF5基因的完整读码框,序列为 5′-ATGT TGGGGAAGTGCTTGACCGC-3′和5′-CTAGAGACGACCCCAT TGTTC-3′。 另 一 对引物PRRSV-N-F和PRRSV-N-R扩增ORF7基因的完整读码框,序列为 5′-ATGCCAAATAACAACGGCAAGCAGC-3′ 和 5′-TCATGCTGAGGGTGATGCTGGGG-3′。
2.2 目的基因的扩增
以引物对 PRRSV-GP5-F和 PRRSV-GP5-R、PRRSV-N-F和 PRRSV-N-R分别对毒株 A06的RNA进行RT-PCR检测,以15 g/L琼脂糖凝胶电泳检测PCR产物,可见2条与预期大小一致的特异性条带(图1)。

图1 PRRSV A06株ORF5基因和ORF7基因的RT-PCR扩增结果Fig.1 Results of RT-PCR amplification of ORF5 gene and O RF7 gene from PRRSV isolate A06
2.3 重组质粒的测序结果与序列分析
回收上述阳性扩增片段,分别连接到pMD18-T载体上,得到重组质粒PRRSV-A06-GP5-pMD18T和PRRSV-A06-N-pMD18T,送宝生物工程(大连)有限公司进行序列测定,结果如图2(A,B)。表明克隆到pMD18-T载体上的基因大小分别为603 bp和372 bp,经NCBI的Blaster分析确定,2个基因均源自 PRRSV,分别与已报道的 PRRSV ORF5和ORF7基因有很高的同源性。
根据测序结果推断A06株ORF5和ORF7基因的氨基酸序列,在Expasy网站上利用Prot Param工具对推断氨基酸进行基本理化性质分析。结果表明,A06的GP5和N蛋白应具有良好稳定性,GP5蛋白亲水性良好,具备充当跨膜蛋白的条件,而N蛋白基本没有亲水性,预计不具有跨膜功能。

图2 PRRSV毒株A06 ORF5基因(A)和ORF7基因(B)的测序结果Fig.2 Sequencing result of ORF5 gene(A)and ORF7 gene(B)from PRRSV isolate A06
2.4 ORF5和ORF7基因与推断氨基酸序列比对与相似性分析结果
在EBI网站上完成PRRSV A06株与其他9个PRRSV毒株之间的ORF5和ORF7核苷酸序列与推断氨基酸序列的相似性比较,相似比例的结果见表1。在A06株的ORF5和ORF7基因及推断氨基酸与我国2006年分离到的4株HP-PRRSV代表株的ORF5和ORF7基因的相似性高达98%~99%,与疫苗株pMLV、经典中国代表株的相似性达87%~95%,与美洲型代表株VR-2332的相似性达89%~95%,而与欧洲型代表株 LV的相似性只有56%~64%,表明A06株属于美洲型,且与中国本土PRRSV毒株相比更接近于2006年中国高致病性PRRSV毒株系列。

表1 PRRSV A06株与其他9个毒株之间的ORF5和ORF7核苷酸序列及氨基酸序列相似性比较Table 1 Similarity comparisons of the sequences of nucleotide and deduced amino acids of ORF5 and ORF7 genes from PRRSV isolate A06 with the other 9 P RRSV isolates
PRRSV A06株与其他9个PRRSV毒株之间的ORF5核苷酸和推断氨基酸序列的排列比对结果显示,10株PRRSV的ORF5基因在第70位~82位、111位~117位、171位 ~175位、442位 ~447位、550位~556位及593位~600位核苷酸序列有明显差异,但氨基酸变异则主要集中在N端信号肽序列及临近高变区(第3位~40位氨基酸)。
PRRSV A06株与其他9个PRRSV毒株之间的ORF7核苷酸和推断氨基酸序列的排列比对结果显示,欧洲型代表株LV缺失第90位~97位和104位~106位碱基,其他9株PRRSV的ORF7缺失第26位~34位、135位~136位以及末尾序列的多个碱基。此外,10株PRRSV的ORF7在第116位~120位、216位~220位、268位~ 271位、280位~285位、302位~306位及323位~329位核苷酸序列有明显差异,但没有导致10个毒株ORF7氨基酸组成的重大差异,仅是LV株缺失第37位~39位氨基酸,其他9株缺失第13位~16位氨基酸,说明不同来源株的ORF7氨基酸组成相对保守,与PRRSV中ORF7编码的N蛋白的有关报道一致。
2.5 A06株ORF5和ORF7基因亲缘关系图谱的构建
利用DNAStar中Meglign软件排列比对10个PRRSV毒株的 ORF5和 ORF7基因序列,选择Clustal V Method进行计算,分别构建了ORF5和ORF7基因的亲缘关系图谱,如图3和图4。图谱表明,欧洲型代表株LV与其他毒株的距离都很远,为单独一群。A06株与美洲型代表株VR 2332关系较近,属于美洲型。国内美洲型分离株明显分为两个亚群,第一亚群以2006年HP-PRRSV为主,第二亚群以早年分离到的中国经典代表株和疫苗株为主。A06株ORF5、ORF7基因与2006年在我国暴发的高致病性 PRRSV 系列株 HEB1、HUB2、HUN4、JXA1关系密切,属同一个亚群,而与中国经典代表株CH-1a和BJ-4、中国疫苗株pMLV分属于国内美洲型分离株的两个亚群。
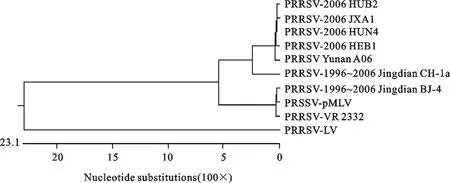
图3 10株PRRSV分离株ORF5基因系统发生树Fig.3 Phylogenetic tree based on nucleotide sequences of ORF5 gene from 10 P RRSV isolates
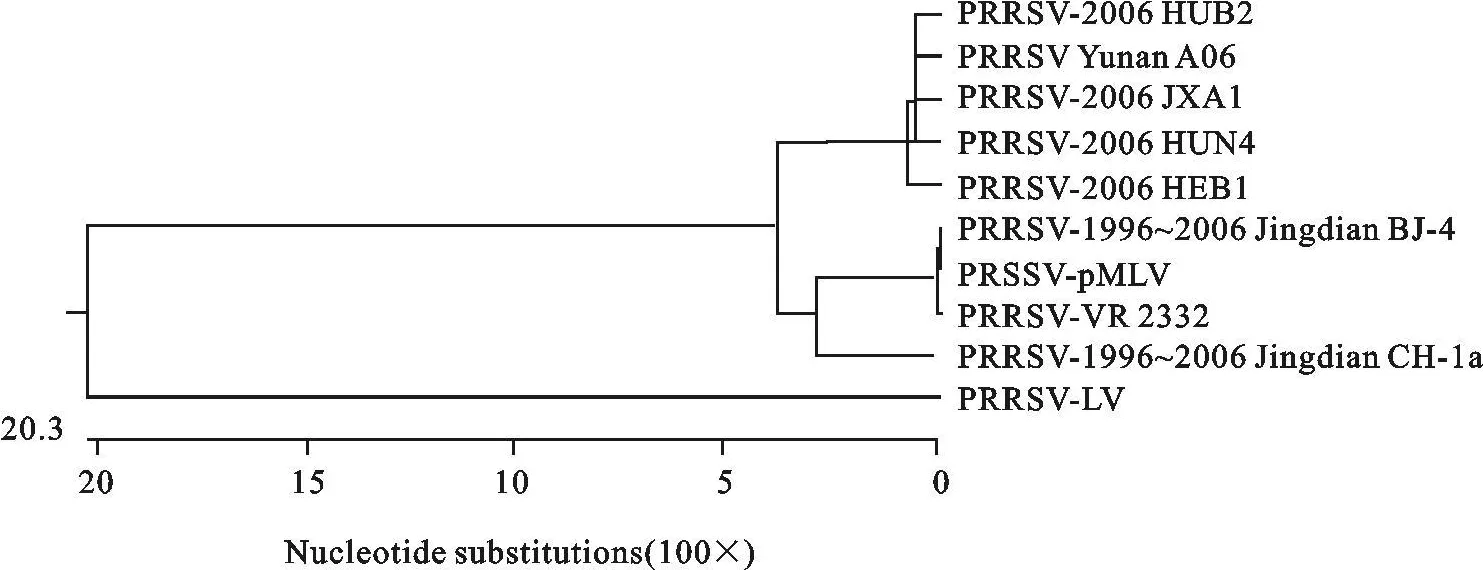
图4 10株PRRSV分离株ORF7基因系统发生树Fig.4 Phylogenetic tree based on nucleotide sequences of ORF7 gene from 10 P RRSV isolates
3 讨论
自从猪繁殖与呼吸综合征在20世纪80年代末发生以来,该病相继在各国呈流行性感染,已成为危害世界养猪业的主要疫病之一,造成了严重的经济损失[4-5,8]。尽管多个国家已采用定期监测、注射疫苗等形式加强预防,但是该病仍陆续暴发,甚至出现了更多的高毒株系,而造成该病难以防控的其中一个重要原因是PRRSV 的变异[9-10]。据报道,PRRSV可通过碱基突变、缺失[8]和基因重组[11]等方式发生变异,产生适应性更好、毒性更高的新毒株[12]。
而在PRRSV中,ORF5基因最容易发生变异[8]。由其编码的GP5蛋白是PRRSV所有结构蛋白中具有较强抗原性的蛋白,不仅可诱导产生与病毒的中和反应呈显著相关的中和抗体,还在引起特异性细胞免疫、阻止肺泡巨噬细胞损伤和诱导细胞凋亡等多个方面发挥着重要作用[12]。因此,ORF5基因的变异,引起其编码的GP5蛋白的变化,带来抗原性的改变,最终导致 PRRSV相关特性的改变[8]。这可能是免疫猪群不能抵抗变异毒株攻击而发病的原因之一[8]。与ORF5相比,ORF7基因相对保守,其编码的N蛋白是PRRSV结构蛋白中含量最高的蛋白,也是免疫原性最强的蛋白,是体液免疫应答的主要抗原,成为目前PRRSV血清学诊断方法的抗原基础,也是PRRSV抗原分型和基因分型的主要依据[3-5]。
本试验从PRRSV毒株A06中克隆到ORF5和ORF7基因,根据基因序列,推导了A06株ORF5和ORF7基因编码的GP5和N蛋白的氨基酸序列,与PRRSV欧洲型代表株LV、美洲型代表株VR 2332和多个中国代表株进行了核苷酸和氨基酸序列比对分析、蛋白特性分析和功能预测,完成了A06株ORF5和ORF7基因与上述毒株相应基因的亲缘关系图谱分析,确定了A06株ORF5和ORF7基因进化的相对位置,为我国PRRSV毒株资料信息库补充了新的材料。
不同毒株的PRRSV具有不同的抗原性,这不仅表现在欧洲株和美洲株之间,即使是美洲株之间也存在差异[7-8]。因此,及时收集、分析和研究当地流行毒株的基因变异情况,选择与当地流行毒株在抗原性上相关的种毒进行疫苗制备,施行因时因地制宜的疫苗免疫接种程序,对于有效预防和控制当地PRRSV的发生和传播,具有重要意义。
[1]Tian K,Yu X,Zhao T,et al.Emergence of fatal PRRSV variants:unparalleled outbreaks of a typical PRRS in China and molecular dissection of the unique hallmark[J].PLoS ONE,2007,2(6):526.
[2]Li Y F,Wang X L,Bo K T,et al.Emergence of a highly pathogenic porcine reproductive and respiratory syndrome virus in the Mid-Eastern region of China[J].Vet J,2007,174(3):577-584.
[3]袁 宝,任文陟.猪繁殖与呼吸综合征病毒分子生物学研究进展[J].吉林畜牧兽医,2006(1):15-17.
[4]李彩珠.猪繁殖与呼吸综合征病毒分子生物学研究进展[J].动物医学进展,2008,29(8):79-83.
[5]刘 霞,沈国顺.猪繁殖与呼吸综合征病毒分子生物学研究进展[J].现代畜牧兽医,2006(11):54-57.
[6]萨姆布鲁克 J,拉塞尔 D W.分子克隆实验指南[M].3版.黄培堂,等,译.北京:科学出版社,2002.
[7]安同庆,田志军,肖 燕,等.高致病性猪繁殖与呼吸综合征病毒变异株主要囊膜糖蛋白GP5的遗传变异分析[J].中国预防兽医学报,2008,30(11):851-855.
[8]刘美容.猪繁殖与呼吸综合征病毒ORF5基因变异分析[J].上海畜牧兽医通讯,2008(3):26-27.
[9]M eng X J.Heterogeneity of porcine reproductive and respiratory syndrome virus:implications for current vaccine efficacy and future vaccine development[J].Vet Microbiol,2000,74(4):309-329.
[10]Stadejek T,Stankevicius A,Storgaard T,et al.Identification of radically different variants of porcine reproductive and respiratory syndrome virus in Eastern Europe:towards a common ancestor for European and American viruses[J].J Gen Virol,2002,83:1861-1873.
[11]Indik S,Valicek L,Klein D,et al.Variations in the major envelope glycoprotein GP5 of Czech strains of porcine reproductive and respiratory syndrome virus[J].J Gen Virol,2000,81:2497-2502.
[12]刘 芳,汪铭书,程安春.猪繁殖与呼吸综合征病毒诱导细胞凋亡的研究进展[J].黑龙江畜牧兽医,2005(10):82-83.
Cloning and Sequence Analysis of ORF5 and ORF7 Genes from PRRSV Isolate A06
ZENG Shao-ling,LIN Qing-yan,HUA Qun-yi,ZHANG Cai-hong,RUAN Zhou-xi,YANG Jun-xing,SUN Jie,QIN Zhi-feng,CAO Chen-fu,CHEN Bing,L¨U Jian-qiang
(Animals and Plants Inspection and Quarantine Institute,Shenzhen Entry-Exit Inspection&Quarantine Bureau,Shenzhen,Guangdong,518010,China)
Two pairs of primers were designed to amplify the complete ORF5 and ORF7 genes from PRRSV isolate A06 by RT-PCR.The ORF5 and ORF7 genes from isolate A06 were cloned to pMD18-T vector and sequenced,respectively.Comparison of the nucleotide sequence and the deduced amino acid sequence of ORF5 and ORF7 genes from isolate A06 with isolate LV,VR 2332,and 7 isolates from China indicated that isolate A06 was clustered within American genotype.The ORF5 and ORF7 genes and their deduced amino acid of isolate A06 showed high homology of 98%-99%to 4 strains of HP-PRRSV which were isolated homeland in 2006,but genetically distinct from isolate LV with a low homology of 56%-64%.The phylogenetic trees of ORF5 and ORF7 genes were set up to show the evolution situation of isolate A06 among the isolates in this study.
PRRSV;ORF5 gene;ORF7 gene;phylogenetic tree
S852.659.6;Q785
A
1007-5038(2010)03-0012-06
2009-08-21
国家质检总局科技项目(2008IK262-2);深圳出入境检验检疫局科技项目(SZ2007038)
曾少灵(1977-),女,广东人,硕士研究生,主要从事病毒分子生物学研究。*通讯作者

