单一引物标记LUX荧光RT-PCR鉴别BTV和EHDV *
张彩虹,花群义*,阮周曦,杨俊兴,曾少灵,陶 虹,陈 兵,曹琛福,林庆燕,周晓黎
(1.深圳出入境检验检疫局,广东深圳 518010;2.云南出入境检验检疫局,云南昆明 650228)
单一引物标记LUX荧光RT-PCR鉴别BTV和EHDV*
张彩虹1,花群义1*,阮周曦1,杨俊兴1,曾少灵1,陶 虹1,陈 兵1,曹琛福1,林庆燕1,周晓黎2
(1.深圳出入境检验检疫局,广东深圳 518010;2.云南出入境检验检疫局,云南昆明 650228)
采用在线LUXTM专业软件,根据BTV-NS3基因序列和EHDV-NS3基因序列,通过特异性单一引物序列3′末端的荧光标记,分别设计出两对BTV和EHDV的LUX荧光PCR引物,并采用BLAST软件对各引物进行匹配性和特异性分析,根据分析结果选择合适的引物合成。经过各反应条件的优化和特异性 、敏感性试验,并对 BTV 、EHDV 、VSV、PPRV 、BVDV 、AKV 的BHK-21细胞培养物和临床样品检测,与常规RT-PCR进行对比检测,建立了能同时鉴别检测BTV和EHDV的二重LUXTM荧光PCR方法。该二重LUXTM荧光PCR的BTV和EHDV各自引物只对相应的病毒呈阳性反应,两者没有交叉反应现象,对健康牛、羊和猪基因组DNA、BKH-21细胞对照,以及其他几种相似疾病如VSV、PPRV、BVDV、AKV均呈阴性反应。该法对病毒的细胞培养液鉴别检测敏感性可达1TCID50C以上,比常规RT-PCR敏感性提高10倍以上,从样品核酸纯化到完成二重LUXTM荧光PCR反应和熔解曲线分析,仅需3 h,在进出口动物检验检疫中快速鉴别BTV和EHDV具有实际应用价值。
LUX荧光RT-PCR;蓝舌病病毒;流行性出血病病毒
蓝舌病(Blue tongue)和鹿流行性出血病(Epizootic hemorrhagic disease of deer,EHD)是由库蠓传播的牛、绵羊等反刍动物的2种重要动物虫媒传染病[1-2],是动物防疫和出入境检疫的重要疫病。BTV和EHDV同属呼肠病毒科环状病毒属的成员,这两种病毒的结构相似,其基因组由分为10个片段(L1-L3、M4-M6、S7-S10)的双股 RNA 组成 ,可编码11种病毒蛋白,其中7种为结构蛋白(VP1-VP7),4种为非结构蛋白(NS1、NS2、NS3a和NS3b)。两种病毒颗粒的外壳均由VP2和VP5两种主要蛋白构成,核芯衣壳均由VP3、VP7两种主要蛋白和VP1、VP4、VP6三种次要蛋白构成,其中VP2是型特异性抗原,可诱导产生中和抗体,VP7和VP3具有群特异性。蓝舌病病毒(BTV)已发现有24个血清型,鹿流行性出血病病毒(EHDV)已发现有8个血清型,每一个型都被认为是一个新的病毒,因此大多数国家将它们列为外来动物疫病[2]。这两种疫病在临床症状和病理变化上极为相似,且在多种诊断方法如琼脂免疫扩散试验、间接免疫荧光技术和补体结合试验中存在交叉反应[2]。因此,一直以来很难对这两种疫病进行快速的鉴别诊断[3]。其常规的病原学诊断方法是病毒分离鉴定、免疫荧光标记抗体检测和病毒核酸检测等,但这些方法中,病毒分离鉴定方法操作费时费力且存在生物安全隐患,免疫荧光标记抗体方法存在敏感性低、特异性差,而目前的病毒核酸检测方法只能进行单一病原的检测等局限性[4-5]。因此,建立一种针对BLU和EHD,在同一个反应管内可同时对二种病毒进行快速鉴别检测的方法,在临床鉴别诊断和出入境动物检疫中具有独特优势和很高的实用价值。LUX(light upon extension)荧光PCR技术是在核酸染料(如SYBR Green I)、TaqMan双标记荧光探针、分子信标等荧光PCR技术之后国际上研发的一种新型实时荧光核酸扩增技术[6-8]。LUX PCR技术采用具有自身荧光淬灭功能的引物,特异性、敏感性与双标记探针技术相当,但成本较低。2003年以来,国外已有应用LUX PCR技术进行核酸表达与动植物疫病检测研究的报道[9-11]。本研究通过基因序列分析,通过特异性单一引物序列3′末端的荧光标记,建立一种能快速的特异性鉴别检测BTV和EHDV的LUX实时荧光PCR方法。
1 材料与方法
1.1 材料
1.1.1 病毒株 蓝舌病病毒(BTV)1~24型、鹿流行性出血病病毒(EHDV)1~8型和赤羽病病毒(AKV)由国家863计划项目课题组保存;VSV-NJ病毒株和VSV-IND病毒株从美国国家兽医服务实验室(NVSL)引进,由深圳出入境检验检疫局动检实验室保存;小反刍兽疫病毒(PPRV)的RNA由英国动物卫生研究所Pirbright实验室惠赠;O型FMDV疫苗株从云南保山疫苗厂引进;牛病毒性腹泻/黏膜病病毒(BVDV),由深圳出入境检验检疫局动检实验室保存。
1.1.2 试剂 SSIII 1-STEP QRT-PCR 100试剂盒、SSIII 1-STEP QRT-PCR 500试剂盒、Total RNA提取试剂盒、Trizol Reagent购于美国Invitrogen公司;三氯甲烷、异丙醇、10 mmol/L dNTP Mixture、25 mmol/L MgCl2、AMV 逆转录酶 、TaqDNA 聚合酶 、40 U/μ L RNase inhibitor(RNA 酶抑制剂)、5×RT buffer 、10×PCR buffer、150 bp DNA ladder Marker、100bp DNA ladder Marker、RNA PCR Kit(AMV)Ver 3.0试剂盒等均为宝生物工程(大连)有限公司产品。
1.2 方法
1.2.1 LUXTM引物设计及序列特异性分析 采用LUXTM专业软件,根据 BTV NS3基因序列和EHDV NS3基因序列,通过特异性单一引物序列3′末端的荧光标记,分别设计LUXTM荧光PCR引物,并采用BLAST软件对各引物进行匹配性和特异性分析,根据分析结果选择合适的引物。BTV下游引物5′端添加发夹形成序列,3′端标记FAM 荧光基团;EHDV下游引物5′端添加发夹形成序列,3′端标记JOE荧光基团。所设计的引物:BTV-NS3上游引物 5′-ACT GAT AGC GGC GGT TGT TG-3′,下游引物 5′-CGT TAT CCG CTC ATG TCA CT T GAT AAC G-3′;EHDV-NS3 上 游引物 5′-TGA TAA TTG CGG CTG TGG TAG C-3′,下游引物5′-CG CTG CAC CCA AAT CAC TTG TCA GCG-3′。由美国Invitrogen公司合成并标记荧光基团。
1.2.2 病毒RNA的提取 将病毒的细胞培养液和组织样品研磨上清液样品各取400 μ L,分别放入1.5 mL的无菌离心管内,加入500 μ L Trizol,充分混匀后室温放置15 min,吹打使组织细胞破碎,加入400 μ L氯仿,振荡混匀后,室温放置 10 min,期间混匀两次。在4℃下12 000 r/min离心15 min,将400 μ L上清液移至另一无菌离心管内,加入400 μ L的异丙醇,充分混匀,室温放置 15 min。在4℃下12 000 r/min离心15 min,缓慢倒掉上清液,沿管壁缓慢加入冰冷的 750 mL/L乙醇 500 μ L,混匀后以12 000 r/min离心10 min,缓慢倒掉乙醇,管底部可见有乳白色RNA沉淀,小心打开管盖,倒扣于吸水纸上,室温自然干燥沉淀的 RNA。加入20 μ L用DEPC处理的无菌双蒸水溶解,用核酸蛋白分析仪检测RNA的纯度和浓度,直接用于反转录或置-70℃保存备用。
1.2.3 BTV和EHDV二重LUX荧光PCR反应体系的建立 采用25 μ L反应体积,通过对退火温度和时间、引物和镁离子浓度等试剂组合与反应条件进行一系列比较试验和优化,建立二重反应体系如下:25 μ L反应混合液含 12.5 μ L UDG 缓冲液(Invitrogen cat.11730-017),4 mmol/L Mg2+,BTV上、下游引物各200 nmol/L,EHDV上、下游引物各100 nmol/L,25 mmol/L ROX 染料0.5 μ L,核酸样品5 μ L;在ABI 7500荧光PCR仪上进行扩增,PCR条件为:50℃2 min,95℃2 min;然后95℃15 s,65℃40 s,35个循环,在65℃反应时采集荧光信号;熔解曲线循环条件采用95℃15 s,60℃30 s,96℃15 s。反应结束,根据扩增曲线、Ct值和熔解曲线判定结果。BTV的反应结果在FAM通道检测,EHDV的检测结果在JOE通道检测。
1.2.4 常规 RT-PCR检测 根据基因库提供的BTV和EHDV各基因的序列,通过Blast分析软件分别对基因的序列进行分析,选择了高度保守和特异性强的区段,应用计算机 Primer软件设计了BTV VP7基因、EHDV VP7基因2对特异性引物,引物由宝生物工程(大连)有限公司合成。引物的序列如下:BTV上游引物:5′-CT T CTT GAA ACT GAG GAA ACC T T-3′,下游引物:5′-AT T TGC ACC ATC GCA T TC TG-3′;EHDV 上游引物 :5′-CCA GAA TGT TAC TAC ATC AAT CGT ATC CT-3′,下游引物:5′-GGC GCC AAT ACG ATA AAG G-3′。RT-PCR 反应体系采用50 μ L 反应体积,具体按说明书进行操作。循环条件如下:50℃30 min,94℃2 min;然后94℃45 s,55℃45 s,72℃1 min,进行30个循环;最后72℃5 min。通过常规琼脂糖凝胶电泳和GoldviewTMDNA染料染色检测扩增产物。BTV扩增产物长度为351 bp,EHDV扩增产物长度为537 bp。
1.2.5 BTV和EHDV二重LUX荧光RT-PCR特异性试验 采用一步法 LUX荧光PCR方法,采用引物浓度优化后的二重 LUX PCR最佳反应条件,按照 1.2.3建立的反应体系,分别以 BTV1、BTV10、BTV17 、EHDV1 、EHDV2 、EHDV5 、VSVNJ、AKV、FMDV 、PPRV 、BVDV 等 的 RNA 和BHK-21细胞总RNA为模板,用2对引物混合液进行LUXTM荧光PCR,以验证LUXTM荧光 PCR的特异性。
1.2.6 BTV和EHDV二重LUXTM荧光PCR鉴别检测的敏感性试验 制备幼仓鼠肾细胞(BHK-21),长成单层后,弃上清营养液,用无血清的维持液洗2次,分别接种BTV和EHDV,37℃吸附1 h,换维持液,于37 ℃培养,当出现75%细胞病变(CPE)时,收获病毒、离心,冻存于-70℃。然后按照Karber氏法测定病毒毒价(TCID50),BTV和EHDV的TCID50测定结果均为 10-7TCID50/50 μ L。用维持液将病毒液稀释成不同滴度,每个稀释度各取50 μ L,按1.2.2提取核酸后,采用二重 LUX 荧光PCR最佳反应条件进行扩增,以评估检测二种病毒的敏感性。同时取10 μ L进行常规二重PCR检测,比较荧光PCR和常规PCR的敏感性。
2 结果
2.1 BTV和EHDV二重LUX荧光PCR最佳反应条件的优化
通过对反转录温度和时间、PCR扩增反应的退火温度和时间、引物和镁离子浓度等试剂组合与反应条件的比较试验和优化,确定最佳反应条件为:反转录50℃15 min,荧光 PCR循环条件为 95℃2 min,然后95 ℃15 s,65 ℃40 s,循环数为40;熔解曲线的循环条件采用95℃15 s,55℃1 min,95℃15 s。在同一个反应管中有BTV和 EHDV两种病毒的 RNA和各自的引物。结果显示,BTV和EHDV分别在FAM和JOE通道检测到典型的扩增信号,熔解曲线分析结果显示BTV在80℃出现明显的吸收峰,EHDV在82℃出现明显的吸收峰。说明如果样品中存在 BTV和 EHDV两种病毒,该反应体系可在同一管中可同时鉴别检测到两种病毒核酸(图1)。
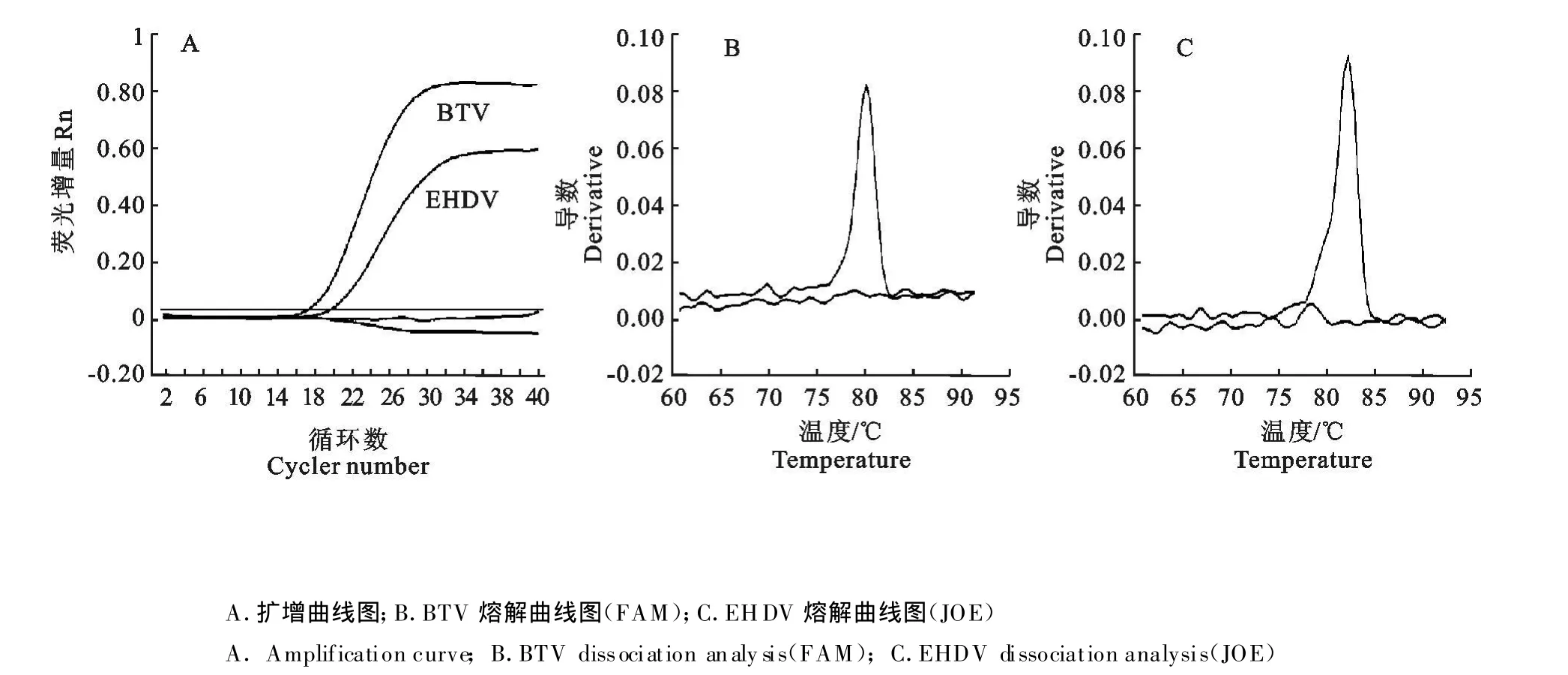
图1 BTV和EHDV二重LUX荧光PCR结果Fig.1 T he result of two-color multiplex LUXTMreal-time PCR for BT V and EHDV
2.2 BTV和EHDV二重LUX荧光PCR的特异性试验
采用已优化的BTV和EHDV二重LUX荧光PCR 反应条件,设立BTV 、EHDV 、VSV-NJ、AKV 、FMDV、PPRV、BVDV等病毒的 RNA和BHK-21细胞总 RNA为模板,用两对引物混合液进行LUXTM荧光PCR,验证LUXTM荧光PCR的特异性。结果显示,在FAM通道,只有BTV样品呈典型的阳性扩增反应,而 EHDV、VSV、AKV、FMDV、PRRV、BVDV等病毒对照和BHK-21细胞对照均呈阴性反应;而在JOE通道,只有EHDV均呈阳性扩增反应,其他病毒对照和BHK-21细胞对照呈阴性反应。熔解曲线结果与扩增曲线分析结果一致。说明BTV和EHDV二重LUX荧光PCR的特异性强,BTV和EHDV之间无交叉反应,与其他相关或相似病毒也无交叉反应现象(图2和图3)。
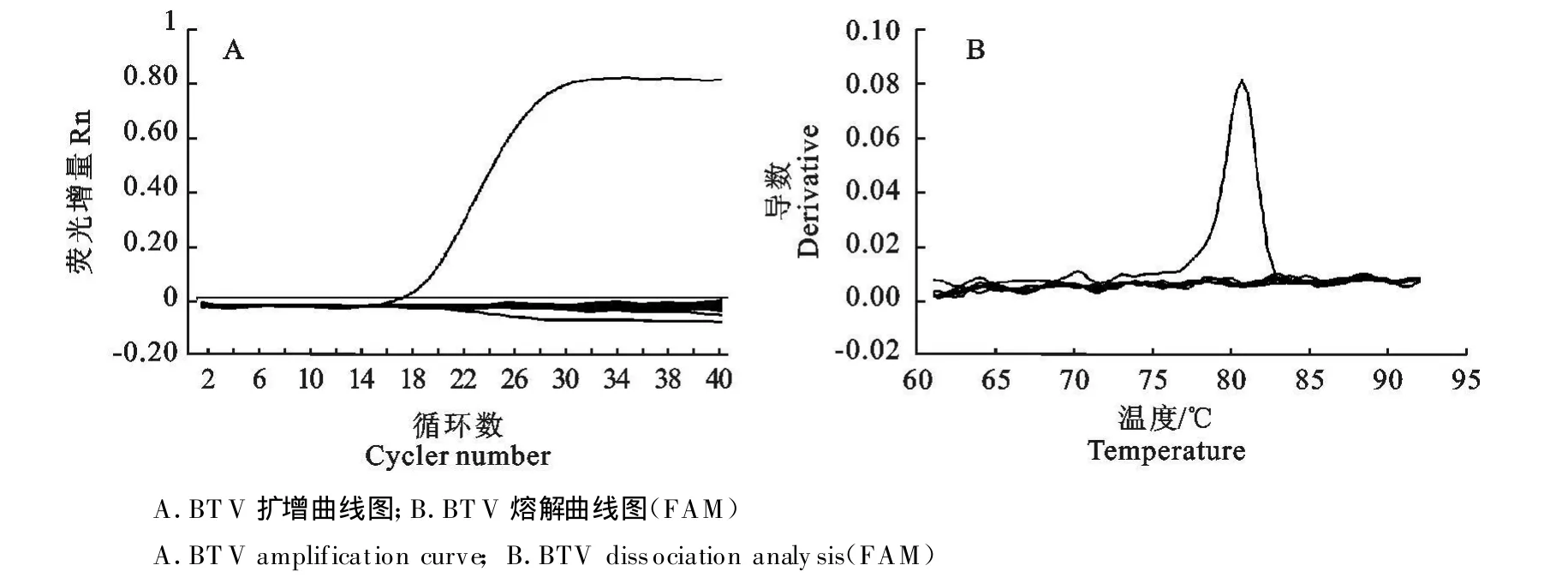
图2 BTV LUX荧光PCR的特异性试验结果Fig.2 The result of L UXTMreal-time PCR specific test for BT V

图3 EHDV LUX荧光PCR的特异性试验结果Fig.3 T he result of LUXTMreal-time PCR specific test fo r EHDV
2.3 BTV和EHDV二重LUX荧光PCR敏感性试验
根据BTV和EHDV病毒毒价测定结果,用维持液将病毒原液做10倍系列稀释成 10-1、10-2、10-3、10-4、10-5、10-6、10-7、10-8,相当于稀释成 10 ×106、10 ×105、10 ×104、10 ×103、10 ×102、10,1、0.1 TCID50,每个稀释度各取50μ L提取病毒核酸,采用已优化的BTV和EHDV二重LUX荧光PCR反应条件,进行BTV和EHDV二重LUX荧光PCR敏感性试验。LUX荧光PCR的敏感性试验结果显示,BTV和EHDV病毒液的检测灵敏度分别为10-6和10-7,分别相当于10个TCID50和1个TCID50。而常规RTPCR对同一批样品的检测灵敏度分别为 10-5和10-6,LUX荧光PCR检测方法的敏感性比常规RTPCR至少高10倍(图4和图5)。
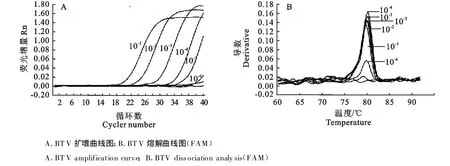
图4 BTV LUX荧光PCR的敏感性试验结果Fig.4 The result of LUXTMreal-time PCR sensitivity test fo r BT V
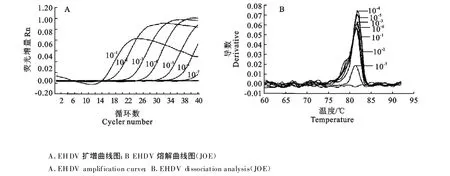
图5 EHDV LUX荧光PCR的敏感性试验结果Fig.5 T he result of LUXTMreal-time PCR sensitivity test for EHDV
2.4 对样品的检测结果
应用BTV和EHDV二重LUX荧光 PCR,对32份BTV1~24型和EHDV1~8型病毒的不同时期的 BHK-21细胞培养液样品进行检测,结果BTV1~24型病毒均在FAM通道检测到典型的扩增信号,熔解曲线分析时在80℃出现明显的吸收峰;EHDV1~8型病毒均在JOE通道检测到典型的扩增信号,熔解曲线分析时在82℃出现明显的吸收峰。说明该方法对各型BTV和EHDV的检测具有通用性和特异性。
3 讨论
本研究采用一种新型的分子生物学检测方法,通过特异性单一引物3′末端的荧光标记,建立了一种快速的能在同一管内对BTV和EHDV进行快速鉴别检测的LUX实时荧光PCR方法。
BTV和EHDV的结构非常相似,核酸序列差异较小,因此在设计 LUX荧光PCR引物时既要考虑选取片段的保守性,又要求这两种病毒的核酸序列差异明显。有研究发现,EHDV编码NS3蛋白的核酸片段10有群特异性,在血清型1和2之间较为保守,同源性为96.3%,而与其他环状病毒属的成员差异较大,如与多种血清型的BTV的相似性较低,在51.4%~54.4%之间,与非洲马瘟3型的相似性仅为27.2%[2,5]。因此,本研究在设计 LUX荧光PCR引物时,选用NS3基因作为目标检测基因。单模板的二重LUX荧光PCR检测结果证明,这两对引物特异性好,EHDV引物对只对EHDV样品呈阳性扩增反应,而与BTV、VSV、AKV等样品呈阴性反应;BTV引物对只对BTV样品呈阳性扩增反应,而与EHDV、VSV、AKV等样品呈阴性反应。
在荧光PCR反应中,对结果的判定往往是依据Ct值和有无明显的扩增曲线,由于引物二聚体有时也会产生荧光信号,出现扩增曲线,因此可能会影响结果的判定[9,12]。本研究方法在PCR扩增反应后,加入熔解曲线的扩增反应,由于特定扩增产物只在特定温度解链并出现特异吸收峰,从而可以排除非特异性扩增引起的干扰。但是由于仪器本身的原因,分析熔解曲线结果时,无法对两种病毒在同一界面上进行分析,每次分析只能选择一个检测通道的样品。BTV和EHDV的LUX荧光PCR特异性检测结果显示,BTV的特异性吸收峰约出现在80℃,而EHDV的特异性吸收峰约出现在82℃。此外,在BTV和EHDV的LUX荧光PCR灵敏度检测结果中发现,熔解曲线结果中样品的特异性吸收峰的峰值高低与PCR扩增反应结果中该样品的荧光增量大小有关,而与样品的浓度无关,荧光增量越大,吸收峰的峰值越高。样品吸收峰的峰值高低是按照扩增反应结果中样品的荧光增量的大小来排列的,因此在熔解曲线图中样品的稀释度排列呈现不规则的现象。这也说明熔解曲线分析可以进一步保证分析结果的准确性。
在BTV和EHDV的二重LUX荧光PCR敏感性试验中,本研究分别采用了单模板和双模板进行PCR扩增。LUX荧光PCR的敏感性试验结果显示,不管是单模板还是双模板混样测试,对检测的最低灵敏度没有影响,但是在混样测试中发现,具有扩增优势的样品会影响另外一个样品扩增的荧光增量和熔解曲线特异性吸收峰峰值的大小。
本研究所建立的二重LUX荧光PCR方法从样品的核酸提取到荧光PCR反应和熔解曲线分析结束,约需2 h~3 h,比起传统的病毒分离方法大大缩短了检测时间。且本方法检测对象是病毒的核酸片段,即使样品中的病毒失活也不会影响检测结果,从而可以提高样品的检出率,这在进出境动物检验检疫中具有实际应用的优势。与常规RT-PCR相比,LUX荧光PCR的检查灵敏度提高了10倍。
[1]M ehlhorn H,Walldorf V,Klimpel S,et al.First occurrence of culicoides obsoletus-transmitted bluetongue virus epidemic in Central Europe[J].Parasitol Res,2007,101:219-228.
[2]Imadeldin E A,Wayne L S,Bennie I O,et al.A multiplex PCR for simultaneous detection and differentiation of North American seroty pes of bluetongue and epizootic hemorrhagic disease viruses[J].Comp Immun Microbiol Infect Dis,2003,26:77-78.
[3]Akita G Y,Chinsangaram J,Osburn B I,et al.Detection of bluetongue virus serog roup by polymerase chain reaction[J].J Vet Diagn Invest,1992,4:400-405.
[4]Orru G,De S P,Solinas F,et al.Differentiation of Italian field and South African vaccine strains of bluetongue virus serotype 2 using real-time PCR[J].J Virol Methods,2004,122:37-43.
[5]Orru G,Ferrando M L,M eloni M,et al.Rapid detection and quantitation of bluetongue virus(BT V)using a molecular beacon fluorescent probe assay[J].J Virol Methods,2006,137:34-42.
[6]Rekhviashvil N,Stevens G,Scott L,et al.Fluorogenic LUX primer for quantitation of HIV-1 by real-time RT-PCR[J].M ol Biotechnol,2006,32(2):101-110.
[7]Nazaren K.Homogeneous detection of nucleic acids using selfquenched polymerase chain reaction primers labeled with a single flo rophore(LUX primers)[J].M ethods Mol Biol,2006,335:95-104.
[8]Chen R,Huang W,Lin Z,et al.Development of a novel realtime RT-PCR assay with LUX primer for the detection of swine transmission gast roenteritis virus[J].J Virol Methods,2004,122:57-61.
[9]Antichou M,Javorschhi S,Ibrahim M,et al.Two color multiplex assay for identification of orthopox viruses with real-time LUX-PCR[J].Mol Cell Probes,2005,19:323-328.
[10]陈 茹,毕英佐,刘琳琳,等.牛疱疹病毒 I型二重 LUXTM荧光PCR基因鉴别方法研究[J].中国兽医科学,2007,37(11):944-949.
[11]陈 茹,刘中勇,曾碧键,等.水泡性口炎病毒血清型特异LUX实时荧光RT-PCR检测方法的建立[J].畜牧兽医学报,2008,39(4):522-528.
[12]Hole K,Clavijo A,Pinedal A.Detection and serotype specific differentiation of vesicular stomatitis virus using a multiplex,real-time,reverse transcription polymerase chain reaction assay[J].J Vet Diagn Invest,2006,18(2):139-146.
Simultaneous Detection and Differentiation of Bluetongue and Epizootic Hemorrhagic Disease Viruses Using Multiplex LUX Real-time PCR
ZHANG Cai-hong1,HUA Qun-yi1,RUAN Zhou-xi1,YANG Jun-xing1,ZENG Shao-ling1,TAO Hong1,CHEN Bing1,CAO Chen-fu1,LIN Qing-yin1,ZHOU Xiao-li2
(1.Shenzhen Entry-Exit Inspection and Quarantine Bureau,Shenzhen,Guangdong,518010,China;2.Y unnan Entry-Exit Inspection and Quarantine Bureau,K unming,Yunnan,650228,China)
A real-time reverse transcriptase(RT)-PCR assay,applying light upon extension(LUX)fluorogenic primers,was developed for rapid detection and identification of bluetongue virus(BTV)and epizootic hemorrhagic disease virus(EHDV).The LUX primers were designed based on the NS3 gene sequence of BTV and EHDV respectively.The assay described here was designed to allow simultaneous detection of BTV and EHDV in a multiplex format.The detection limit of the assay was approximately 10TCID50and 1TCID50for BTV and EHDV respectively.Comparison tests indicated that the LUX real-time RT-PCR assay had at least ten-fold increase of sensitivity than the gel-based RT-PCR method.The real-time PCR assay could differentiate BTV and EHDV from other related disease viruses,such as VSV,PPRV,BVDV,AKV.The whole procedure,including RNA extraction,real-time amplification and dissociation analysis,can be completed within 3 hours.Due to its high specificity,sensitivity,and relative simplicity,the LUX RT-PCR assay provides a novel,rapid,and practical tool for the identification detection and of BTV and EHDV.
LUX real-time RT-PCR;Bluetongue virus;Epizootic hemorrhagic disease virus
S852.659.4
A
1007-5038(2010)03-0006-06
2009-09-28
国家863计划项目(2006AA10Z445)
张彩虹(1980-),女,河北邯郸人,兽医师,主要从事动物检疫和诊断方法研究。*通讯作者

