Pitzer理论在CaSO4-Ca(OH)2-H2O系硫酸根平衡浓度计算中的应用
彭小玉 ,王云燕,柴立元,舒余德
(1. 中南大学 冶金科学与工程学院,湖南 长沙,410083;2. 湖南省环境监测中心站,湖南 长沙,410014)
在有色金属湿法冶炼、电镀、采矿及制碱等行业中,普遍使用硫酸盐体系,每年产生大量含有重金属的酸性硫酸盐废水[1-3]。此类酸性废水中硫酸根离子质量浓度较高,其中部分废水中质量浓度高达2.0×103mg/L以上。根据已有的研究结果,当水中硫酸根含量较高时,会产生一系列危害[4-6]:(1) 腐蚀管道。在各类输水管中,它将直接减小水的电阻而增加腐蚀,间接地影响到硫酸盐还原菌的循环和生物腐蚀的传播;(2) 过量的硫酸根可使水体产生恶臭,影响水的感官性状及其使用;(3) 过量的硫酸根不利于作物生长,使土地盐渍化;(4) 含硫酸盐的饮用水有苦涩味,并有致泻作用,如长期饮用,将引起腹泻和消化不良等症状[7-8]。因此,水中硫酸根含量对其使用性能的影响越来越引起人们的关注。目前,对于含有重金属的酸性硫酸盐废水,许多大型冶炼厂采用石灰乳中和沉淀法,有效地去除了废水中的重金属离子及控制溶液的酸度[9-11],但净化水中钙离子及硫酸根离子将不断富集,属腐蚀和结垢复合型水质,因而不宜直接回用。马鸿文等[12]进行了相关方面的研究,指出了通过向Na2SO4-H2O系中加入CaO而析出CaSO4沉淀的可行性,但理论研究尚未见报道。为了使有色冶炼废水回用,并达到零排放,本文作者利用20世纪70年代发展起来的 Pitzer电解质溶液理论,计算CaSO4-Ca(OH)2-H2O多组分体系中硫酸根平衡浓度的变化规律,为从废水中脱除 Ca2+和 SO24-离子提供理论依据。
1 CaSO4-Ca(OH)2-H2O系溶解度计算原理
1.1 固液溶解平衡的溶度积和活度积
在一定温度下,各种盐在水中溶解达到饱和时,便达到了溶解平衡[13-14]。对于一种给定的盐MN1XN2,其溶解平衡可以表示为:
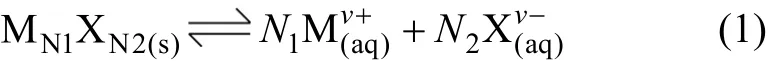
当达到平衡时:
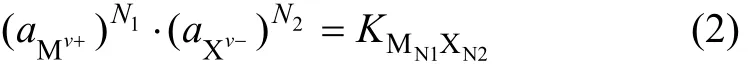
式中: aMv+和 aXv-分别为阳离子和阴离子在溶解平衡时的活度; KMN1XN2为盐在水中的溶解平衡常数。它与温度和离子强度有关,故称为电解质活度积。对于溶解度极小的微溶电解质,如其饱和溶液中无其他电解质存在,则溶液中离子强度不大,近似地认为电解质的活度积等于溶度积。作者假设此结论适用于CaSO4-Ca(OH)2-H2O三元体系。
1.2 25 ℃时 CaSO4-Ca(OH)2-H2O 系硫酸根平衡浓度的计算
CaSO4-Ca(OH)2-H2O系是1个由含有共同阳离子Ca2+的盐、碱和水组成的三元体系。若CaSO4是饱和的,其浓度为 c(),Ca(OH)2没有饱和,其浓度为0.5c(OH-),则CaSO4溶解平衡的活度积为:
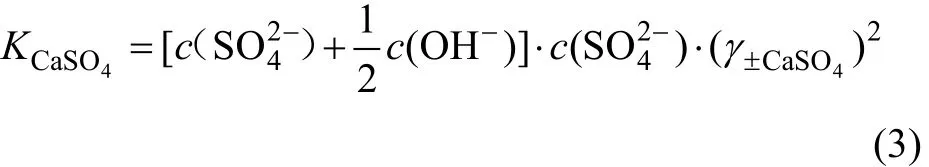
若c(OH-)是已知的,而c(S O24-)未知,在Ca(OH)2浓度为0.5c(OH-)时,可利用式(3)求c(CaSO4):
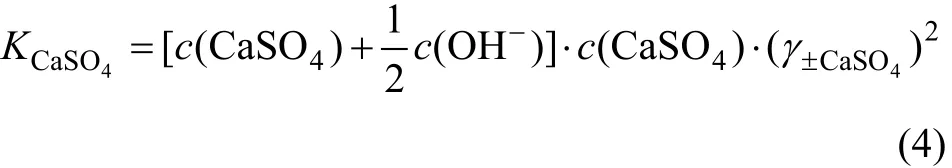
因为 KCaSO4已知,而CaSO4平均活度系数 γ±CaSO4是 c(CaSO4)和 c(OH-)二者的函数,所以,原则上c(CaSO4)是可以求解的,即CaSO4在三元体系中溶解度曲线上的一个未知坐标是可以求得的。
同理,若Ca(OH)2是饱和的,其浓度为0.5c(OH-),CaSO4没有饱和,其浓度为 c(),则 Ca(OH)2的溶解平衡常数为:
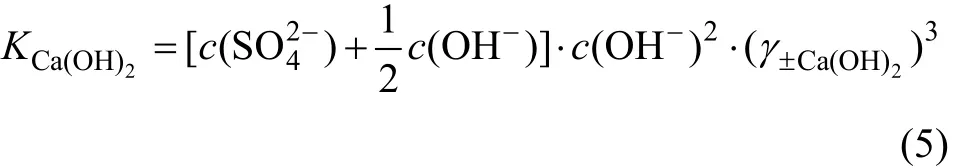
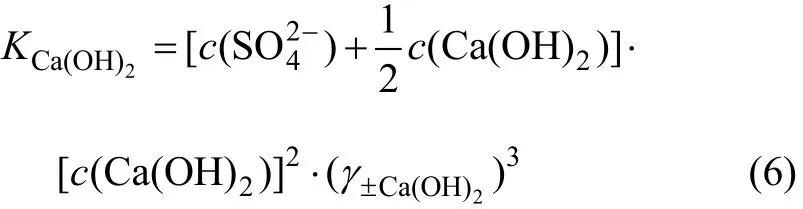
由(4)及(6)式表明:要求得 CaSO4-Ca(OH)2-H2O三元系的平衡浓度,首先要求得 CaSO4及Ca(OH)2的平均离子活度系数。
2 平均离子活度系数的计算方程式
根据Pitzer理论,混合电解质溶液中电解质平均活度系数,可以利用下式计算[15-16]:
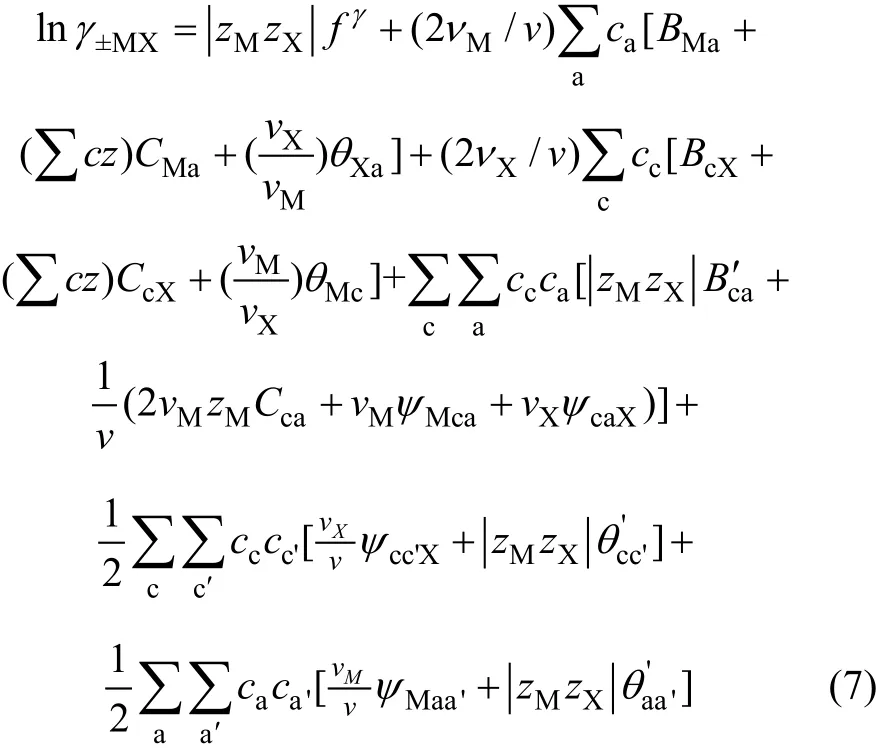
式中:代表正离子的c包括了离子M,代表负离子的
a包括了离子X;zM和zX为电解质MX中阳离子M的电荷数和阴离子X的电荷数;vM, vX和v分别为电解质MX电离出的阳离子M的数目,阴离子X的数目和离子总数,v=vM+vX;mc和ma为阳离子c和阴离子a的摩尔浓度;a和c为分别表示阴离子和阳离子;a′和 c′分别表示不同的另一种阴离子和阳离子;θ为 2个不同种类的同号离子的Pitzer作用参数;ψ为3个不同种类离子(2个阳离子和1个阴离子或2个阴离子和1个阳离子)的作用力参数;

3 计算过程
利用Pitzer电解质溶液理论计算混合电解质活度系数,其基本计算过程如下。
3.1 查找所需Pitzer参数
本计算过程中所需的电解质 Pitzer参数[17]如表1和表2所示。注:c为阳离子;a为阴离子;θ为2个不同种类的同号离子的Pitzer作用参数;ψ为3个不同种类离子的作用力参数。
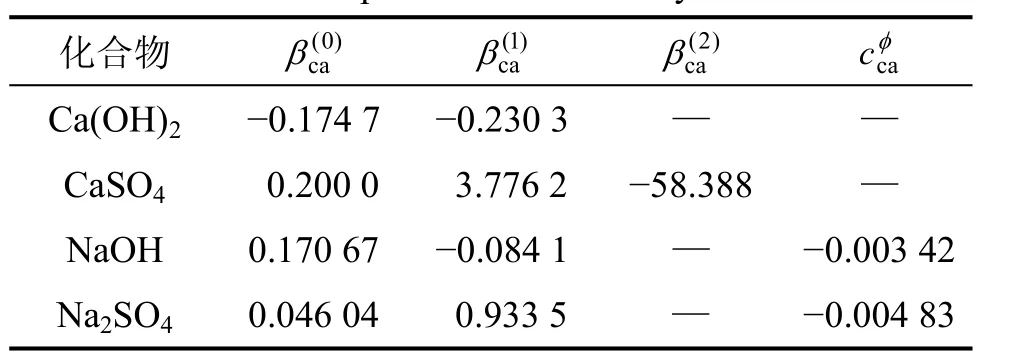
表1 25 ℃时电解质的Pitzer参数Table 1 Pitzer parameter of electrolytes at 25 ℃

表2 25 ℃时电解质的Pitzer参数θ和ψ值Table 2 Pitzer mixing parameters of electrolytes at 25 ℃
3.2 求混合电解质的平均活度系数或
由于混合体系的多样性,混合参数θ和ψ的数目尚不能满足实际计算的需要,一个近似的计算方法是假定未知的θ和ψ为0。此外,由于CaSO4属难溶化合物,其溶解度很小,浓度范围只有1.0 mol/L以下,拟合时可将 cφ当作0 mol/L来处理,这是因为 cφ描述的是三离子的相互作用,数值通常都很小。基于以上2点,将查找所得的Pitzer参数代入式(7)中,可得出

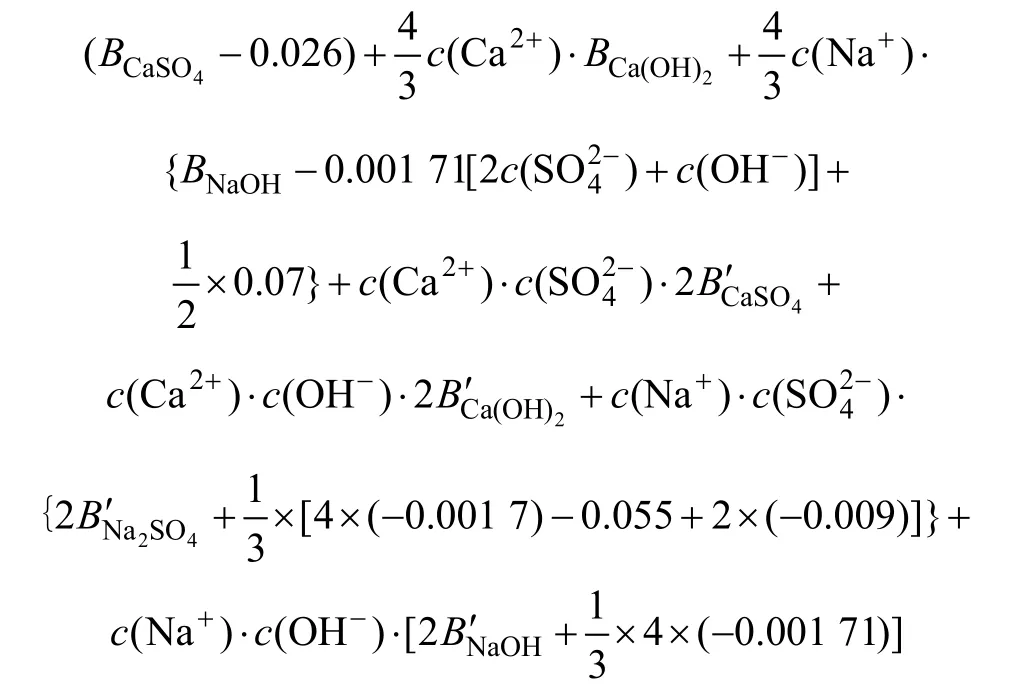
3.3 计算离子活度的乘积
修正活度系数,计算离子的活度积,根据离子活度积与电解质的溶解平衡常数的关系判断电解质溶解是否达到平衡。
对于CaSO4饱和区,离子活度积k为:
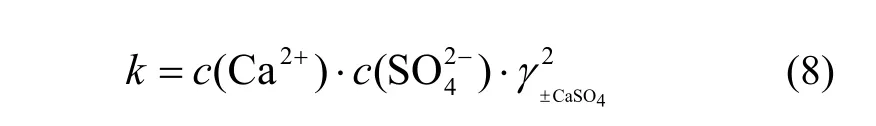
对于Ca(OH)2饱和区,离子活度积k为:
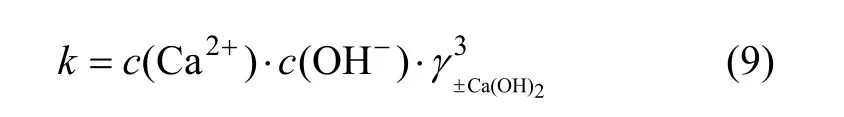
3.4 计算程序
由于Pitzer电解质溶液理论中计算混合电解质活度系数的过程十分复杂,整个求解过程非常困难,本文作者借助于计算机编程完成整个过程,其基本框架如图1所示。
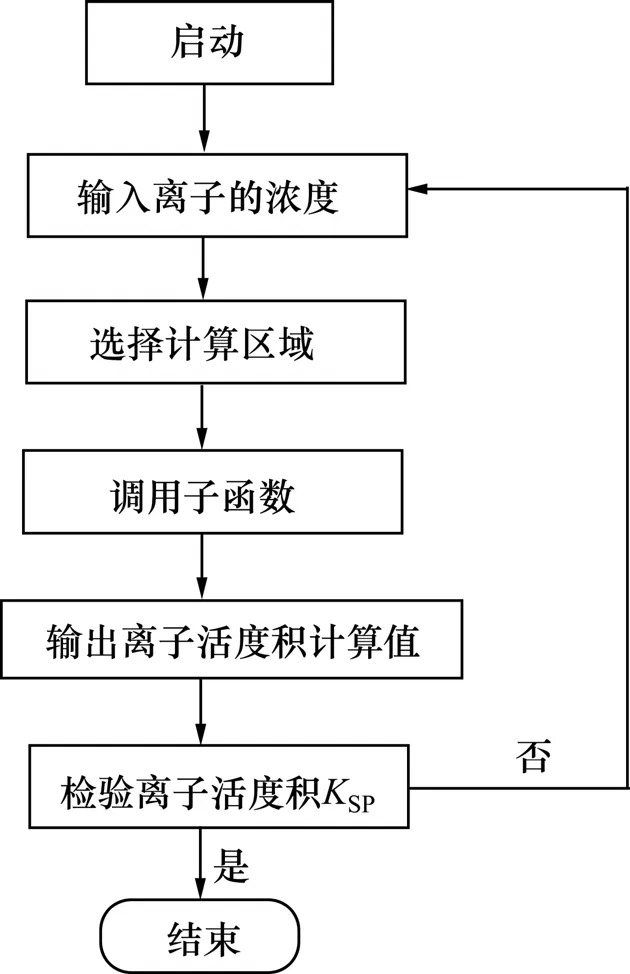
图1 CaSO4-Ca(OH)2-H2O系硫酸根平衡浓度的计算框图Fig.1 Calculation program of sulfate equilibrium concentration in CaSO4-Ca(OH)2-H2O system
4 计算结果
4.1 运用 Pitzer理论计算 CaSO4-Ca(OH)2-H2O 系的平衡浓度
利用 Pitzer电解质溶液理论计算 25 ℃时三元体系CaSO4-Ca(OH)2-H2O在pH为3.0~14.0时 SO24-的平衡浓度及CaSO4的活度系数,计算结果如图2及表3所示。
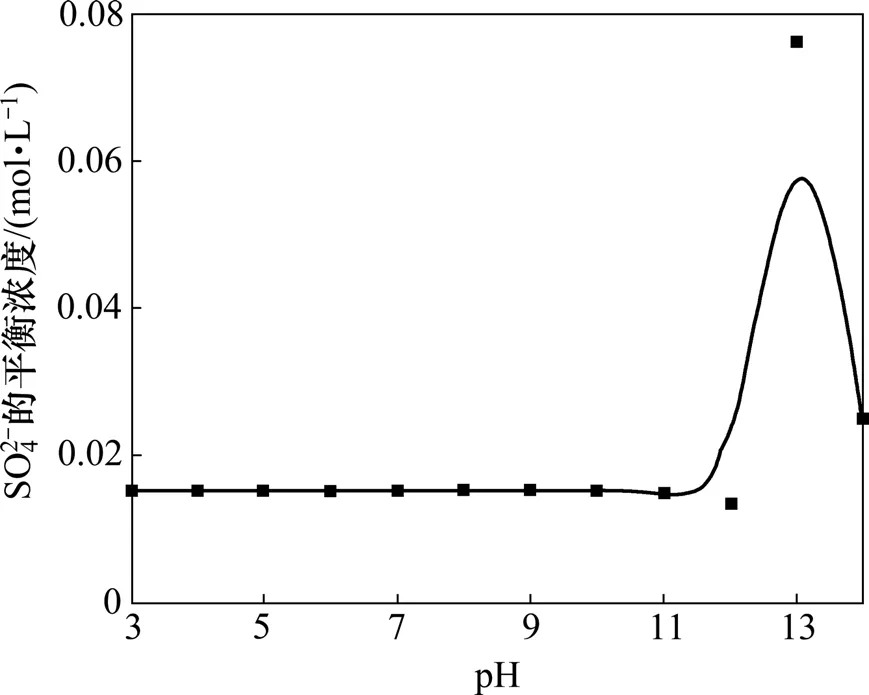
图2 pH对CaSO4-Ca(OH)2-H2O系 SO 24 -平衡浓度的影响Fig.2 Effect of pH on sulfate equilibrium concentration in CaSO4-Ca(OH)2-H2O system
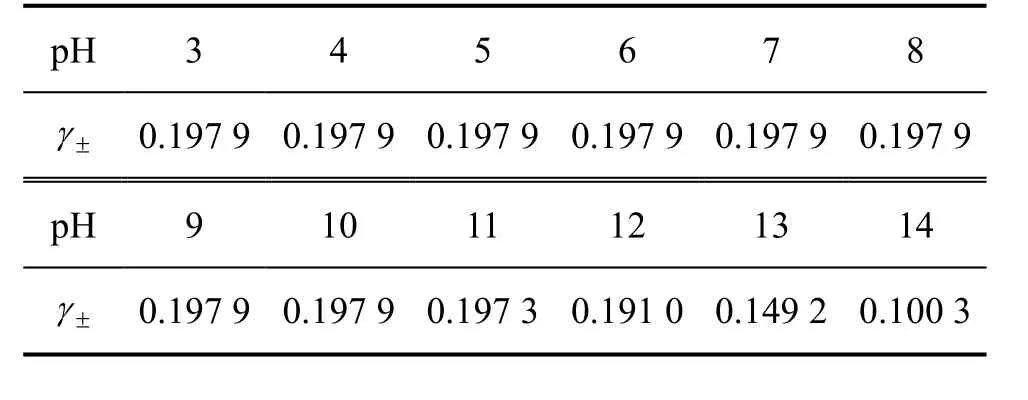
表3 25 ℃时CaSO4-Ca(OH)2-H2O系中CaSO4的平均活度系数Table 3 Average activity coefficients of CaSO4 in CaSO4-Ca(OH)2-H2O system at 25 ℃
由图2及表3可以看出:当pH在3.0~10.0范围内时,的平衡浓度基本维持一恒定值,约为0.015 2 mol/L,而pH在10.0~13.0范围内的平衡质量浓度随着pH的增大而先略微减小随后显著增大,pH在13.0~14.0时的浓度又随着pH的增大而减小。图2所示曲线表明:用Ca(OH)2控制溶液酸度,在pH为 3.0~12.0范围内不能用 Ca(OH)2将脱除到0.015 2 mol/L以下。其原因是溶液pH<12.0时,溶液中Ca2+浓度为0.012 9 mol/L,随着pH的减小,溶液中加入的Ca2+浓度也减少,而CaSO4溶度积所需要的Ca2+浓度约为0.013 3 mol/L,故pH<12.0时加入氢氧化钙所提供的Ca2+浓度略小于CaSO4溶度积所需要的Ca2+浓度。因此,在此pH范围内,Ca(OH)2不能将 SO24
-脱除到0.015 2 mol/L以下;当pH为12.0~13.0时,随着pH增加 SO24-平衡浓度增加,表明硫酸根不与Ca2+发生沉淀反应将 SO24-脱除,其原因是氢氧化钙溶度积比硫酸钙的溶度积小,以及pH高时OH-浓度大,故Ca2+以Ca(OH)2优先沉淀,Ca(OH)2的平衡Ca2+浓度不足以使硫酸钙沉淀,故 SO24-以游离形态存在。随着pH继续增大,大量的Ca(OH)2沉淀形成,沉淀在沉降过程中会集卷溶液中的部分 SO24-,从而使溶液中SO2-浓度呈下降趋势,但 SO2-的平衡质量浓度不低
4
4于0.049 4 mol/L。综上所述,当pH大于12.0时也不能用Ca(OH)2将 SO24-脱除到0.015 2 mol/L以下。
4.2 Na+对CaSO4-Ca(OH)2-H2O系 SO 42 -平衡浓度的影响
含重金属酸性硫酸盐废水经石灰乳中和沉淀法处理后,溶液中残留有大量的Ca2+,生产中通常采用加入Na2CO3形成CaCO3沉淀以降低溶液中的Ca2+浓度,故溶液中存在大量 Na+。为了查明 Na+对 CaSO4-Ca(OH)2-H2O系 SO24-平衡浓度的影响,利用Pitzer电解质溶液理论计算 25 ℃时 Na+存在时三元体系CaSO4-Ca(OH)2-H2O在pH为3.0~14.0范围内 SO24-平衡浓度及活度系数,计算结果如图3及表4所示。
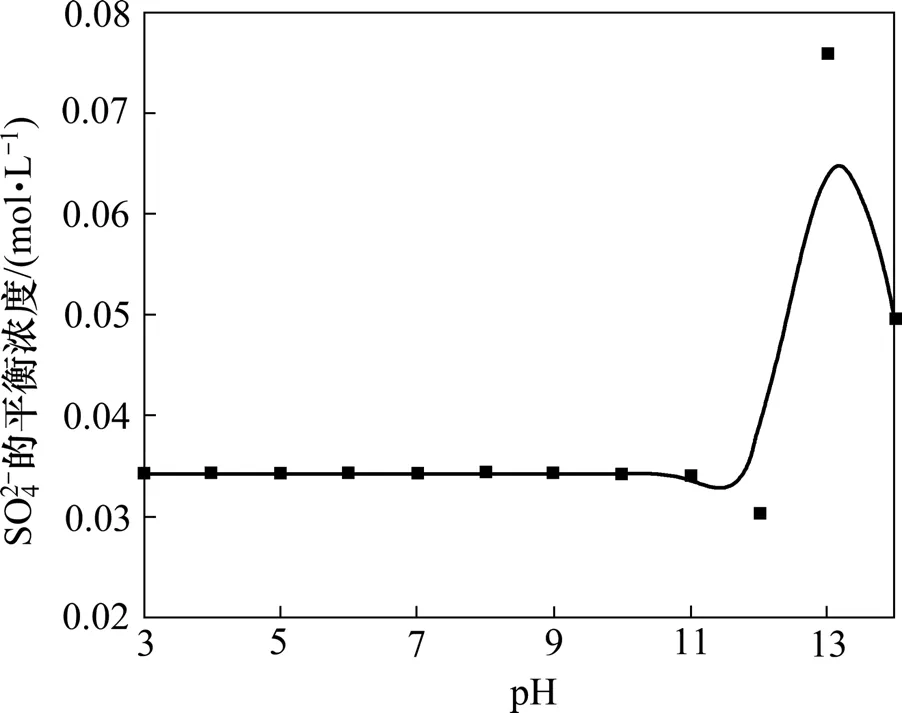
图3 Na+对CaSO4-Ca(OH)2-H2O系 SO 24 -平衡浓度的影响Fig.3 Effect of Na+ on sulfate equilibrium concentration in CaSO4-Ca(OH)2-H2O system
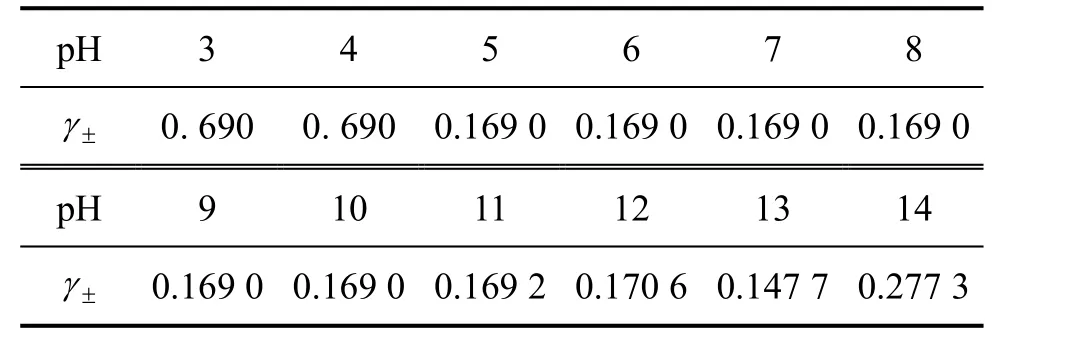
表4 25 ℃时CaSO4-Na2SO4-Ca(OH)2-NaOH-H2O系中CaSO4的平均活度系数Table 4 Average activity coefficients of CaSO4 in CaSO4-Na2SO4-Ca(OH)2-NaOH-H2O system at 25 ℃
由图3及表4可以看出:pH在3.0~10.0范围内时,SO2-的平衡浓度基本维持一恒定值,约为 0.034 3
4 mol/L,而pH在10.0~13.0范围内 SO24-的平衡浓度随着 pH的增大而先略微减小随后显著增大;当pH在13.0~14.0时,SO24-浓度又随着pH的增大而减小。结果表明:该体系 SO24-浓度均高于三元系 CaSO4-Ca(OH)2-H2O中 SO24-的平衡浓度,表明溶液中Na+的存在使溶液中 SO24-的平衡浓度增大,说明溶液中Na+的存在不利于 SO24-的去除。
5 结论
(1) 在温度为25 ℃,pH为3.0~10.0时,CaSO4-Ca(OH)2-H2O三元系中 SO24-平衡质量浓度基本维持一恒定值,约为0.015 2 mol/L。而pH为10.0~13.0时,SO2-的平衡质量浓度随着pH的增大而先略微减小随
4后显著增大;当pH为13.0~14.0时, SO24-的质量浓度又随着pH的增大而减小。在pH为3.0~14.0时,向硫酸废水中单独加入 Ca(OH)2,不能将 SO24-脱除到0.015 2 mol/L以下。
(2) 在 25 ℃时,pH 为 3.0~14.0 时,Na+对 CaSO4-Ca(OH)2-H2O三元系中 SO24-平衡质量浓度的影响规律为: SO24-平衡质量浓度均高于三元系 CaSO4-Ca(OH)2-H2O中 SO24-的平衡质量浓度,表明溶液中Na+的存在使溶液中 SO24-的平衡浓度增大,溶液中Na+的存在不利于 SO24-的去除。
[1] 王广兴, 郭连才. 控制硫酸根含量的有效方法[J]. 中国氯碱,2006(1): 6-7.WANG Guang-xing, GUO Lian-cai. Effective method of control SO2-content[J]. China Chlor-Alkali, 2006(1): 6-7.4
[2] 王华, 曾振欧, 赵国鹏, 等. 硫酸盐溶液体系中三价铬镀厚铬工艺及镀层性能研究[J]. 电镀与涂饰, 2007, 26(6): 13-17.WANG Hua, ZENG Zhen-ou, ZHAO Guo-peng, et al. Study on the process of thick chromium plating and coating performance from trivalent chromium sulfate electrolyte[J]. Electroplating &Finishing, 2007, 26(6): 13-17.
[3] 吴慧敏, 康健强, 左正忠, 等. 全硫酸盐体系三价铬电镀铬的研究[J]. 武汉大学学报: 理学版, 2004, 50(2): 187-191.WU Hui-min, KANG Jian-qiang, ZUO Zheng-zhong, et al.Study of electroplating with thrivalent chromium in sulfate system[J]. Journal of Wuhan University: Natural Science Edition,2004, 50(2): 187-191.
[4] 柴立元, 刘恢, 闵小波, 等. 改性活性污泥高效处理高浓度硫酸盐废水[J]. 中南大学学报: 自然科学版, 2005, 36(3):431-436.CHAI Li-yuan, LIU Hui, MIN Xiao-bo, et al. Efficient treatment of high concentration sulfate wastewater by modified aerobic activated sludge[J]. Journal of Central South University: Science and Technology, 2005, 36(3): 431-436.
[5] 谢杰, 洪文笔, 高玉梅, 等. 液膜分离技术提取水中硫酸根的可行性分析[J]. 吉林建筑工程学院学报, 2007, 24(4): 5-8.XIE Jie, HONG Wen-bi, GAO Yu-mei, et al. The feasibility analysis of extracting sulfate from water by liquid membrane separation technology[J]. Journal of Jilin Architectural and Civil Engineering Institute, 2007, 24(4): 5-8.
[6] Benattia C T, Tavares C R G, Lenzi E. Sulfate removal from waste chemicals by precipitation[J]. Journal of Environmental Management, 2009, 90(1): 504-511.
[7] Lens P N L, Visser A N L, Janssen A J H, et al. Biotechnological treatment of sulfate-rich wastewaters[J]. Critical Reviews in Environmental Science and Technology, 1998, 28(1): 41-88.
[8] Ghigliazza R, Lodi A, Rovatti M. Kinetic and process considerations on biological reduction of soluble and scarcely soluble sulfates[J]. Resources, Conservation and Recycling,2000, 29(3): 181-194.
[9] 王新文. 我国大型冶炼厂酸性废水处理工程概况[J]. 矿冶,2000, 9(2): 84-89.WANG Xin-wen. Survey on treatment of acidic wastewater from large smelteries in China[J]. Mining and Metallurgy, 2000, 9(2):84-89.
[10] 宋显洪, 周志鹤. 含重金属的硫酸废水的治理[J]. 化工环保,1999, 19(5): 284-286.SONG Xian-hong, ZHOU Zhi-he. Treatment of sulfuric acid wastewater containing heavy metals[J]. Environmental Protection of Chemical Industry, 1999, 19(5): 284-286.
[11] 袁林, 柴立元, 闵小波, 等. 剩余污泥与人造沸石复合体系去除废水中的钙离子[J]. 中国有色金属学报, 2007, 17(5):825-829.YUAN Lin, CHAI Li-yuan, MIN Xiao-bo, et al. Removal of calcium ion from wastewater using waste activated sludge and artificial zeolites[J]. The Chinese Journal of Nonferrous Metals,2007, 17(5): 825-829.
[12] 马鸿文, 王英滨, 王芳, 等. 硅酸盐体系的化学平衡: (Ⅱ). 反应热力学[J]. 现代地质, 2006, 20(3): 397.MA Hong-wen, WANG Ying-bin, WANG Fang, et al. Chemical equilibrium in silicate system: (partⅡ ). Reaction thermodynamics[J]. Geoscience, 2006, 20(3): 397.
[13] 宋彭生, 罗志农. 三元水盐体系 25 ℃溶解度的预测—Pitzer电解质溶液理论应用之一[J]. 化学通报, 1983(12): 13-19.SONG Peng-sheng, LUO Zhi-nong. Prediction of the solubility of ternary water-salts system at 25 ℃—One of the applicatlon of Pitzer’s theory of electrolyte solutions[J]. Chemistry, 1983(12):13-19.
[14] 李亚红, 高世扬, 宋彭生, 等. Pitzer混合参数对HCl-NaCl-H2O体系溶解度预测的影响[J]. 物理化学学报,2001, 17(1): 91-94.LI Ya-hong, GAO Shi-yang, SONG Peng-sheng, et al. Effects of Pitzer mixing parameters on the solubility prediction of the phase system HCl-NaCl-H2O[J]. Acta Phys Chim Sin, 2001,17(1): 91-94.
[15] 高世扬, 宋彭生, 夏树屏. 盐湖化学: 新类型硼锂盐湖[M].北京: 科学出版社, 2007: 136-174.GAO Shi-yang, SONG Peng-sheng, XIA Shu-ping. Salt lake chemistry: New types boron-lithium salt lake[M]. Beijing:Science Press, 2007: 136-174.
[16] 李以圭, 陆九芳. 电解质溶液理论[M]. 北京: 清华大学出版社, 2005: 232-264.LI Yi-gui, LU Jiu-fang. Electrolyte solution theory[M]. Beijing:Tsinghua University Press, 2005: 232-264.
[17] 牛自得, 程芳琴, 李宝存, 等. 水盐体系相图及其应用[M].天津: 天津大学出版社, 2002: 172-179.NIU Zi-de, CHENG Fang-qin, LI Bao-cun, et al. Phase diagram of salt-water systems and its application[M]. Tianjin: Tianjin University Press, 2002: 172-179.

