阳离子光固化活性单体氧杂环丁烷的合成
刘安昌,夏 强,张 良,李高峰
(武汉工程大学湖北省新型反应器与绿色化学工艺重点实验室,湖北 武汉 430074)
0 引 言
阳离子光固化材料广泛应用于涂料、油墨、电子封装、印刷和快速成型等领域[1],其主要成分由两部分组成:光引发体系和可紫外光固化的活性树脂.常用的阳离子UV固化的活性树脂有环氧化合物和乙烯基醚.环氧化合物在强酸作用下可发生开环聚合.双酚A环氧树脂是最常用的一种,但它的聚合速度慢.脂肪族环氧化合物[2]一般聚合速度快,固化制件耐候性好,具有良好的电绝缘性能,已成为阳离子固化体系中主要的反应原料,其主要品种有:3,4-环氧环己基甲酸-3,4-环氧己基甲基酯(商品名:UVR-6110)和二-(3,4-环氧己基)己二酸酯(商品名:UVR-6128).但该类化合物合成工艺复杂,成本较高.乙烯基醚类化合物也可以进行阳离子聚合,用作阳离子光固化预聚物或活性稀释单体[3].它们具有速度快、粘度低等优点.它们还可以与环氧化合物生成杂化聚合物,与丙烯酸酯、马来酸酯、顺丁烯二酰亚胺等生成共聚物.但该类化合物易挥发,气味较大,对环境污染较大.其主要品种有:三甘醇二乙烯基醚(DVE-3);1,4-环已基二甲醇二乙烯基醚(CHVE)和4-羟丁基乙烯基醚(HBVE)等.
近年来,日本东亚合成公司合成了系列氧杂环丁烷单体和齐聚物[4].这些化合物具有粘度低、固化收缩率低、粘接强度高、聚合速度快、毒性低和不易挥发等特点,广泛用于紫外光固化材料.其主要品种有:
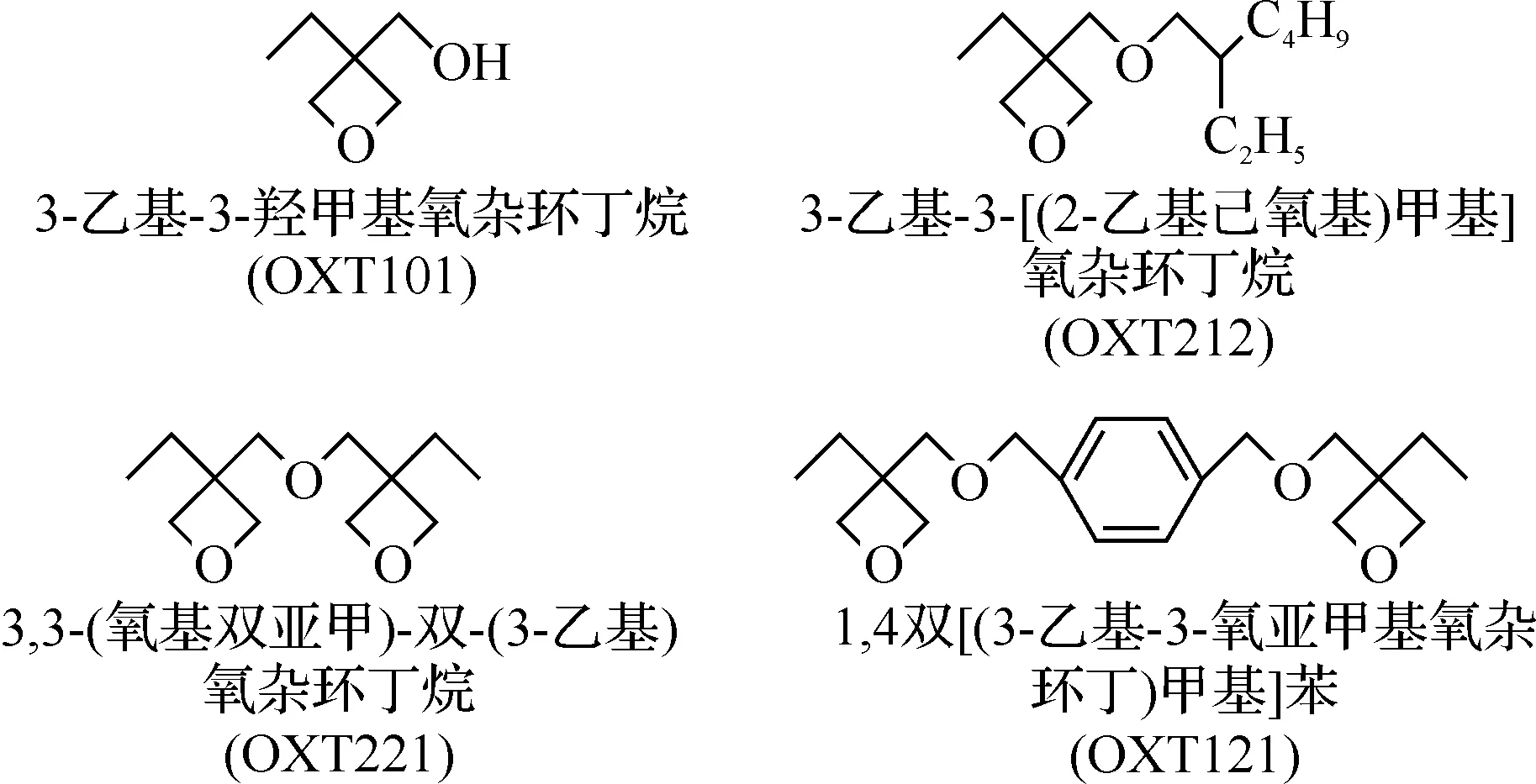
氧杂环丁烷类阳离子光固化单体合成国内还未见报道,笔者在文献[5-8]的基础上,对3,3-(氧基双亚甲基)-双-(3-乙基)氧杂环丁烷的合成工艺进行了详细的研究,其合成路线见图1.
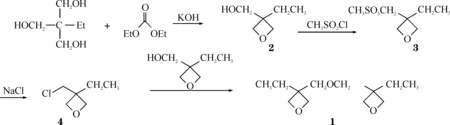
图1 3,3-(氧基双亚甲基)-双-(3-乙基)氧杂环丁烷的合成路线
1 实验部分
1.1 主要实验药品和仪器
三羟甲基丙烷,分析纯,天津市福晨化学试剂厂生产;碳酸二乙酯,化学纯,国药集团化学试剂有限公司生产;甲基磺酰氯,工业品,湖北孝昌金鸡化工厂生产;氯化钠,分析纯,天津市福晨化学试剂厂生产.日本岛津IR-408型红外分光光度计(KBr压片);瑞士BrukerAvance 400NMR型核磁共振仪.
1.2 3-乙基-3-羟甲基氧杂环丁烷(2)的合成
在装有温度计,搅拌器和蒸馏装置的250 mL的三口反应瓶中,加入80.4 g(0.6 mol)三羟甲基丙烷,用少量的乙醇做溶剂,再加入70.8 g(0.6 mol)的碳酸二乙酯,加热至110~120 ℃,反应5~6 h,至无乙醇馏出,升温至180~185 ℃,进行裂解反应,此时有大量的二氧化碳放出.当二氧化碳气泡明显减少时,裂解基本完毕,减压蒸馏,收集120~125 ℃/267 Pa的馏分57.5 g,收率82.6%.
1.3 3-乙基-3-甲磺酰基甲基氧杂环丁烷(3)的合成
在装有温度计,搅拌器和滴液漏斗的500 mL的三口反应瓶中,加入139.2 g(1.2 mol)的3-乙基-3-羟甲基氧杂环丁烷(2)和200 mL甲苯,冷却至-10~-15 ℃,在-10 ℃以下滴加137.4 g(1.2 mol)的甲烷磺酰氯.滴加完毕,升至室温继续反应2 h.加入200 mL蒸馏水至反应瓶中,分层,有机层用3×150 mL质量分数为5%的NaCl水溶液洗涤,再用蒸馏水洗至中性,浓缩得棕红色液体,减压蒸馏,收集140~148 ℃/2Pa的馏分155 g,收率66.6%.
1.4 3-乙基-3-氯甲基氧杂环丁烷(4)的合成
在装有温度计,搅拌器和回流冷凝管的250 mL的三口反应瓶中,加入97.0 g(0.5 mol)的3-乙基-3-甲磺酰基甲基氧杂环丁烷(3),35.1 g(0.6 mol)氯化钠和100 mL甲苯,加热回流反应3 h.冷却,将反应物倾入80 mL蒸馏水中分层,有机层用3×30 mL蒸馏水洗,浓缩得淡黄色液体,减压蒸馏,收集84~86 ℃/267 Pa的馏分64.2 g,收率95.4%.
1.5 3,3-(氧基双亚甲基)-双-(3-乙基)氧杂环丁烷的合成
在装有温度计,搅拌器和回流冷凝管的250 mL的三口反应瓶中,加入26.9 g(0.2 mol)的3-乙基-3-氯甲基氧杂环丁烷(4),48%的氢氧化钠溶液32.4 g,23.2 g(0.2 mol)3-乙基-3-羟甲基氧杂环丁烷(2)和100 mL甲苯.加入0.2 g四丁基溴化铵作相转移催化剂,在100~102 ℃的条件下反应6 h.冷却,加入80 mL蒸馏水中分层,有机层用3×30 mL蒸馏水洗,浓缩得淡黄色液体,减压蒸馏,收集128~130 ℃/267 Pa的馏分37.6 g,收率88.0%.(文献[8]收率75.6%)
2 结果与讨论
2.1 3,3-(氧基双亚甲基)-双-(3-乙基)氧杂环丁烷的结构确证
图2和图3为3,3-(氧基双亚甲基)-双-(3-乙基)氧杂环丁烷红外光谱图和核磁共振图.从图2红外光谱图可知,其红外吸收有IR,υ(cm-1):2963,2933,2867,1462,1412,1375为甲基和亚甲基的红外吸收峰;1112为C—O—C醚键的非环外吸收峰;981,827为C—O—C环醚吸收峰.图3核磁共振谱图表明1H-NMR(CDCl3):δ:0.87(t,6H,CH3)为甲基(a)的化学位移;1.74(q,4H,CH2)为亚甲基(b)的化学位移;3.579(s,4H,CH2)为亚甲基(c)的化学位移;4.36(d,4H,CH2);4.44(d,4H,CH2)分别为亚甲基(d)和(e)的化学位移.由此可以证明,所合成的目的产物结构得到确证.
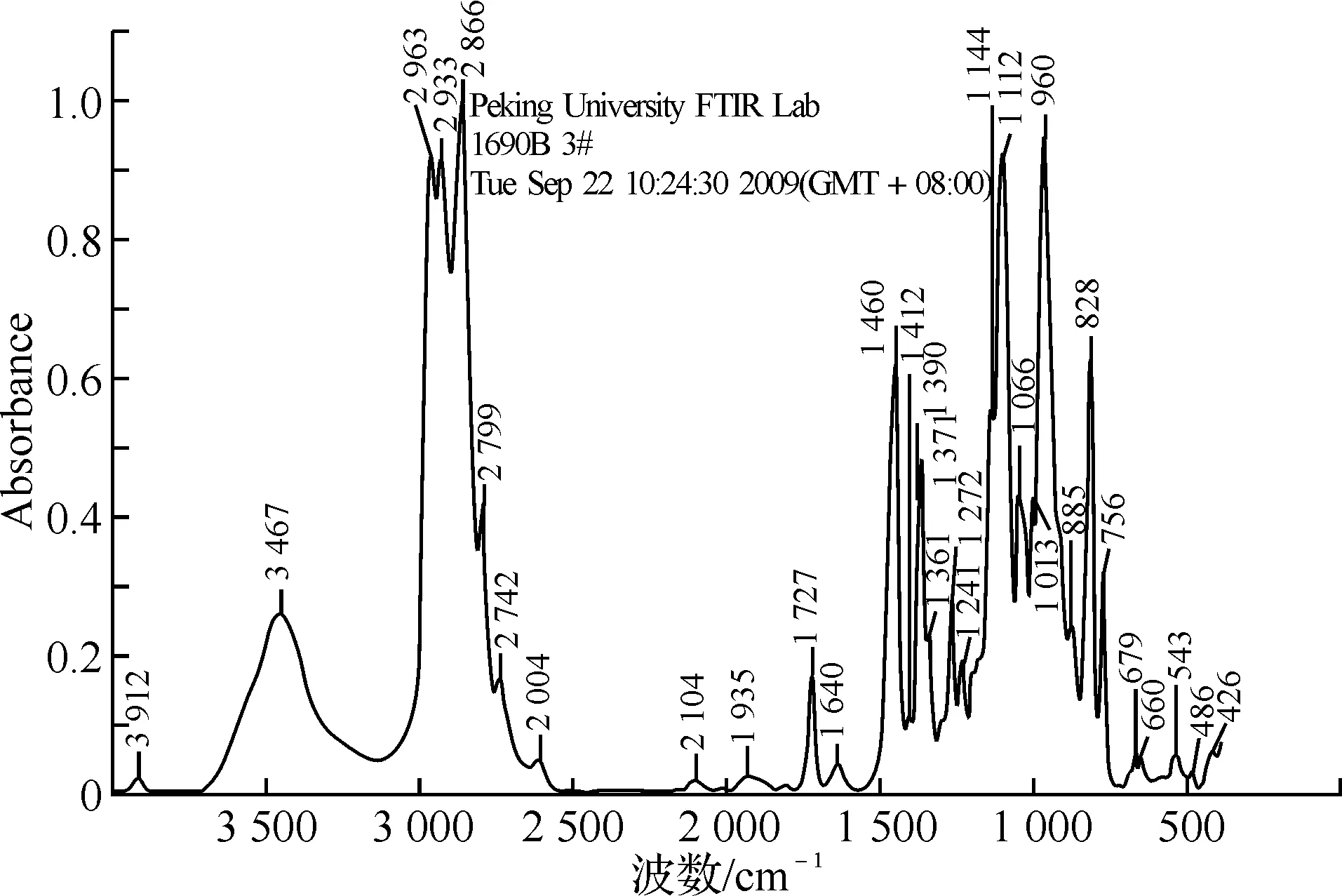
图2 3,3-(氧基双亚甲基)-双-(3-乙基)氧杂环丁烷红外光谱图
2.2 3,3-(氧基双亚甲基)-双-(3-乙基)氧杂环丁烷的固化机理
将单体3-(氧基双亚甲基)-双-(3-乙基)氧杂环丁烷(OXT 221)或3,3-乙基-3-(2-乙基己氧基甲基)氧杂环丁烷(OXT212)和3%~5%(单体的质量分数,下同)的光引发剂UVI 6976搅拌器搅拌,配制成均匀无色液体.然后将该液体涂覆在玻璃片上,用355 nm激光下扫描固化.观察氧杂环丁烷的红外吸收强度的变化.
图4是OXT 221/UVI 6976(3.0%)紫外光固化前后的光谱图,2 963和2 867 cm-1分别是CH2中C—H的反对称伸缩振动峰和对称伸缩振动峰;1 462和1 375 cm-1分别是c—H的反对称变形振动峰和对称变形振动峰;1 112 cm-1为非四元环主链中C—O—C的伸缩振动峰,它与氧杂环丁烷基开环聚合后形成的C—O—C伸缩振动峰合并,形成1 103 cm-1的宽峰;981和827 cm-1分别是氧杂环丁烷四元环的反对称变形振动峰和对称变形振动峰.光固化后,可以观察到,981和827 cm-1两波峰下降很明显,说明氧杂环丁烷的四元环发生开环反应.可能的固化机理[10]见图5.
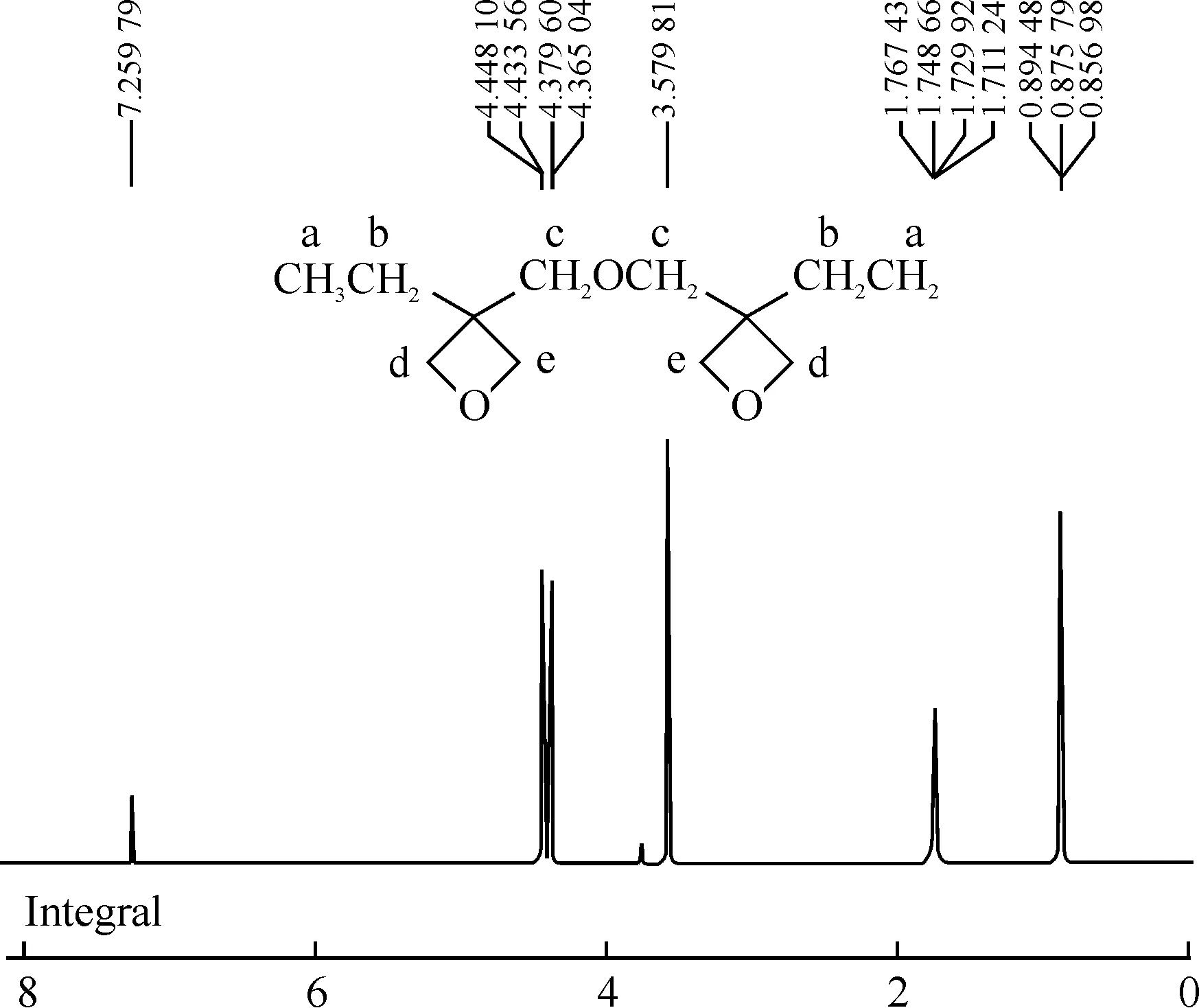
图3 3,3-(氧基双亚甲基)-双-(3-乙基)氧杂环丁烷核磁共振谱图
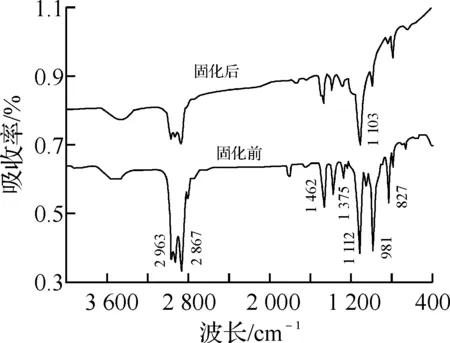
图4 3,3-(氧基双亚甲基)-双-(3-乙基)氧杂环丁烷固化前后的红外光谱图

图5 3,3-(氧基双亚甲基)-双-(3-乙基)氧杂环丁烷的固化机理
3 结 语
a.以三羟甲基丙烷,碳酸二乙酯为原料,经环化裂解,甲磺酰氯磺化化,氯化钠氯化得到3-乙基-3-氯甲基氧杂环丁烷,最后与3-乙基-3-羟甲基氧杂环丁烷醚化得到目的产物3,3-(氧基双亚甲基)-双-(3-乙基)氧杂环丁烷,总收率46.18%.
b.通过红外光谱和核磁共振图谱分析,3,3-(氧基双亚甲基)-双-(3-乙基)氧杂环丁烷的结构得到进一步的确证.
参考文献:
[1]Nobumasa S.Radiation-curable ink compositions containing glycidyl compounds and method and apparatus for ink-jet recording using them:JP 2009108235[P].2009-05-21.
[2]Masahiro U,Katsuyuki T,Takahiko K.Stereolithography resin compositions and three-dimensional objects made therefrom:WO,2008115057[P].2008-09-25.
[3]Yuji H,Hiromichi K,Takeo T.Stereoselective zirconocene-mediated ring transformation of 2-vinylheterocycles to vinylcarbocycles[J].Heterocycles,2004,62:297-311.
[4]Laurence M,Loiec M,Carole C,et al.Photocurable compositions for preparing ABS-like articles:WO,2008110512[P].2008-09-18.
[5]Lund U A,Rehnberg N,Perstorp.Process for production of an oxetane:US,6515152[P].2003-05-04.
[6]Pattison D B.Cyclic ethers made by pyrolysis of carbonate esters[J].J Am Chem Soc,1957,79(13):3455-3456.
[7]Tadakazu I,Hiroshi S,Akira K.Manufacture of bis(3-alkyloxetan-3-ylmethyl)ethers:JP,2000086646[P].2000-03-28.
[8]Hisao K,Tadakazu I,Akira K.Preparation of ethers from3-alkyl-3-hydroxy-methyloxetane without using phase-transfer catalysts:JP,2002138084[P].2000-11-01.
[9]Nobuaki K,Tadakazu I.Preparation of oxetane ethers from halides and alcohols:JP,2003267961[P].2003-09-25.
[10]刘海涛,莫健华,刘厚才.氧杂环丁烷光固化动力学研究[J].华中科技大学学报:自然科学版,2008,36(11):129-132.

