雪旺细胞促进大鼠骨髓间充质干细胞分化为神经元样细胞的效应研究
智晓东,吕刚
(辽宁医学院 附属第一医院骨外科,辽宁 锦州 121001)
骨髓来源的间充质干细胞(mesenchymal stems cells,MSC)是一种具有多向分化潜能的干细胞,以其多胚层分化、低免疫原性、取材方便、容易扩增等优点,成为众多干细胞当中最受青睐的一个。近年来,将其分化为肝细胞[1]、心肌细胞[2]、成骨细胞[3]等的研究层出不穷。神经元以其不可再生性,使得恢复其功能难度很大。因而,研究者们渴望通过一种较好的方法诱导分化MSC为神经元样细胞[4],以修复损伤的神经元,恢复其功能。到目前为止,诱导分化的方法大致分3种,应用化学药物[5]、生物制剂[6]或者基因转染[7]。然而,至今仍没有取得理想的效果。本研究应用雪旺细胞与MSC细胞共培养,对于雪旺细胞是否可以促进MSC分化为神经元样细胞作一探讨。
1 材料与方法
1.1 主要仪器及试剂
SD大鼠购置于辽宁医学院实验动物中心,荧光显微镜(德国Carl Zeiss公司)。小鼠Brdu抗体和Brdu购置于Sigma公司,FITC标记兔抗小鼠IgG抗体购置于北京中杉金桥有限公司,兔抗大鼠CD44、CD45抗体购置于博士德,兔抗大鼠NSE、S-100蛋白抗体购置博士德,DMEM、胎牛血清购置于美国Gibco公司,Ⅱ型胶原酶购置于Sigma公司。
1.2 SD大鼠骨髓间充质干细胞的分离和培养
取1只4~6周正常SD大鼠的股骨和胫骨,用PBS洗净,去掉干骺端,用1 ml无菌注射器,吸取1 ml筛选培养基[含2 mmol/L的L-谷氨酰胺、1%青霉素和1%链霉素、9%胎牛血清(fetal bovine serum,FBS)和 9%马血清(horse serum,HS)的低糖DMEM],冲出骨髓,每只鼠的骨髓吹打均匀后,静置5 min,以2×106/ml接种到25 cm2培养瓶内,于 37℃、5%CO2培养箱中培养,24~48 h后,换液,弃去未贴壁细胞,PBS洗3次,每3~4 d换液1次,待细胞90%融合后用0.25%的胰酶和0.02%EDTA消化3~5 min传代,含血清的培养基终止消化,1 000 rpm,5 min离心,收集细胞1∶2传代,用扩增培养基(含2 mmol/L的L-谷氨酰胺、1%青霉素和1%链霉素、9%FBS和9%HS的IMDM)再培养,记作一代,取二、三代细胞做诱导分化。
1.3 大鼠骨髓间充质干细胞的鉴定
取2~3代的大鼠骨髓间充质干细胞以2×105/ml接种于6孔板的盖玻片上,放置于37℃、5%CO2培养箱中培养。24 h后取出6孔板,PBS漂洗3次,加入4%甲醛固定 30 min,0.1%TritonX-100通透 20 min,PBS漂洗3次,每次5 min,加入1%BSA常温封闭 30 min。加入兔抗鼠 CD44、CD45抗体(1∶100)孵育过夜,PBS漂洗3次,每次5 min,加入FITC标记抗兔IgG抗体,常温孵育30 min,90%甘油封片,荧光显微镜观察,照像。
1.4 雪旺细胞的分离和培养
取SD大鼠3只,用10%水合氯醛腹腔注射麻醉(30 mg/kg),剪下坐骨神经,D-Hank′s液漂洗3次,加入0.25%胰酶和0.2%的胶原酶混合消化37℃,50 min,每5 min震荡1次。完全培养基终止消化,1 000 r/min离心5 min。用完全培养基(含2 mmol/L的L-谷氨酰胺、1%青霉素和1%链霉素、15%胎牛血清的DMEM)以8×105/ml接种于25 cm2培养瓶中。每3~4 d更换1次培养基。当细胞80%融合时,用0.25%的胰酶和0.02%EDTA,消化3~5 min传代。然后细胞1∶2重新接种,传代。鉴定后用第3代的细胞做共培养诱导。
1.5 雪旺细胞的鉴定
消化收集培养的雪旺细胞,将细胞以2×105/ml接种于6孔板的盖玻片上,24 h后,用PBS漂洗,4%甲醛固定,30 min,0.1%TritonX-100 通透 20 min,PBS漂洗3次,每次5 min,加入1%BSA常温封闭30 min。加入兔抗鼠S-100蛋白抗体,PBS漂洗,加入FITC标记抗兔IgG抗体,常温孵育30 min,90%甘油封片,荧光显微镜观察,照像。
1.6 雪旺细胞与MSC细胞共培养
取MSC细胞用10μmol/L的Brdu脉冲标记1 h,PBS漂洗,消化收集,用DMEM/F12悬浮,与雪旺细胞1∶1混合,均以1×105/ml加入含有盖玻片的6孔板。每3~4 d天换1次液,10 d后,观察细胞形态变化、照像。
1.7 诱导分化后的神经元样细胞鉴定
1.7.1 免疫细胞化学检测NSE和Brdu表达:用PBS漂洗3次培养板,4%甲醛固定,30 min,0.1%TritonX-100通透 30 min,PBS漂洗 3次,每次 5 min,加入1%BSA常温封闭30 min。加入兔抗鼠NSE抗体和鼠抗Brdu抗体(1∶100稀释),PBS漂洗,加入FITC标记抗兔IgG抗体和罗丹明标记抗鼠抗体(1∶200稀释),常温孵育30min,90%甘油封片,荧光显微镜观察,照像,用NSE/Brdu(%)计数分化率。
1.7.2 形态学观察测定神经突触长度:随机选择两个细胞集落,测量10个神经元样细胞突出长度。比较MSC和神经元样细胞差别。
1.7.3 免疫印迹检测NeuN的表达:将细胞样品用TBS漂洗后加入RIPA缓冲液(1%NP-40、0.5%脱氧胆酸钠、1%SDS、0.1%PMSF)裂解细胞,考马斯亮蓝法测定蛋白质浓度。加热变性,SDS-聚丙烯酰胺凝胶电泳,转膜,5%脱脂奶粉封闭过夜,加入1∶1 000稀释的一抗杂交2 h,TBST洗膜后加入二抗温育1 h,TBST洗膜后进行BCIP/NBT显色,采用Chemigenius凝胶成像系统分析目的蛋白的表达量。betaactin为内参。
1.8 统计学分析
采用SPSS13.0统计软件分析所有数据,数据用x±s表示,采用t检验统计方法,P<0.05为差异有统计学意义。
2 结果
2.1 细胞培养及鉴定(图1,2)
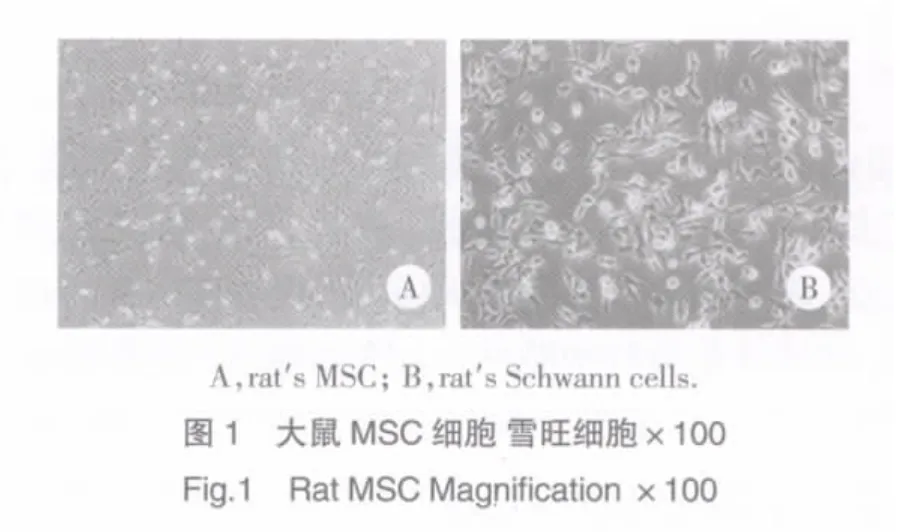

形态学观察显示,图2A为MSC细胞CD45的表达,图中染成绿色的即是细胞CD45;图2B为雪旺细胞S-100表达情况,可见细胞质被染成绿色。
2.2 雪旺细胞对MSC分化为神经元样细胞的影响
2.2.1 形态学观察:MSC细胞与雪旺细胞共同培养10 d后可见雪旺细胞与MSC细胞可以共生,并且雪旺细胞在MSC集落旁边,MSC分化的神经元样细胞,呈放射状排列,细胞变成长梭形,有突触样结构(图3)。
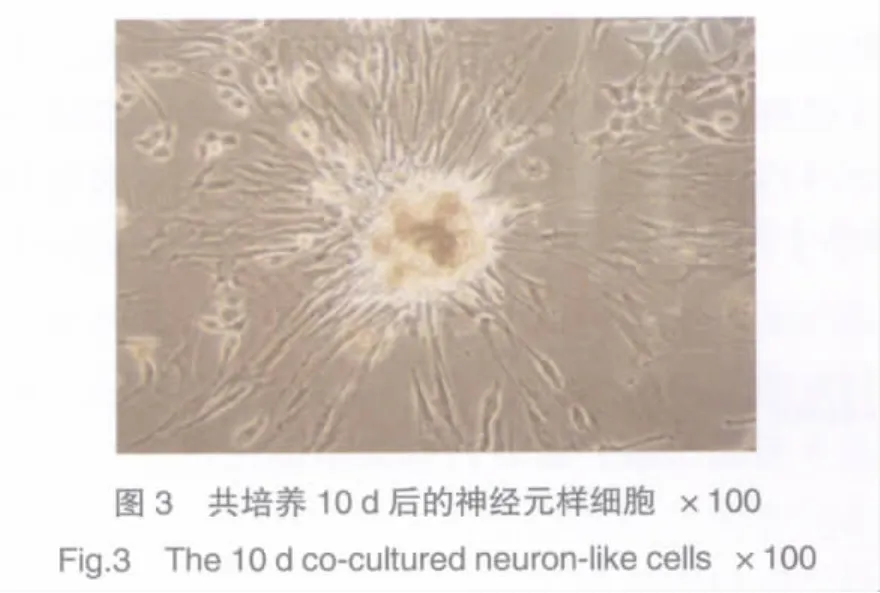
2.2.2 神经突触测量:可见共培养组细胞的长度为(12.18±0.92)μm,MSC 组的长度为(10.32±0.89)μm,二者比较差异有统计学意义(P<0.01)。
2.2.3 NSE免疫荧光结果:共培养10 d后,分化后的神经元样细胞免疫荧光染色显示NSE与Brdu的表达情况如图4所示,标记了Brdu的MSC细胞被染成红色,位于细胞核内,NSE用绿色荧光表示,位于细胞质内。细胞同时表达NSE和Brdu的为成功分化的神经元样细胞,而对照组MSC细胞中,NSE表达弱,并且阳性细胞很少。雪旺细胞共培养组的神经元样细胞诱导分化率较高为(80.51±5.65)%;而对照组MSC细胞的分化率较低,为(58.99±6.62)%。二者之间差异有统计学意义(P<0.01)。

2.2.4 NeuN免疫细胞化学结果:由图5可见,共培养后的细胞表达NeuN而MSC细胞不表达,雪旺细胞弱表达。
3 讨论

骨髓间充质干细胞是一种多向分化潜能的干细胞,近年来将其诱导分化为各种细胞的研究颇多[8~11]。到目前为止,还没有一种方法取得了很好的效果。Pittenger等[12]的1999年报道化学诱导方法出现典型神经细胞形态的比率为(86.8±2.7)%,但神经细胞存活时间较短,2006年Choi等分析经RA诱导分化3 h后形态神经元化的细胞,发现神经元标志的表达虽在3 h后明显增加,但24 h后即下降[13];基因转染[14]方法能够获得纯度较好,细胞功能稳定的细胞,然而由于其技术要求高,复杂程度高,尤其是其长期效应不清等原因难以广泛应用实施;生物诱导剂方法毒性小,效果比较好,之前的研究认为,若想定向分化干细胞,常用目的细胞的成分来分化[15~17],关于应用周围神经细胞诱导MSC分化位神经元样细胞的研究尚未见报道。
本研究结果显示,共培养10 d后的MSC集落周围的细胞明显变长,突触明显变长,细胞形态与MSC明显不同(P<0.05)。经NSE/Brdu染色发现,分化后的细胞(神经元样细胞)胞质内明显有NSE表达,阳性率远高于MSC细胞(P<0.01)。蛋白印迹结果显示诱导分化后的神经元样细胞内NeuN的表达明显高于MSC细胞。NeuN是神经元的特异性标志物,经共培养后的MSC细胞能够表达NeuN说明MSC可以经雪旺细胞共培养而分化为神经元样细胞。从形态学与NSE、NeuN染色可见,将MSC细胞与雪旺细胞共培养可以使MSC细胞分化为神经元样细胞,即雪旺细胞作为一种支持营养的细胞,是可以诱导MSC细胞分化为神经元样细胞的。因此,我们认为可能是由于雪旺细胞在骨髓间充质干细胞周围起到了神经元生存的微环境作用,或者是支持营养等,以此促进骨髓间充质干细胞分化为神经元样细胞。
综上所述,雪旺细胞可以促进骨髓间充质干细胞分化为神经元样细胞。本研究可望为干细胞的诱导分化提供一个较好的方法,为干细胞诱导分化的基础研究提供一个新思路。
[1]Lue J,Lin G,Ning H,et al.Transdifferentiation of adipose-derived stemcellsintohepatocytes:anewapproach[J].Liver Int,2010,30(6):913-922.
[2]Hida N,Nishiyama N,Miyoshi S,et al.Novel cardiac precursor-like cells from human menstrual blood-derived mesenchymal cells[J].Stem Cells,2008,26(7):1695-1704.
[3]Oki Y,Watanabe S,Endo T,et al.Matureadipocyte-derived dedifferentiated fat cells can trans-differentiate into osteoblasts in vitro and in vivo only by all-trans retinoic acid[J].Cell Struct Funct,2008,33(2):211-222.
[4]Sanchez-Ramos J,Song S,Cardozo-Pelaez F,et al.Adult bone marrow stromal cellsdifferentiate intoneural cellsin vitro[J].Exp Neurol,2000,164(2):247-256.
[5]邢莹,景莹,杨红旗,等.兔骨髓间充质干细胞向神经元的诱导分化[J].河南医学研究,2004,13(2):103-105.
[6]谷艳娇,李博,高志安.大鼠骨髓间充质干细胞体外向神经元样细胞的诱导[J].中国组织工程研究与临床康复,2010,14(14):2481-2484.
[7]姜传涛,杨秋慧,刘玉军,等.成年大鼠及猴骨髓基质细胞的体外培养及向神经元的分化诱导[J].神经解剖学杂志,2003,19(1):56-60.
[8]Yang J,Lou Q,Huang R,et al.Dorsal root ganglion neurons induce transdifferentiation of mesenchymal stem cells along a Schwann cell lineage[J].Neurosci Lett,2008,445(3):246-251.
[9]Johnson KA,Yao W,Lane NE,et al.Vanin-1 pantetheinase drives increasedchondrogenicpotentialofmesenchymalprecursorsinank/ank mice[J].Am JPathol,2008,172(2):440-453.
[10]Moonen JR,Krenning G,Brinker MG,et al.Endothelial progenitor cells give rise to pro-angiogenic smooth muscle-like progeny[J].Cardiovasc Res,2010,86(3):506-515.
[11]Song L,Tuan RS.Transdifferentiation potential of human mesenchymal stemcellsderived frombonemarrow[J].FASEBJ,2004,18(9):980-982.
[12]Pittenger MF,Mackay AM,Beck SC,et a1.Muhilineage potential of adulthumanmesenehymal stemcells[J].Science,1999,284(5411):143-l47.
[13]Choi CB,Cho YK,Prakash KV,et a1.Analysisof neuron-likedifferentiation of human bone marrow mesenchymal stem cells[J].Biochem Biophys Res Commun,2006,350(1):138-146.
[14]沈峰,潘庆刚,邓东风,等.GDNF基因转染诱导神经干细胞向神经元分化的作用[J].同济大学学报(医学版),2007,28(5):35-39.
[15]Choi KS,Shin JS,Lee JJ,et al.In vitro trans-differentiation of rat mesenchymal cellsintoinsulin-producingcellsby rat pancreatic extract[J].BiochemBiophys Res Commun,2005,330(4):1299-1305.
[16]李宏丹,穆长征.体外应用大鼠胰腺提取物诱导小鼠间充质干细胞为胰岛素产生细胞[J].解剖学报,2009,40(5)789-793.
[17]Karnieli O,Izhar-Prato Y,Bulvik S,et al.Generation of insulin-producing cells from human bone marrow mesenchymal stem cells by genetic manipulation[J].Stem Cells,2007,25(11):2837-2844.

