黄麻染色体制备若干方法比较研究
陈 涛,徐建堂,陈燕萍,陈富成,祁建民
(福建农林大学作物遗传育种与综合利用教育部重点实验室,福州 350002)
黄麻(jute)为椴树科(Tiliaceace)黄麻属(Corchorus)一年生韧皮纤维作物,是世界上最重要的纤维作物之一,也是我国重要的特色经济作物。黄麻纤维具有产量高、纤维质地柔软、易染色、抗静电、抑菌、可降解等优良特点[1][2]。作为遗传物质的载体,染色体在植物种类鉴定、系统分类、遗传学、进化和迁移等相关研究中起重要作用[3],且能够为深入探讨植物的起源、染色体水平的遗传变异及其进化机制等提供科学依据[4],因此获得清晰的黄麻中期染色体图像,是进行黄麻核型分析等研究的关键。国内外有关黄麻属染色体和核型系统分析的报道较少,Banerjee等首先报道了黄麻属圆果种(C.capsularis L.)、长果种(C.olitoritus L.)和C.acutangulus这三个种的单倍染色体数为7[5],黄麻染色体很小,属于小染色体类[6],对制片要求较高。随着细胞生物学技术的发展,本研究以圆果黄麻179为材料,比较了不同预处理条件下去壁低渗涂片法、去壁低渗悬液法、预先固定去壁低渗涂片法、不同酸解时间下的酸解离常规压片法的制片效果,试图找到最适合黄麻的中期分裂相清晰的染色体制备方法。
1 材料和方法
1.1 材料
供试材料为圆果黄麻179品种,将少量种子用0.1%HgCl2溶液消毒10min,在清水中浸种过夜,放入底部垫有滤纸的培养皿中于28℃催芽。待根长至1.5cm左右时,取其距顶端3mm左右的根尖进行预处理。
1.2 试验方法
1.2.1 不同预处理条件下的去壁低渗涂片法
参考李懋学方法[7],将取下的黄麻179的根尖分别置于0.002mol.L-1 8-羟基喹啉溶液和0.2%的秋水仙素溶液的玻瓶中,前者浸泡3.5小时,后者浸泡2小时进行预处理,温度都保持在10℃-15℃。分别去掉预处理液,用0.075mol.L-1 KCl低渗液浸没材料,25℃下处理30min进行前低渗。倒去KCl溶液,用蒸馏水充分洗净,加入混合酶(纤维素酶与果胶酶各占2.5%),26℃下酶解2小时。回收酶液,用蒸馏水分别慢洗3次,在25℃双蒸馏水中停留10min进行后低渗处理。将后低渗的材料用卡诺固定液在10-15℃下固定20小时以上。分别取3个固定后的根尖材料置于预先洗净、冷冻的载玻片上,滴1滴卡诺固定液,并用镊子敲碎涂抹,去掉大块组织残渣,在酒精灯火焰上掠过3次左右,使其干燥。将载玻片置于Giemsa染色液中25℃下染色4个小时以上,蒸馏水冲洗,空气干燥后即可油镜镜检,选择分散良好、清晰的中期染色体再进行显微拍照。
1.2.2 去壁低渗悬液法
参考陈瑞阳方法[8],将根尖用0.002mol.L-1 8-羟基喹啉溶液浸泡3.5小时作预处理,温度保持在10℃-15℃。然后进行前低渗、酶解去壁、后低渗处理,方法同1.2.1。倒去后低渗的双蒸水,用镊子将材料挟碎、搅拌,形成细胞悬液。再向黄麻179根尖细胞悬液加入适量卡诺固定液,10-15℃下静置固定30min,吸取上层细胞悬液,去除大块组织沉淀。将上层细胞悬液静置25min,细胞沉淀后,轻轻地吸去上清液,留1mL左右细胞悬液为染色体标本滴片备用。取一张预先洗净并冷冻的清洁载玻片,滴2-3滴细胞悬液滴在玻片上,立即将玻片一端抬起,并轻轻吹气,使细胞迅速分散,然后在酒精灯火焰上掠过3次左右,使其干燥。最后Giemsa染色、镜检过程的方法同1.2.1。
1.2.3 预先固定的去壁低渗涂片法
将根尖用0.002mol.L-1 8-羟基喹啉溶液浸泡3.5小时作预处理,温度保持在10℃-15℃。双蒸水洗净后用新鲜的卡诺固定液,在10-15℃下固定20小时以上。接下来的前低渗、酶解去壁、后低渗、涂片、Giemsa染色、镜检等步骤方法同1.2.1。
1.2.4 不同酸解时间下的酸解离常规压片法
参考王春台方法[9],将根尖用0.002mol.L-1 8-羟基喹啉溶液浸泡3.5小时作预处理,温度保持在10℃-15℃。双蒸水洗净后用新鲜的卡诺固定液固定20小时以上,温度以10-15℃为宜。倒去固定液,用蒸馏水洗3次。将根尖分成三份,再放入预热的1 mol.L-1盐酸中,60℃水浴中分别解离6min、8.5min、11min,然后分别用双蒸水漂洗3次,每次5min。分别将根尖放于洁净、冰冷的载玻片上滴加改良的石碳酸品红染色,25℃染色2小时,盖上盖玻片,用镊子轻轻敲打盖玻片,然后用滤纸吸去多余染液,用铅笔的橡皮头敲打,使细胞分散。最后镜检、显微拍照。
2 结果与分析
2.1 不同预处理方法对染色体制片效果的影响
在1.2.1实验中,采用不同预处理方法,其他实验步骤相同的条件下,对制片效果进行比较(见图1),图1A为根尖用0.2%的秋水仙素溶液进行预处理下的中期分裂相,染色体比较小,有收缩,边缘模糊,缢痕不清晰,核型分析效果较差。图1B为根尖用0.002mol.L-18-羟基喹啉溶液进行预处理下的中期分裂图像,染色体较大,背景清晰,缢痕明显,分散度适当,可作为核型分析。故在后续试验中均用0.002mol.L-18-羟基喹啉溶液进行预处理。
2.2 去壁低渗法中涂片法与细胞悬液滴片法的制片效果
图2A和2B为都为细胞悬液滴片法处理下黄麻179染色体中期分裂图像,相对于涂片法得到的图1B,细胞悬液滴片法会使染色体分散度太大,可能造成染色体丢失。在挟碎细胞时可能会损毁染色体(如图2B),而且使细胞碎片过多,图像背景不清晰。比较可知,去壁低渗法中涂片比细胞悬液滴片的制片效果要好。
2.3 去壁低渗法中材料固定先后对制片效果的影响
图3A和3B都为用预先固定的去壁低渗涂片法制得的黄麻179染色体中期分裂图像,相对于采用后固定的去壁低渗涂片法制得的中期分裂图像图1B,图3A和图3B中的染色体分散程度太低,染色体粘在一起,核型分析效果相对较差。比较可知去壁低渗法中材料后固定比预先固定的制片效果要好。
2.4 不同酸解时间对制片效果的影响
图4A为酸解5min的黄麻179染色体中期分裂图像,染色体模糊,分散程度太低,染色过浅。图4B为酸解8.5min的黄麻179染色体中期分裂图像,染色体比较清晰,缢痕清晰,分散度适当,背景清晰,可用于核型分析。图4C酸解11min的黄麻179染色体中期分裂图像,染色体已发生形变,大小不均匀,染色深浅不一。比较可知。酸解时间为8.5min时染色体制片效果较好。
3 讨论
麻类染色体普遍较小,中期染色体通常在0.5-1.5 μm之间[10],如此小的黄麻染色体要获得比较好的中期分裂图像,就必须做到染色体分散程度高,染色体不能收缩,背景要清晰。

图1 用秋水仙素溶液(图1A)和8-羟基喹啉溶液(图1B)作预处理的中期分裂图像Fig.1 Chromosomeinmetaphasestagepretreatedbycolchicinesolution(Fig.1A)and8-hydroxyquinolinesolution(Fig.1B)

图2 图2A、2B均为细胞悬液滴片法处理下黄麻179染色体中期分裂图像Fig.2 The jute 179 chromosome in metaphase stage treated bycell hypotonic suspension method

图3 图3A、3B均为预先固定的去壁低渗涂片法制的黄麻179染色体中期分裂图像Fig.3 Thejute179chromosomeinmetaphasestagetreatedbypre-fixedwalldegradationhypotonicsmearmethod
实验过程中发现使用秋水仙素预处理时,浓度和处理时间要控制得当,若秋水仙素浓度过低,就难以获得较多的中期分裂相;若秋水仙素的使用浓度过高或处理时间太长,可能会引起染色体收缩成粒状或短棒状,影响制片效果。而8-羟基喹啉最大的优点就是显示缢痕、随体清晰[11],也不致引起染色体的粘连,本实验也验证了这一点。后固定的去壁低渗法因是活体原生质,半渗透性好,吸水速度快,染色体因低渗作用而分散到细胞质内,所以染色体分散程度比较高,容易获得比较好的染色体图象。而先固定的去壁低渗法细胞固定后使细胞质失去半渗透性,染色体难以随低渗作用分散到细胞质内,所以在低渗吸水的时间需要很长的才会使细胞软化膨胀,染色体分散的效果不是很好。去壁低渗中的涂片法比悬液法操作简单,且能更容易找到中期分裂相,背景也较清晰,而实验过程中悬液法需要的根尖材料比较多,挟碎过程中可能会损坏染色体。从本实验结果来看,8-羟基喹啉处理下的后固定去壁低渗涂片法,相对其他的去壁低渗法制得的图片效果更好,但实验过程中酶解时间的控制是关键,需不断摸索优化。
酸解离常规压片法比去壁低渗法操作上更简便,时间更短,关键是酸解时间的控制。若盐酸解离时间太短,染色不清晰,细胞质也染上深浅不同的颜色;若处理时间过长,染色体染色极淡或不染色。这可能与酸解不够,醛基暴露不充分有关,而呈现染色过浅。酸解过度,则使DNA完全解聚,糖与醛基之间的键被破坏,流离的核酸分子会扩散到细胞质中,从而使染色浅或不均一[12]。本实验发现酸解8.5min时制得的黄麻179染色体中期分裂图像效果比较好。
通过比较这4种方法制得的中期图片,笔者认为酸解离常规压片法最适合制备黄麻染色体中期图片,此法制得的图片效果较好、分散度适当、缢痕清晰、形态良好、背景清楚,且此法操作比较简单,快捷。黄麻属于小染色体类,要获得形态良好、分散适当、着丝点清晰的染色体图进行核型分析,难度比较大,还需要不断优化制片技术,以求获得更完美的染色体中期分裂图像。
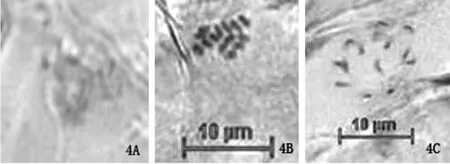
图4 酸解6min(图4A)、8.5min(图4B)、11min(图4C)的黄麻179染色体中期分裂图像Fig.4 The jute 179 chromosome in metaphase stage byacid dissolution 6 minutes,8.5 minutes and 11 minutes respectively
[1] 祁建民,李维民,吴为人.黄麻的起源与进化研究[J].作物学报,1997,23(6):678-679.
[2] 熊和平.麻类作物育种学[M].北京:中国农业科学技术出版社,2008.
[3] STANCECA.Cytology and cytogenetics as fundmental taxomomic resources for 20th and 21st centuries[J].Taxon ,2000,49:451-477.
[4] 洪德元.中国和日本产竹叶子(亚种)核型的一致性[J].植物分类学报,1986,24(4):264-267.
[5]Banerjee,I.Chromosome number ofIndian crop plants.A.Chromosome numbers in jute[J].Indian Bot.Soc.11:82-85.1932a.
[6] 谢小芳,黄代青,吴为人.长果种黄麻单染色体未克隆DNA文库的构建[J].作物学报,2006,32(8):1184-1187.
[7] 李懋学,张赞平.作物染色体及其研究技术[M].北京:中国农业出版社,1996.
[8] 陈瑞阳,宋文芹,李秀兰.植物染色体标本制备的去壁低渗法及其在细胞遗传学中的意义 [J].遗传学报,1982,9(2):151-159.
[9] 王春台.图解现代遗传学实验[M].北京:化学工业出版社,2009.
[10] 朱凤绥,何广文,肖瑞芝,李树川,田自强,程尧楚.麻类作物染色体组型分析及Giemsa带型初步观察[J].中国麻作,1981,(3):1-9.
[11] 朱徵.植物染色体及染色体技术[M].北京:科学出版社,1982.
[12] 卢笼斗,常重杰.遗传学实验技术[M].北京:科学出版社,2007.

