西罗莫司单层高分子渗透泵控释片的制备及其体外释放特性研究Δ
王娟,张晶,宋洪涛#,唐星,何仲贵
(1.南京军区福州总医院药学科,福州市 350025;2.沈阳药科大学药学院,沈阳市 110016)
西罗莫司(Sirolimus,SRL)作为第3代免疫抑制剂,是迄今为止发现的毒性较小的新型强效免疫抑制剂,其正成为肾移植患者长期免疫抑制治疗的基本药物[1,2]。临床主要用于抗器官移植抗排斥作用和治疗类风湿性关节炎、红斑狼疮、牛皮癣等自身免疫性疾病,其免疫抑制作用比环孢素强100倍,比他克莫司强30倍[3,4]。但由于其治疗窗窄[5],高甘油三酯血症、高胆固醇血症等不良反应发生率高,使其临床应用受限。因此,本课题拟研究制备SRL控释制剂,以减小其用药后导致的血药浓度波动,使药物能够更安全、有效地应用于临床。
渗透泵是迄今为止口服控释制剂中释药特性最为理想的一种。目前研究难溶性药物的渗透泵片主要有2种:双层渗透泵片与单层高分子渗透泵片。由于双层渗透泵片在生产中需快速、准确地辨识药物层后再打释药孔,设备智能化要求高,难以实现工业化。因此本试验选择制备SRL单层高分子渗透泵片。
1 仪器与试药
BS124S电子天平(德国Sartorius公司);PHS-3C精密pH计(上海雷磁科学仪器公司);HP1100高效液相色谱系统(二级管阵列检测器,美国Agilent公司);TDP-5A型单冲压片机(上海天凡药机制造厂);BY300A小型包衣机、YPD-200C型片剂硬度仪、RCZ-6BZ型药物溶出度仪均由上海黄海药检仪器有限公司提供。
SRL对照品(含量:99.9%)、SRL原料药(批号:060702,含量:99.5%)均由福建科瑞药业有限公司提供;SRL单层高分子渗透泵控释片(南京军区福州总医院自制,规格:每片1 mg);十二烷基硫酸钠(SDS,诸暨丰盈化工有限公司);聚氧乙烯(PEO,美国Dow公司);乳糖(Lactose,美国MEGGLE公司);甘露醇(Mannitol)、氯化钠(NaCl)、醋酸纤维素(CA)、聚乙二醇(PEG400、PEG4000)均由国药集团化学试剂有限公司提供;乙腈、甲醇为色谱纯;其余试剂均为分析纯。
2 方法与结果
2.1 体外释放度测定方法
2.1.1 色谱条件。色谱柱:Zorbax SB-C8(150 mm×4.6 mm,5 μm);流动相:甲醇-水-乙腈(30∶30∶40);流速:1 mL·min-1;检测波长:277 nm;柱温:50 ℃;进样量:20 μL。以SRL峰计理论板数为1998,分离度为3.13。
2.1.2 释放介质的选择。难溶性药物进行体外释放度测定试验时,为保证释放的漏槽状态,常加入一定浓度的表面活性剂。由溶解度试验测定结果可知,SRL在0.1%~0.5%SDS溶液中溶解度较高,均能够达到漏槽条件,但参考已上市的SRL纳米结晶片的质量标准,笔者选择0.4%SDS溶液为释放介质。
2.1.3 线性关系考察。精密称取SRL对照品5.0 mg,置于50 mL容量瓶中,加无水乙醇溶解并定容,得浓度为100 μg·mL-1贮备液。精密量取贮备液适量加0.4%SDS溶液稀释成浓度分别为0.1、0.2、0.5、1、2、5、10 μg·mL-1的对照品溶液。按“2.1.1”项下条件进样20 µL,记录峰面积,以浓度(X,µg·mL-1)为横坐标,峰面积(Y)为纵坐标进行线性回归,得回归方程为:Y=56.74X-0.3824(r=0.9996)。结果表明,SRL检测浓度的线性范围为0.1~10µg·mL-1。经考察,该方法的精密度结果为为0.74%,回收率为(98.3±0.81)%、RSD=0.83%,24 h稳定性性好(RSD=1.39%),均符合规定。
2.1.4 释放度测定方法。取样品6片,装入沉降篮中,按2005年版《中国药典》(二部)释放度测定法(附录ⅩD第三法),采用溶出度测定法(2005年版《中国药典》(二部)附录ⅩC第三法)的装置,以0.4%SDS溶液250 mL为溶出介质,转速100 r·min-1。在1、2、4、6、8、10、12 h分别取溶液5 mL,用0.45 μm微孔滤膜滤过,并及时在操作容器中补充空白介质溶液5 mL,分别精密量取续滤液适量,进样20 μL测定;另精密称取SRL对照品适量,用上述溶出介质制成2.0 μg·mL-1的对照品溶液,同法测定,分别计算不同时间内SRL累积释放度,绘制溶出曲线。
2.2 样品制备工艺
2.2.1 SRL固体分散体的制备。为了提高SRL的溶解度,改善其在缓释制剂中的溶出度,本课题前期研究了SRL的固体分散体。以SRL 10倍量的泊洛沙姆188(F68)为载体,先将SRL溶解于适量的乙醇溶液中,待F68加热至熔融后,混匀,剧烈搅拌并将熔融物倾倒在不锈钢板上形成薄层,使之迅速冷却成固体,再将此固体置于真空干燥箱内24 h,取出,研磨,过80目筛备用。
2.2.2 制备片芯。先将PEO、促渗剂分别粉碎过80目筛,称取处方量的SRL固体分散体及其它辅料采用等量递加法混合均匀,采用7.5 mm冲模直接压片(药物剂量为每片1 mg,硬度约为50 N),即得每片含SRL 1 mg的片芯。
2.2.3 包衣。将CA、PEG溶于丙酮-水(95∶5,V/V)中,即得包衣溶液。将片芯置于包衣锅内,在温度40℃、包衣液输入速度7.0~10.0 r·min-1、压力0.6~0.8 MPa条件下进行包衣操作,直至衣膜增重达到预定要求为止。在40℃下干燥24 h,然后在片剂表面打一释药小孔,即得SRL单层高分子渗透泵控释片。
2.3 处方筛选单因素考察
影响单层高分子渗透泵控释片释药行为的因素有很多,为简化试验,本研究在固定包衣工艺参数的条件下,对片芯组成、片芯制备工艺和包衣膜组成对制剂释药行为的影响进行了考察,并采用相似因子(f2)进行相似性判定(f2值越接近100,相似程度越高;f2值介于50~100之间,释药行为无显著性差异;f2值小于50时,则认为释药行为有显著性差异)。
基本处方暂定如下:
片芯组成:SRL固体分散体(含SRL 9%)1.1 g,PEO 3.0 g,乳糖 8.5 g,硬脂酸镁 0.07 g。包衣液组成:CA 1.0 g,PEG4000.15 g,丙酮-水(95∶5)100 mL。共制100片(衣膜增重为10 mg)。
2.3.1 PEO分子量对药物释放的影响。难溶性药物SRL在片芯微环境内难以完全溶解释出,故加入低分子量PEO作为释药载体,以避免水化后SRL沉淀析出。试验中选择Mw20000、Mw30000、Mw400003种低分子量PEO,其余辅料组成见基本处方,按“2.2”项下方法制备控释片,考察PEO分子量对药物释放的影响。结果表明,不同分子量PEO对药物释放有显著性影响。随着分子量的增大,药物释放减慢。其中Mw20000既能达到良好的释药效果,又能有效避免释药过程中衣膜可能出现的膨胀变形现象。采用f2法进行相似性判定,结果见表1。

表1 自制片剂相似性分析Tab 1 Similarity analysis of self-prepared tablets
2.3.2 PEO用量对药物释放的影响。选用PEO Mw20000为释药载体,用量分别为20、30、40 mg,制备控释片,考察不同用量对药物释放的影响。结果表明,在考察范围内,PEO用量对药物释放无显著性影响。但随着PEO用量的增加,药物释放速率有减慢趋势。故选择PEO用量为30 mg。采用f2法进行相似性判定,结果见表1。
2.3.3 促渗剂种类对药物释放的影响。由于药物产生的渗透压较低,一般需加入促渗剂以产生足够渗透压来维持适宜的释药速率。选择乳糖、甘露醇、NaCl 3种不同促渗剂,其用量均为85 mg,制备控释片,考察促渗剂种类对药物释放的影响。结果表明,不同促渗剂对药物释放有影响,其释药速率快慢依次为NaCl>乳糖>甘露醇。故选择NaCl作为促渗剂。采用f2法进行相似性判定,结果见表1。
2.3.4 促渗剂用量对药物释放的影响。取NaCl用量分别为55、85、115 mg,制备控释片,考察不同用量的NaCl对药物释放的影响。结果表明,促渗剂用量对药物释放有显著性影响:随着NaCl用量的增加,药物释放速率加快。其中NaCl用量为115 mg时,释药过快;而用量为55、85 mg时释药效果均满足要求,故NaCl用量为55~85 mg。采用f2法进行相似性判定,结果见表1。
2.3.5 片剂硬度对药物释放的影响。在制片过程中由于机器及其他系统误差,片芯硬度可能在一定的范围内发生波动。试验中固定主药含量,PEO用量30 mg,NaCl用量85 mg,将片芯硬度控制在30、50、70 N 3个水平,制备控释片,考察不同片芯硬度对药物释放的影响,结果表明,在考察的范围内片芯硬度对释放无显著性影响,故将片芯硬度控制在约50 N。采用f2法进行相似性判定,结果见表1。
2.3.6 释药孔大小对药物释放的影响。释药孔的大小由半透膜的性质、厚度、药物分子大小及释放介质的黏度决定。要获得所需要的释药速率,必须选择适当的释药孔径。试验制备不同释药孔径的控释片,分别为0.6、0.8、1.0 mm,其余条件同“2.3.5”项,考察释药孔大小对药物释放的影响。结果表明,在考察的范围内释药孔大小对药物释放无显著性影响。故本试验选择释药孔径为1.0 mm。采用f2法进行相似性判定,结果见表1。
2.3.7 PEG分子量对药物释放的影响。CA单独使用形成的薄膜包衣往往机械性能差,较脆易断裂。为改进衣膜质量,常在包衣处方中添加增塑剂以提高包衣材料的成膜能力,增强包衣膜在室温时的柔韧性和抗撞击强度,改善衣膜对底物的黏附状态,以获得具有良好控释能力的包衣膜。参考相关文献[6],选择同时具有增塑剂和致孔剂作用的水溶性PEG,试验考察不同分子量PEG(400、4000)对药物释放的影响。结果表明,PEG分子量对药物释放有显著性影响:PEG分子量越大,释药速率越慢。故本试验选择PEG分子量为400。采用f2法进行相似性判定,结果见表1。
2.3.8 PEG400用量对药物释放的影响。选择相当于CA用量的5%、10%、15%的PEG400,制备控释片,考察不同PEG400用量对药物释放的影响。结果表明,PEG400用量对药物释放有显著性影响:随着PEG400用量的增大,释药速率明显加快。其中PEG400用量为15%时,释药过快,故选择PEG400用量为10%~15%。采用f2法进行相似性判定,结果见表1。
2.3.9 衣膜增重对药物释放的影响。由于衣膜较薄,无法直接测量其衣膜厚度,故本文采用衣膜增重法测定,方法如下:W=(W2-W1)/n,式中W为衣膜增重(mg),W1为包衣前n片片芯的重量(mg),W2为包衣后n片片剂的重量(mg)。
渗透泵的释药速率与包衣膜厚度关系密切。衣膜厚度应适中,膜过薄则牢度不够,一旦破裂,药物迅速倾泻而出,有可能引起药物过量的危险;膜过厚则难以将释药速率调整到产生持续有效血浓度的释药水平。选择衣膜增重分别为10、15、20 mg,制备控释片,考察衣膜增重对药物释放的影响,结果见图1。采用f2法进行相似性判定,结果见表1。
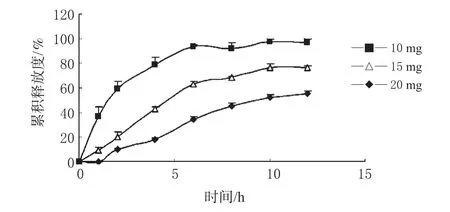
图1 衣膜增重对药物释放的影响(n=3)Fig 1 Effect of weight gain of coating film on drug release(n=3)
由图1可见,随着衣膜增重的增加,释药速率明显减慢。其中衣膜增重为20 mg时,释药过快,故选择衣膜增重为10~15 mg。
2.4 正交试验
2.4.1 正交试验设计。在单因素考察的基础上确定了进行正交试验的因素及其水平。固定主药含量,PEO用量为每片30 mg,片芯硬度约为50 N,释药孔径为1.0 mm。选择对药物释放影响较大的3个因素即NaCl用量(A)、衣膜增重(B)以及PEG400用量(C)作为影响因素,每个因素分为3个水平,详见表2。

表2 正交试验因素与水平Tab 2 Factors and levels of orthogonal experiment
2.4.2 评价指标的选择[7,8]。缓控释制剂的释放度评价指标有很多种,如:采用零级释放的相关系数作为评价指标;对试验数据进行模型拟合,再对得到的模型方程进行评价;其它如偏离度、相似因子等都可以作为缓控释制剂的释放度评价指标。本试验拟选用相关系数r为指标进行评价。评价方法如下:将各取样时间点内累积释放度与时间按零级释药方程进行拟合,以方程的r作为评价指标。公式为:Mt/M∞=kt,式中,Mt为t时刻的药物释放量,M∞为最大药物释放量,k是药物释放速度常数。最后采用直观分析的方法,对正交试验结果进行分析。
2.4.3 正交试验数据分析。具体试验结果及分析见表3。

表3 正交试验结果Tab 3 Results of orthogonal experiment
由表3可知,以r为指标时,各因素影响的大小次序为:B>C>A,最优处方为A2B2C2,即NaCl的用量为70 mg,衣膜增重为12 mg,PEG400的用量为CA用量的12%。
2.5 处方确定
制剂最终处方确定如下:
片芯组成:SRL固体分散体(含SRL 9%)1.1 g,PEO 3.00 g,NaCl 7.00 g,硬脂酸镁 0.07 g。包衣液组成:CA 1.20 g,PEG4000.14 g,丙酮-水(95∶5)100 mL。共制100片(衣膜增重为12 mg)。
按上述处方制备样品,其体外释药曲线见图2;并进行释药方程拟合,结果见表4。

图2 优化处方的体外释放曲线(n=6)Fig 2 Drug release curves in vitro of optimized formulation(n=6)

表4 释药曲线拟合方程表Tab 4 Fitting equations of drug release curve
由表4可知,本制剂体外释药方程更符合零级释放动力学方程(r=0.9954)。
3 讨论
3.1 片芯处方对释药的影响
一般认为单层渗透泵片的释药机制是渗透、溶胀共同作用机制,二者同等重要[9]。(1)药物及促渗剂(NaCl等)形成较大的渗透压,单层渗透泵片源源不断地从外部环境吸进水分;(2)在助悬剂(PEO等)的溶胀作用下,难溶性药物粉末形成稳定的混悬液,并从释药孔释放。由本试验结果也可以看到,助悬剂和促渗剂的加入对于药物的释放行为有显著性影响。
3.2 包衣膜处方对释药的影响
包衣膜因素包括衣膜对水分的通透系数、包衣膜厚度等。衣膜中加入亲水性高分子材料可以增加衣膜对水分的通透系数,从而增加释药速率。本试验结果表明,衣膜厚度增加会减小衣膜水分通透性,减小释药速度;亲水性高分子材料PEG400用量越大,药物释放越快。这可能是由于:(1)PEG400经沥出后能在衣膜中形成可供药物通过的孔道;(2)PEG400沥出后形成并不相通的孔道,相当于降低了衣膜的厚度,增加了衣膜对水的渗透性;(3)PEG400通过氢键等作用,增加了衣膜表面与水结合的活性部位,使衣膜的水合作用增强,改善衣膜的通透性,进而加速药物的释放。通过正交试验发现,衣膜厚度及性质是控制释药速率的主要因素。因此,对同一处方应严格控制好衣膜增重,以获得良好的重现性。
[1]朱 曼,郭代红.新型大环内酯类免疫抑制剂-西罗莫司[J].中国药物应用与监测,2005,2(6):26.
[2]Vignot S,Faivre S,Aguirre D,et al.mTOR-targeted herapy of cancer with rapamycin derivatives[J].Ann Oncol,2005,16(4):525.
[3]吴亚铭,陈 晓.新型免疫抑制剂——西罗莫司[J].天津药学,2003,15(2):72.
[4]江 红,程元荣,黄 捷,等.免疫抑制剂F904的免疫抑制作用[J].中国抗生素杂志,2000,25(5):382.
[5]王 娟,宋洪涛,周 欣,等.西罗莫司大鼠在体肠吸收动力学研究[J].中国药房,2009,20(1):27.
[6]刘龙孝,车斌杰,徐 清.阿替洛尔单层芯渗透泵片的制备[J].药学学报,2006,41(5):457.
[7]洪燕龙,冯 怡,徐德生.关于缓控释制剂的处方优化指标[J].中国中药杂志,2006,31(1):15.
[8]刘清飞,罗国安,王义明.缓控释制剂释放度相似性评价方法的应用进展[J].中国药学杂志,2006,41(15):1121.
[9]陈存香,李三鸣,李红菊,等.法莫替丁单室单层渗透泵片的制备[J].中国新药杂志,2007,16(13):1035.

