猪繁殖与呼吸综合征病毒TM株的分离鉴定及其Nsp2序列分析
邓雨修,招丽婵,苏润环,潘永飞,杨明柳,吴德铭,李春梅,宋延华
(广东温氏食品集团有限公司温氏研究院,广东 新兴 527400)
猪繁殖与呼吸综合征(Porcine reproductive and respiratory syndrome,PRRS)是由PRRS病毒(PRRSV)引起的一种严重危害养猪业的病毒性传染病,其临床症状主要表现为母猪繁殖障碍和仔猪呼吸系统疾病。该病自1987年美国首次报道以来,世界上很多国家都有相继报道[1-3]。郭宝清等于1996年首次在国内分离到PRRSV,证实了该病在中国的存在[4]。自2006年夏季以来,高致病性PRRSV变异株引起的PRRS的暴发与流行,给我国养猪业造成巨大的经济损失[5]。对分离的PRRSV全基因序列测序分析表明,病原的基因序列变化主要是在Nsp2区缺失了30个氨基酸,其中仅在一段基因序列中就连续缺失了29个氨基酸[6-8]。本研究在临床流行病学研究的基础上,分离病毒,经基因序列分析及人工猪体感染发病试验,鉴定为新缺失表型高致病性PRRSV美洲型毒株,补充和丰富了毒株的基因组信息数据,为深入开展该毒株的遗传变异分析及生物学特性研究奠定了基础。
1 材料和方法
1.1 病毒株及主要试剂 PRRSV TM分离株由本实验室分离并保存;PRRSV TP变异株为本实验室分离、鉴定并保存(EU864233);Ingelvac PRRS MLV为Boehringer Ingelheim公司产品;Marc-145细胞由本实验室保存;pMD18-T、TOP10菌株、PrimeSTAR®HS DNA Polymerase、PrimeScriptTMReverse Transcriptise(RNase H-)、DNA Marker DL15000 购 自TaKaRa公司;TRIzol Reagent购自Invitrogen公司。
1.2 引物设计 参照GenBank中登录的Ingelvac PRRS MLV(AF066183)、TP(EU864233)等毒株基因序列及苏润环等发表的序列[9],设计三对引物(表1),由宝生物工程(大连)有限公司合成。

表1 PRRSV Nsp2基因检测及鉴别扩增引物Table 1 Primes of detection and identification the PRRSV Nsp2 gene
1.3 病料的采集与处理 参照文献[10]方法进行。
1.4 病毒分离 病毒悬液上清接种单层Marc-145细胞,37℃吸附1 h后,用含2%胎牛血清的DMEM培养液培养5 d~7 d,当70%~80%出现细胞病变(CPE)时收集病毒液并盲传3代。将分离病毒液按Reed-Muench法测定其TCID50。
1.5 病毒分离株的RT-PCR鉴定 采用P1/P2和P3/P4两对引物,按照两步法进行RT-PCR扩增,其中反应参数为:42℃ 45 min,95℃ 5 min,获得cDNA。以cDNA为模板,94℃ 2 min;94℃30 s、55℃1 min、72℃1 min,30个循环;72℃10 min。
1.6 Nsp2基因的序列测定及分析 以引物P5/P6,扩增Nsp2基因的目的片段,进行回收、连接和转化,鉴定正确的质粒由TaKaRa公司测序,使用DNAStar软件和NCBI BLAST在线分析测序结果,并与国内外主要PRRSV分离株的相应序列进行核苷酸和氨基酸比较分析。
1.7 病毒猪体回归试验 将16头3周龄左右PRRSV抗体及病原检测均为阴性的健康仔猪随机平均分为2组,第一组接种TM株第5代病毒,毒价为TCID5010-5.5/mL;第二组注射正常细胞液,作为空白对照。接种方式为颈部肌肉注射2 mL/头,滴鼻1 mL。观察临床症状和体温变化;对死亡猪及时剖解,存活猪于接种后14 d解剖,观察病理变化,具体操作参照文献[11-12]进行。
2 结果
2.1 RT-PCR鉴定 用引物P1/P2,扩增血清样品和组织悬液。扩增出约为500 bp的特异片段(图1),与PRRSV变异株片段大小接近;而P3/P4引物扩增产物与PRRSV TP变异株相比较片段略小(图2)。


2.2 病毒分离 病料在Marc-145细胞上盲传3代后,培养至72 h~96 h出现明显的CPE,表现为细胞灶状变圆突起,聚集、皱缩并脱落,与目前国内外报道的PRRSV所致细胞病变相似。病毒TCID50达107/mL左右。将分离株病毒暂定名为TM株。
2.3 TM株Nsp2基因的克隆 利用RT-PCR方法扩增TM株Nsp2基因片段进行T克隆和鉴定。TM株Nsp2基因重组质粒经PCR和测序鉴定,大小为2844 bp,与预测相符。
2.4 Nsp2基因的核苷酸序列分析 通过序列测定获得TM株Nsp2序列,核酸序列比对分析结果表明,TM株Nsp2基因序列与目前国内分离的PRRSV变异株相比同样存在2780 bp~2782 bp位置3个核苷酸和2933 bp~3019 bp位置87个核苷酸的缺失。此外,TM毒株在1401 bp~1463 bp位置发现有63个核苷酸的独特缺失,该缺失现象与目前国内分离的PRRSV变异株缺失表型不完全一致,具有毒株特异性。
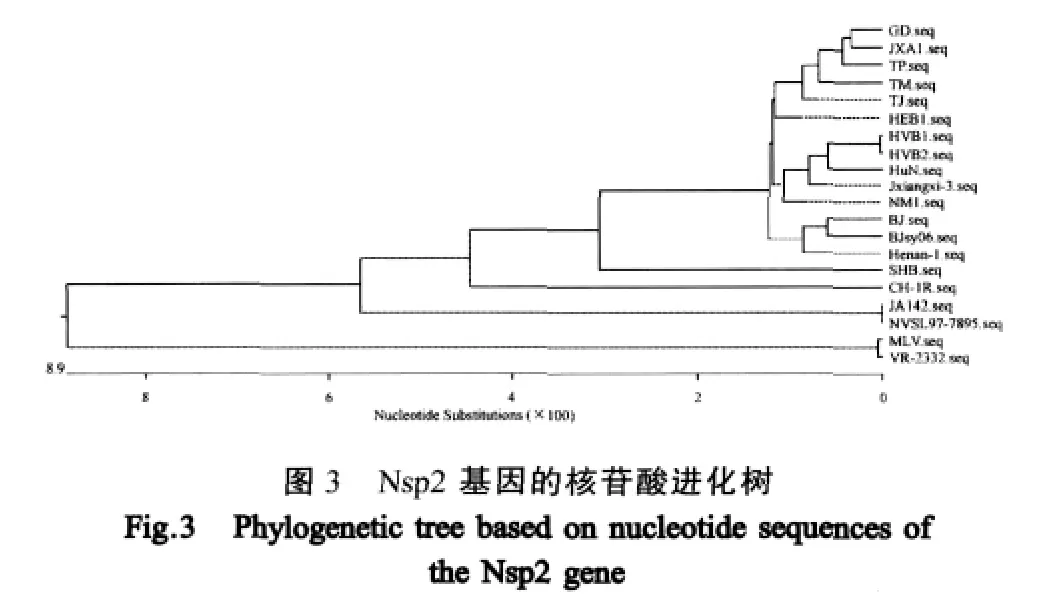
Nsp2核苷酸序列同源性分析表明,本实验分离的TM株与国内分离的高致病性PRRSV毒株GD、HEB1、Henan-1、JXA1、HUB1、HUB2、HuN、Jiangxi-3、JXA1、NM1、TJ和TP的序列同源性较高,为98.0%~98.6%;而与国内分离的毒株SHB、CH-1R和JA142同源性次之;与NVSL 97-7895株、美洲标准株VR-2332和疫苗株MLV和的同源性相对较低,分别为87.9%、83.0%和82.9%。系统发育树分析表明(图3),TM株Nsp2序列与GD、JXA1、TP TJ和HEB1序列接近,类聚于同一分支,与国内早期分离的PRRSV经典株SHB、CH-1R株相对较远,与美洲经典株VR-2332、疫苗株MLV、NVSL 97-7895和JA142的遗传距离最远。
2.5 TM株Nsp2基因的推导氨基酸序列分析 利用DNAStar软件对TM分离株Nsp2基因推导氨基酸序列比对结果表明TM株与目前国内外分离的PRRSV毒株相比变异较大,分别存在不同位置的多位点缺失。与经典的PRRSV株相比,TM株分别在481位和532位~560位氨基酸存在30个氨基酸缺失(图4),与国内近年来分离的高致病性PRRSV分离株的缺失表型相同。此外,TM株分别在22位~42位氨基酸存在21个氨基酸的独特缺失(图4),目前未见以上两个缺失位点表型的报道。

2.6 病毒猪体回归试验 实验组猪只接种PRRSV TM株后24 h即出现临床症状。主要表现为体温升高快,接种后第2 d体温升至40℃以上,第3 d~13 d高达41℃以上,并逐渐出现食欲减退、精神沉郁、眼结膜变红肿胀、全身皮肤发红以及神经症状等。解剖可见全身淋巴结肿胀,肺脏实质性病变,病变面积占整个肺部的30%~80%。而对照组猪体温均正常,无临床症状变化。
3 讨论
PRRSV各分离株间基因组存在广泛的变异。尤其以Nsp2序列变异最大,并且具有耐受碱基插入或缺失的能力[13]。高志强等对PRRSV毒株HB2(sh)/2002全基因序列测定分析,首次发现PRRSV存在缺失变异现象,该毒株Nsp2存在连续编码12个氨基酸的36个核苷酸的缺失[14]。此后一系列PRRSV分离株Nsp2片段的突变、缺失、插入现象相继被发现[15]。因而对Nsp2基因的变异表型分析可反映整个病毒基因组序列的变异情况[16]。
本研究通过PRRSV TM分离株的Nsp2基因序列的系统进化比较显示该毒株与近年来发现并流行的高热病毒株的同源性较高,同属于一个亚型;而国内SHB、CH-1R和JA142等与美国疫苗株Resp PRRS MLV遗传距离较远,属于另一个亚型。结合系统进化树分析结果,可以推断本研究中分离的TM毒株在流行过程中其Nsp2基因发生了不同程度的变异,起源可能与TP、JXA1、GD、TJ和HEB1有关。特别是与TP株的同源性比其他毒株高,推导氨基酸同源性为98.2%。Nsp2推导的氨基酸序列比较发现,TM株除了在481位和532位~560位缺失30个氨基酸外,还在22位~42位氨基酸存在21个氨基酸的独特缺失。TM毒株存在新的缺失位点,与我国多个地区高致病性PRRSV分离株的核苷酸/氨基酸序列均差异较大,表明PRRSV Nsp2基因在缺失变异毒株间存在一定的差异,毒株变异可能与时间、病毒株间的流行地域跨度、不同毒株在同一宿主的共存竞争等密切相关。
M株是在广东地区某疑似PRRSV感染的猪场病料中分离得到。在Marc-145细胞盲传3代即可产生明显稳定的CPE,与国内2006年后分离的高致病性PRRSV变异株的感染细胞特性相似。动物回归试验结果显示,TM株接种仔猪可引起明显临床症状和病理变化,表明该毒株具有较强的致病性。
尽管目前对Nsp2基因的功能尚不清楚,但普遍认为PRRSV Nsp2基因的功能与病毒的细胞嗜性、复制与生长、致病性等密切相关[13]。有研究表明,Nsp2基因中30个氨基酸片段的缺失并非与病毒的毒力相关[17]。本研究中TM分离株在30个氨基酸缺失的基础之上再次发生了21个氨基酸的独特缺失,由此表明PRRSV流行毒株的Nsp2基因序列发生了新变化,该缺失变异是否与毒株的毒力、生长特性等生物学特征相关,尚需进一步研究。
[1]Kranker S,Nielsen J,Bille-Hansen V,et al.Experimental inoculation of swine at various stages of gestation with a Danish isolate of porcine reproductive and respiratory syndrome virus(PRRSV)[J].Vet Microbiol,1998,61(1-2):21-31.
[2]Wu J,Li J.Genetic variation and pathogenicity of highly virulent porcine reproductive and respiratory syndrome virus emerging in China[J].Arch Virol,2009,154(10):1589-1597.
[3]Nielsen H S,Liu G,Nielsen J,et al.Generation of an infectious clone of VR-2332,a highly virulent north American-type isolate of porcine reproductive and respiratory syndrome virus[J].J Virol,2003,77(6):3702-3711.
[4]郭宝清,陈章水,刘文兴,等.从疑似PRRS流产胎儿分离PRRSV的研究[J].中国预防兽医学报,1996,(2):1-4.
[5]Gao Z Q,Guo X,Yang H C,et al.Genomic characterization of two Chinese isolates of porcine respiratory and reproductive syndrome virus[J].Arch Virol,2004,149(7):1341-1351.
[6]Shen S,Wang K J.Determination of the complete nucleotide sequence of a vaccine strain of porcine reproductive and respiratory syndrome virus and identification of the Nsp2 gene with a unique insertion[J].Arch Virol,2000,145(5):871-883.
[7]Tian K G,Yu X L,Zhao T Z,et al.Emergence of fatal PRRSV variants:unparalleled outbreaks of atypical PRRS in China and molecular dissection of the unique hallmark[J].Plos One,2007,2(6):526-539
[8]高志强,郭鑫,杨汉春,等.猪繁殖与呼吸综合征病毒缺失变异株的基因组特征[J].畜牧兽医学报,2005,36(6):578-584.
[9]苏润环,邓雨修,李春梅,等.PRRSV高致病性变异株与经典株混合感染[J].动物医学进展,2009,30(3):26-31.
[10]宋延华,邓雨修,李春梅,等.猪繁殖与呼吸综合征病毒的分离与鉴定[J].畜牧与兽医,2008,40(3):27-30.
[11]Wang Y,Liang Y,Han J,et al.Attenuation of porcine reproductive and respiratory syndrome virus strain MN184 using chimeric construction with vaccine sequence [J].Virology,2008,371(2):418-429.
[12]Tian Z J,An T Q,Zhou Y J,et al.An attenuated live vaccine based on highly pathogenic porcine reproductive and respiratory syndrome virus(HP-PRRSV)protects piglets against HP-PRRS[J].Vet Microbiol,2009,138(1-2):34-40.
[13]Kim D Y,Kaiser T J.Insertion and deletion in a non-essential region of the nonstructural protein 2(Nsp2)of porcine reproductive and respiratory syndrome(PRRS)virus:effects on virulence and immunogenicity[J].Virus Genes,2009,38(1):118-128.
[14]高志强,郭鑫,杨汉春,等.猪繁殖与呼吸综合征病毒HB-1(sh)/2002株全基因组分子特征分析[J].病毒学报,2004,20(3):270-274.
[15]Han J,Wang Y,Faaberg K S.Complete genome analysis of RFLP 184 isolates of porcine reproductive and respiratory syndrome virus[J].Virus Res,2006,122:175-182.
[16]Fang Y,Christopher-Hennings J,Brown E,et al.Development of genetic markers in the non-structural protein 2 region of a US type 1 porcine reproductive and respiratory syndrome virus:implications for future recombinant marker vaccine development[J].J Gen Virol,2008,89(12):3086-3096.
[17]Zhou L,Zhang J,Zeng J,et al.The 30 amino acids deletion in Nsp2 of highly pathogenic porcine reproductive and respiratory syndrome virus emerging in China is not related to its virulence[J].J Virol,2009,83(10):5156-5167.
- 中国预防兽医学报的其它文章
- 寄生虫MicroRNA的研究进展

