溶菌酶对肉鸡食糜微生物数量、免疫及生产性能的影响
武汉新华扬生物股份有限公司 程时军
华中农业大学动物科技学院 马立保*
鉴于抗生素的使用会带来畜禽产品药物残留、耐药基因转移到微生物等负面作用,近年来许多国家开始逐步限制使用饲用抗生素,因此新的、安全高效的饲用抗生素替代品的开发已是迫在眉睫,早已应用于食品及医疗行业中的溶菌酶因是蛋白质类,具有类似抗生素的作用特点,近年来受到了畜牧行业的普遍关注。本试验以溶菌酶取代饲料中的抗生素添加剂,结合相关抗生素的研究方向,探讨溶菌酶对肉鸡生产性能的影响并简要探讨其机制,为溶菌酶在饲料工业中取代抗生素的应用提供参考。
1 材料与方法
1.1 试验材料及动物 溶菌酶:500000 U/g,由武汉新华扬生物股份有限公司提供,酶活单位定义:在25℃、pH为6.2的条件下,于450 nm处每分钟引起溶酶小球菌体溶液吸光度下降0.001为1个酶活力单位(U)。
1.2 试验日粮 参照《中华人民共和国农业行业标准NY/T 33-2004》配制玉米-豆粕型粉料,基础日粮组成及营养水平见表1。
1.3 试验分组 采用单因子试验设计,选择144只1日龄艾维茵肉鸡仔随机分4为组,每组6重复,每重复6只,公母各半,各处理见表2。
1.4 饲养管理 试验肉鸡地面平养,自由采食和饮水,试验分0~3周龄和4~6周龄两个阶段;室内温度按艾维茵饲养标准控制;在3周龄时以地克珠利饮水防球虫病;免疫程序:7 d新城疫Lasota+传染性支气管炎H120二联苗滴鼻、点眼,14 d和21 d IBD饮水。

表1 试验基础日粮组成及营养水平

表2 试验分组及日粮处理
1.5 测定指标 21日龄和42日龄清晨以重复为单位称鸡活重和余料重量,计算不同阶段肉鸡平均日采食量、平均日增重及料重比。于42日龄清晨从各处理鸡中随机选取6只 (每重复1只),编号称重后,翅静脉采血备用测血清新城疫抗体效价;采血后进行屠宰,迅速取脾脏保存测细胞因子;取十二指肠、空肠各2 cm左右,并以棉线结扎两端,用酒精棉球消毒各结扎口,置于冰盒送实验室超净台食糜微生物待测,最后取其胸腺、法氏囊称重。
1.6 检测方法
1.6.1 血清新城疫抗体效价 采用血凝抑制法(HI)测定(杨汉春,2003)。
1.6.2 食糜微生物数量 超净工作台中,从肠道分别取0.5 g食糜,加入4.5 mL PBS稀释液,静置5 min后,取上清液0.5 mL于4.5 mL稀释液,依次倍比稀释到 10-9后,分别从 10-4、10-5、10-6、10-7、10-8、10-9浓度离心管中取 100 μL 于大肠杆菌、乳酸杆菌、双歧杆菌及梭菌选择性培养基培养。以每平皿菌落数30~200个为有效,每样作2平行,取平均数。菌落数计数公式:每g内容物菌落数=lg[(菌落数×稀释倍数×每次稀释取样毫升数)/(接种用样品毫升数×样品克数)]
1.6.3 细胞因子TNF-α,IL-1 mRNA 用TRIzol提取脾脏RNA进行反转录,通过RT-PCR检测细胞因子TNF-α,IL-1 mRNA设计引物扩增相应基因片段 (见表3)。RT-PCR反应程序:95℃、2 min,1 个循环,然后 95 ℃、15 s,56 ℃、30 s,68 ℃、45 s,共35个循环。

表3 实时定量PCR所用引物
1.7 数据分析 数据用平均数±标准差表示,采用SPSS 16.0软件进行ONE-WAY ANOVA分析,并以LSD作多重比较。试验数据以平均值±标准差表示。
2 结果与分析
2.1 溶菌酶对42 d肉鸡十二指肠食糜微生物数量的影响 见表4。从表4可以看出,3个试验组十二指肠中梭菌总数分别比对照组极显著降低了4.03%、2.6%和5.6%(P<0.01);与对照组相比,抗生素组和溶菌酶组2极显著降低了大肠杆菌总数(P<0.01);各处理对十二指肠双歧杆菌和乳酸杆菌有降低的趋势,但无显著差异(P>0.05)。
2.2 溶菌酶对42 d肉鸡空肠食糜微生物数量的影响 见表5。从表5可见,与对照组相比,抗生素组极显著降低了空肠梭菌总数(P<0.01),2个溶菌酶处理组显著降低空肠梭菌总数 (P<0.05);与对照组相比,溶菌酶组1显著降低了空肠大肠杆菌总数(P<0.05);各处理对空肠双歧杆菌和乳酸杆菌有降低的趋势,但无显著差异(P> 0.05)。
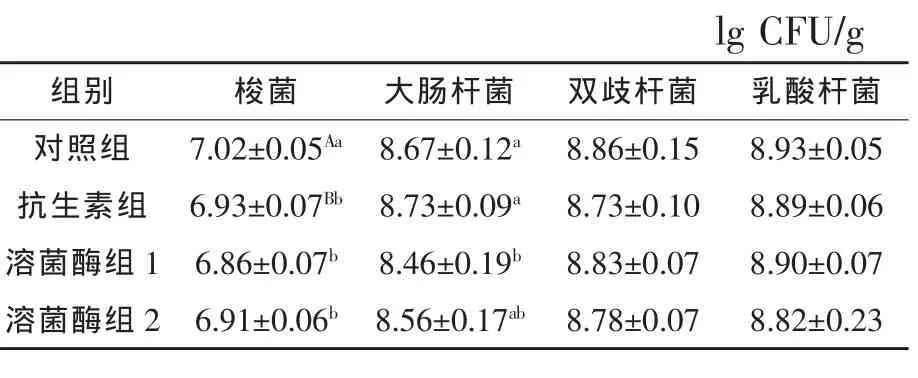
表5 溶菌酶对42d肉鸡空肠食糜微生物数量的影响
2.3 溶菌酶对肉鸡免疫器官指数的影响 见表6。从表6可见,与对照组相比,抗生素组和溶菌酶组2可显著降低肉鸡胸腺指数分别达31.3%和26.9%(P<0.05),溶菌酶组1胸腺指数降低16.8%(P>0.05);与对照组相比,溶菌酶组2可显著降低法氏囊指数23.3%(P<0.05),抗生素与溶菌酶组1也可降低法氏囊指数,但差异不显著(P > 0.05)。
2.4 溶菌酶对42 d肉鸡血清新城疫抗体效价的影响 见表6。从表6可以看出,与对照组相比,溶菌酶组1极显著降低了肉鸡血清新城疫抗体水平21.1%(P<0.01),抗生素组及溶菌酶组2也显著降低了 15.8%和 15.8%(P<0.05),3个试验组间抗体水平差异不显著(P>0.05)。
2.5 溶菌酶对肉鸡细胞免疫因子的影响 见表7。从表7可以看出,与对照组相比抗生素组及溶菌酶组2脾脏IL-1β mRNA表达丰度极显著降低19.3%和24.6%(P<0.01),溶菌酶组2相对溶菌酶组1 IL-1β mRNA表达丰度降低了18.9%(P<0.05);与对照组相比,不同试验处理组脾脏TNF-α mRNA表达丰度均有所降低但差异不显著(P > 0.05)。

表6 溶菌酶对42 d肉鸡免疫器官指数和ND抗体水平的影响

表7 溶菌酶对42 d肉鸡脾脏细胞因子TNF-α,IL-1β mRNA 表达丰度的影响
2.6 溶菌酶对肉鸡生产性能的影响 见表8。从表8可以看出,试验前期肉鸡的平均日采食量各组之间差异显著(P>0.05);试验各处理组料重比均有降低的趋势,与对照组相比,抗生素组降低了9.8%,两个溶菌酶组分别降低了7.0%和8.0%。与对照组相比,抗生素组和溶菌酶组2显著提高了前期肉鸡的平均日增重(P<0.05),分别提高了11.1%和7.3%。各处理对后期肉鸡的平均日采食量无显著影响(P>0.05);与对照组相比,抗生素组和溶菌酶组2显著提高了后期肉鸡的平均日增重 (P<0.05),提高幅度分别达到12.4%和12.2%;与对照组相比,抗生素组和溶菌酶组1分别降低了料重比10.2%和9.0%,但差异不显著(P>0.05),溶菌酶组2肉鸡后期料重比则显著降低了 11.0%(P <0.05)。
从全期数据来看,与对照组相比,3个处理组对肉鸡平均日采食量无显著影响(P>0.05);各处理组均极显著提高了肉鸡平均日增重和料重比(P<0.01)。使用溶菌酶与抗生素在平均日采食量、日增重及料重比方面未表现出显著差异(P>0.05),溶菌酶组2相对溶菌酶组1料重比降低了2.58%(P > 0.05)。

表8 溶菌酶对不同阶段肉鸡生产性能的影响
3 讨论
3.1 溶菌酶对肉鸡食糜微生物数量的影响 肠道菌群最终反映其与宿主的共生关系,微生物的变化会影响动物的健康、生长及成熟(Hill,1982)。本试验结果发现,溶菌酶同抗生素一样影响了肉鸡的肠道微生物数量,且对革兰氏阳性菌如梭菌更为敏感,主要原因是革兰氏阳性菌细胞壁组成主要是肽聚糖,会被溶菌酶中N-乙酰胞壁质聚糖水解酶直接水解而导致死亡,这与杨露青等(2003)研究报道的结论较类似。本试验还发现,溶菌酶对双歧杆菌和乳酸杆菌无显著影响 (P>0.05),可能原因是双歧杆菌和乳酸杆菌这2种微生物因梭菌数量减少而具备了增殖优势,另外跟这种细菌的细胞壁结构特点有关。
3.2 溶菌酶对肉鸡免疫机能的影响
3.2.1 溶菌酶对肉鸡免疫器官和体液免疫的影响机体免疫器官指数如法氏囊指数反映了动物的免疫器官发育状况和免疫功能。本试验发现,溶菌酶和抗生素在一定程度上降低肉鸡免疫器官指数和ND抗体水平,有降低动物免疫活化状况的趋势,与佟建明等(2001)研究结果类似。
3.2.2 溶菌酶对肉鸡细胞因子的影响 抗生素通过抑制或杀灭病原微生物,减少机体的免疫应答,从而降低细胞因子如IL-1的水平,降低动物的免疫应激(Roura等,1991),进而改变饲料效率。微生物会影响细胞因子含量(Hill等,1952)。动物生长性能的下降是感染的反应(Murray,1979),并且它至少一部分是受IL-1调节 (Mccarthy等,1985)。这种下降也是由于基础代谢率的提高、营养物质吸收的变化及组织成分改变所致(Klasing和Peng,1987)。本试验发现,抗生素组及溶菌酶组2脾脏IL-1β mRNA水平极显著降低 (P<0.01),不同试验处理脾脏TNF-α mRNA水平也均有所降低,但差异不显著(P>0.05),表明溶菌酶与抗生素有类似作用:通过减少微生物特别有害微生物的数量,降低微生物对动物免疫系统的刺激,从而一定程度上抑制了致炎细胞因子产生,这与 Naqi(1984)、Roura(1991)报道类似。 导致此现象的另一可能原因是溶菌酶通过静电作用结合脂质A和脂多糖,导致酰基链固化和内毒素分子从立方体形向多层结构转变,从而阻止内毒素与巨噬细胞受体互作,减少促炎症反应细胞因子如IL-1、IL-6 及 TNF-α 的释放 (Klaus等,1998;Takada 等,1994)。
3.3 溶菌酶对肉鸡生产性能的影响 关于溶菌酶与抗生素在畜禽中应用的效果比较已有报道。孙小青(2008)研究表明,溶菌酶取代抗生素可显著提高肉鸭增重2.33%(P<0.05)和降低增重成本(P<0.05),对料重比也有改善,综合其他指标溶菌酶在肉鸭中应用总体效果好于抗生素。张世卿等(2008)也发现,添加溶菌酶可降低肉仔鸡采食量、料重比,提高日增重,且一定添加量可显著改善肉鸡全期(0~6周龄)日增重和料重比(P<0.05)。Brooke等(2002)使用老鼠表达的溶菌酶饲喂肉鸡也有较好的促生长效果。本试验发现,不同处理对肉鸡不同阶段日采食量并无显著影响(P>0.05),原因可能是肉鸡采食量更多受日粮能量水平等因素的影响;300 g/t溶菌酶对肉鸡平均日增重和料重比均有显著改善(P<0.05),与抗生素的效果无差别(P>0.05),可能原因是溶菌酶减少了有害微生物对肉鸡肠道的刺激,鸡的免疫器官发育变慢,炎性因子降低,摄入的营养用于维持减少,从而用于生产的数量相应增加,所以在采食量不变的情况下,肉鸡增重增加。
4 结论
4.1 饲料中添加溶菌酶可降低食糜中有害微生物(梭菌和大肠菌类)数量(P<0.05);一定程度上降低了肉鸡免疫器官指数、新城疫抗体水平、IL-1β mRNA和TNF-α mRNA的表达丰度。
4.2 溶菌酶对肉鸡平均日采食量无显著影响(P>0.05),极显著提高了整个试验期肉鸡平均日增重,降低了料重比(P<0.01),每吨饲料添加150 g溶菌酶可替代抗生素不影响肉鸡生产性能。
[1]孙小青.在肉鸭日粮中溶菌酶与几种抗生素的饲用价值比较:[硕士学位论文][D].重庆:西南大学,2008.
[2]佟建明,张日俊,萨仁娜,等.持续、低剂量重金霉素对肉鸡免疫机能的抑制作用[J].中国农业科学,2001,34(2):200 ~ 204.
[3]杨汉春.动物免疫学[M].北京:中国农业大学出版社,2003.
[4]杨露青,薛金花,何爱桃,等.溶菌酶抑菌作用检测方法研究[J].American Journal of Chinese Medicine,2003,5:3.
[5]张世卿,朱忠珂,王明成,等.玉米-豆粕日粮添加溶菌酶对肉仔鸡生长性能、代谢及免疫指标的影响[J].动物营养学报,2008,20(4):463 ~ 468.
[6]Brooke D,Humphrey,Ning Huang,et al.Rice Expressing Lactoferrin and Lysozyme Has Antibiotic-Like Properties When Fed to Chicks[J].Journal of Nutrition,2002,32:1214 ~ 1218.
[7]Harrned B K,Cunningham R W,Clark M C,et al.The pharmacology of duomycin[M].Annals of the New York Academy of Sciences,1948,51:182.
[8]Hill D C,Branion H D,Slinger S I,et al.Influence of environment on the growth response of chicks to penicillin[J].Poultry Science,1952,32:464 ~ 466.
[9]Hill M J.Gut flora associated diseases in man[J].Journal of Veterinary Medical Science,1982,33:32 ~ 36.
[10]Klasing K C,Peng R K.Influence of cell source,stimulating agents,and incubation conditions on release of interleukin-1 from chicken macrophages[J].Developmental and Comparative Immunology,1987,11:385 ~ 394.
[11]Klaus Brandenburg,Michel H J,Koch,et al.Biophysical characterisation of lysozyme binding to LPS Re and lipid A[J].European Journal of Biochemistry,1998,258:686 ~ 695.
[12]Mccarthy D O,Kluger M J,Vanderg A J.Suppression of food intake during infection:is interleukin-1 involved[J].American Journal of Clinical Nutrition,1985,42:1179 ~ 1182.
[13]Murray M J,Murray A B.Anorexia of infection as a mechanism of host defense[J].American Journal of Clinical Nutrition,1979,32:593 ~ 596.
[14]Naqi S A,Shain N,Wagner G,et al.Adverse effects of antibiotics on the development of gut-associated lymphoid tissues and the serum globulins in chickens[J].American Journal of Veterinary Research,1984,45:1425 ~ 1429.
[15]Roura,Josep Homedes,Klasing K C.Prevention of Immunologie Stress Contributes to the Growth-Permitting Ability of Dietary Antibiotics in Chicks[A].Annual Meeting of the Poultry Science Association[C].1991.13.
[16]Takada K,Ohno N,Yadomae T.Lysozyme regulates LPS-induced interleukin-6 release in mice[J].Circulatory Shock,1994,44:169 ~ 174.

