细菌生物膜与导管伴生感染相关性的研究
刘新,王岚,刘颖,张晓科
(1.沈阳医学院基础医学院病原生物学研究室,辽宁省环境污染与微生态学重点实验室,辽宁 沈阳 110034;2.解放军沈阳 202医院干诊科;3.中国医科大学附属第一医院重症监护病房)
现代医学技术的发展,多种侵入性的医疗器械、生物医学材料广泛应用,如传统的导尿管、子宫节育环、中心静脉导管、新型的人工心脏瓣膜、各种支架、角膜接触镜等,这些器械和材料的应用,在解决了原有医疗问题的同时,许多引发了伴生感染 (associated infection)[1],此种现象在有置入性导管者表现尤为突出有研究发现,细菌容易粘附于塑料输液管内表面,形成细菌生物膜 (biofilm),难以冲洗清除[2]。为了解细菌生物膜与置入性导管伴生感染相关性,我们对医院实施置入性导管进行检查或治疗的患者撤出导管时进行细菌检查、分离培养及生物膜形成的研究,现将结果报道如下。
1 材料与方法
1.1 材料 2009年7月至 2010年6月,采集来自沈阳市多家医院病房患者包括导尿管、呼吸机导管及手术的引流管等标本,共 62例 (临检已判定有感染,病原菌主要包括铜绿假单胞菌、鲍曼不动杆菌、肺炎克雷伯菌、大肠埃希菌、金黄色葡萄球菌及表皮葡萄球菌),无菌操作下,将近人体端 1cm导管外壁 70%酒精涂抹消毒后,纵向剪开,接种环灭菌刮取内壁后接种于 LB肉汤培养基中增菌,37℃过夜,然后用其肉汤分别接种于血平板、麦康凯培养基上,可疑鲍曼不动杆菌转种于青霉素◦诺氟沙星培养基上培养。
1.2 菌种鉴定
1.2.1 初步鉴定 过夜培养的肉汤直接涂片,革兰染色;平板上可疑菌落触酶试验、氧化酶、甘露醇试验、硝酸盐还原动力试验及明胶酶试验。然后转种相应培养基,纯化。
1.2.2 菌种鉴定及生物膜模式株筛选 经初步鉴定的菌种,采用生物—梅里埃公司 ATB生化鉴定分析仪,按 ID 32 GN革兰阴性杆菌鉴定试条(Ref.32 100)、ID 32 STAPH葡萄球菌鉴定试条(Ref.32 500)及 ID 32 C酵母菌鉴定试条 (Ref.32 200)说明书进行鉴定到种。将临床标本中分离纯化的菌株在刚果红培养基培养[3],产生生物膜的菌株菌落呈深红色,非模式株菌落为无色。
1.3 生物膜形态观察
1.3.1 细菌生物膜染色快速鉴定 根据文献[4]配制生物膜染液:阿利新蓝 -刚果红染液:阿利新蓝染液:阿利新蓝 2g,冰醋酸 3ml,蒸馏水 97m l;刚果红染液:刚果红 2g,蒸馏水 100ml。染色方法:接种环直接刮取导管内壁粘液涂于洁净载玻片上,滴加 10μl阿利新蓝染液,混匀,静置 3~5min,火焰加热固定,直至染液挥发完全,滴加 20μl刚果红染液,均匀涂布,火焰加热干燥后,三蒸水冲洗,吸干水分后油浸镜 (NIKON-80I)下观察。
1.3.2 细菌生物膜形态结构观察 将导管标本分别浸泡于 LB肉汤中,封口膜封口防止污染,Innova40温控摇床 37℃连续震荡培养,振幅为 50Hz,每隔 48h取出 PBS冲洗,除去浮游菌,换新培养液,鲍曼不动杆菌持续 7d,其他菌持续 5d。振荡培养后的引流管经 2.5%戊二醛 4℃下固定 24h,pH7.2的磷酸盐缓冲液冲洗 3次,再以 1%的锇酸4℃固定 2h,4℃双蒸水冲洗 3次,梯度乙醇脱水(以 50%、70%、80%、90%、95%两次、100%三次,每次脱水时间 10min),醋酸异戊酯置换,CO2临界点干燥,离子喷金镀膜,通过 KYKY-3200 SEM扫描观察引流管内壁生物膜形态结构。
1.4 生物膜定量 将刚果红培养基上菌落为深红色的菌种,初步确定形成生物膜的模式株,参照文献[5,6]用微量板进行生物膜定量检测,96孔板于37℃分别培养 3d后取出,轻轻拍出孔内液体,然后用 PBS缓冲液冲洗四次,去除浮游菌。用 1%结晶紫染色 15min,三蒸水再次冲洗,待孔板晾干后,向每孔内加入无水乙醇 -丙酮 (80∶20 v/v)200μl脱色,置于酶标仪 (BioTek ELx800,美国)上测定吸光度 (OD 570 nm)值。
2 结果
2.1 菌种鉴定 62例导管标本,分离出细菌 137株,其中鲍曼不动杆菌 43例 (31.39%),铜绿假单胞菌 41例 (29.93%),大肠埃希菌 22例(16.05%),葡萄球菌属 14例 (10.22%),肺炎克雷伯菌 10例,真菌 4例 (4/137,2.92%),其它 7例 (5.11%),有 11例标本有多种细菌混合感染。ATB生化鉴定菌株:鲍曼不动杆菌、铜绿假单胞菌的纯度达 99.9%。
2.2 生物膜定性 62例临床标本中有 38例在刚果红培养基不同程度菌落呈深红色,为产生生物膜的菌株,阳性率为 61.29%。另 24例菌在刚果红培养基培养,菌落始终为无色。采用阿利新蓝-刚果红涂片染色,生物膜型细菌因胞外多糖被染成深红色,未成膜的细菌为黄色,背景为蓝色。
2.3 细菌生物膜的定量检测 图 1表明微量板上生物膜形成,我们发现颜色最深的孔,恰恰是刚果红培养基上呈深色菌落的模式株。枯草杆菌不形成生物膜为阴性对照,几乎无色。
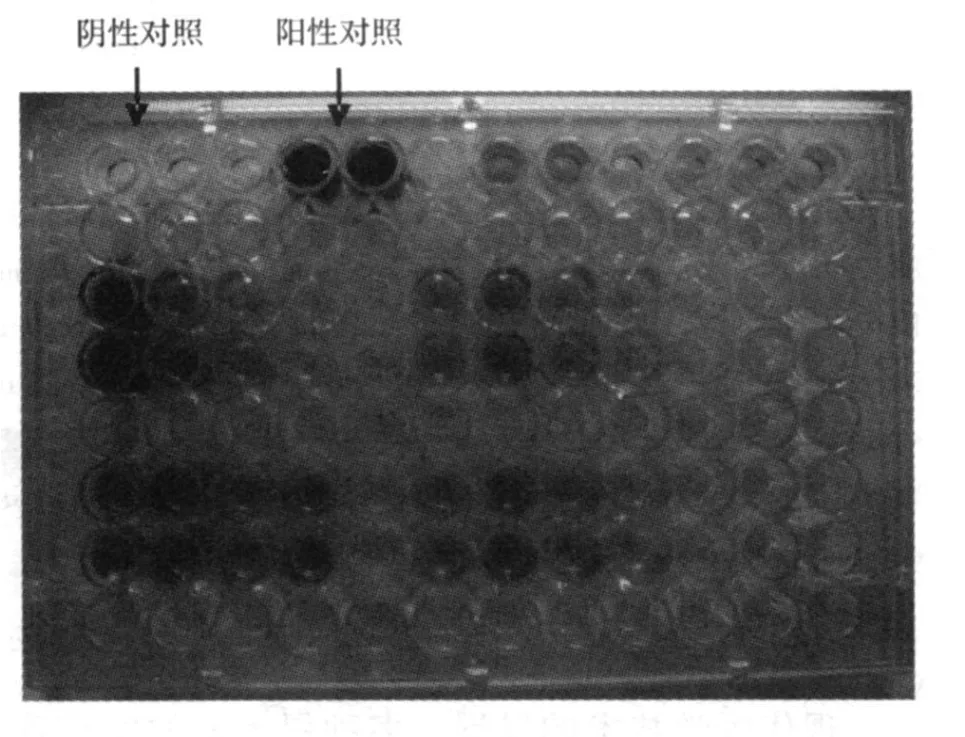
图1 微量板上生物膜形成(紫色孔是生物膜形成菌株,颜色越深表明形成的膜越多)
将微量板经过酶标仪测定结果见表1。
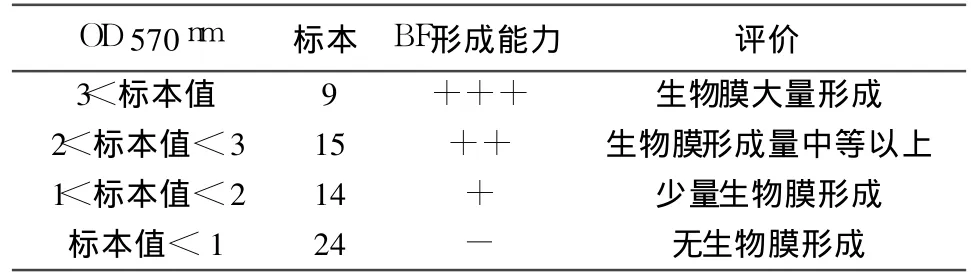
表1 细菌生物膜的定量检测
2.4 扫描电镜观察结果 导管内表面有膜状物质形成,膜内可见细菌聚集于交联的纤维素样物质中 (图 2 A),由于枯草杆菌无胞外多糖,不能形成生物膜,为阴性对照 (图 2 B),培养 5d的膜厚度可达 4.92μm(图 2C)。
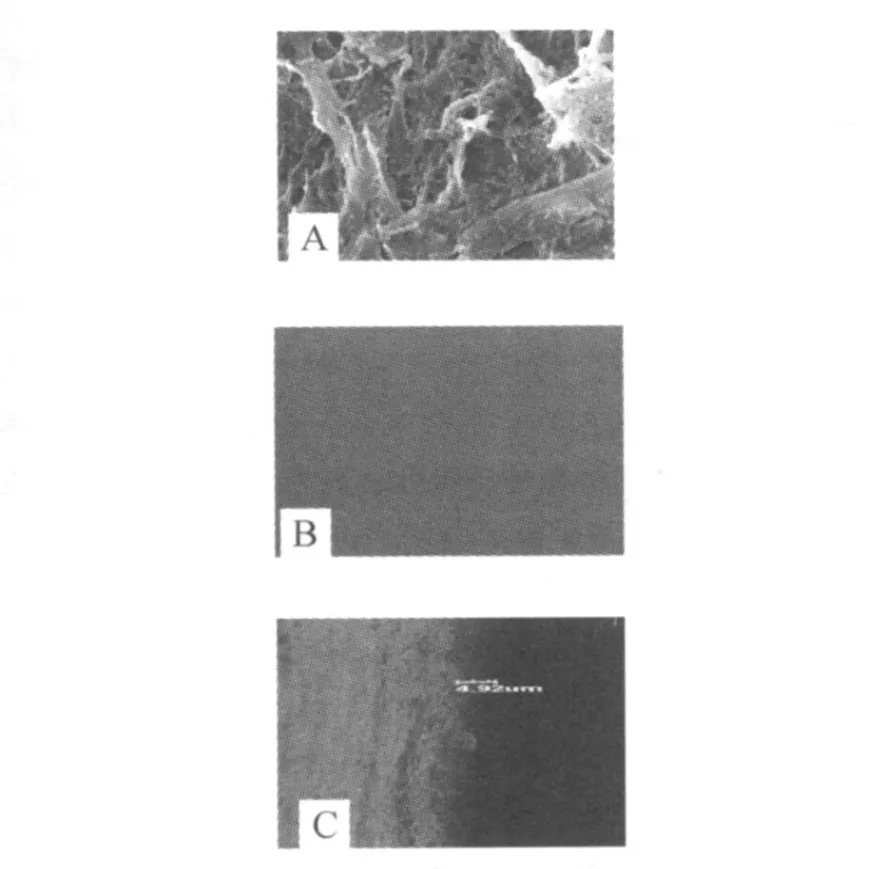
图2 导管内细菌生物膜形态结构(A导管内形成的生物膜,B无生物膜形成的对照组,C培养 5d的膜厚度)
3 讨论
本研究发现有感染的患者导管内均有细菌检出,11例患者有多种菌混合感染,病原菌以革兰阴性杆菌为主 (116/137,84.67%),其中铜绿假单胞菌、鲍曼不动杆菌是主要致病菌,这些菌均是临床耐药严重的菌株。
铜绿假单胞菌、鲍曼不动杆菌、肺炎克雷伯菌、大肠埃希菌属于机会致病菌 ,可引起呼吸道、泌尿生殖道感染及败血症等严重感染,其中以呼吸道感染最为常见,本研究 62例导管标本中呼吸道感染者 44例 (70.96%),如此高感染率,急需快速检测方法进行诊断,我们在研究中采用结晶紫染色方法对细菌生物膜进行定量检测,阿利新蓝染色进行生物膜定位,这些实验技术简便快速,可选为临床快速诊断适宜的方法。扫描电镜可直接观察生物膜的形态特征及结构,但其实验环节多,技术复杂并要求特殊设备,更适用于研究。
患者有侵入性导管操作时,尽管医护人员非常注意无菌技术,但这些患者的医院感染率仍然高于其他患者,以往的报告常限于菌群种类和耐药性分析,而关于这些病原菌如何引起感染少有报道,特别是 ICU患者病情重,各种侵入型导管多,这些导管因与外界相通,为细菌粘附提供了机会。本研究发现具有较强粘附性的机会致病菌一旦定植于导管,在导管内的气体或液体的流动冲刷下,容易形成生物膜 (38/62,61.29%)。将导管浸入于肉汤培养液中,摇床连续振荡,模拟导管液体流动状态,3天即可形成不易剥离的生物膜,提示这些细菌在医用导管内定植快,易于形成生物膜,尤其是来源于应用呼吸机通气的通气管,鲍曼不动杆菌形成生物膜比率更高,导致 ICU患者呼吸道感染鲍曼不动杆菌呈逐年增多趋势。鲍曼不动杆菌在自然环境中普遍存在,具有较强粘附性,属于条件致病菌,置入性导管高感染率的重要原因可能与细菌导管中快速粘附、定植形成生物膜有关[7],这应引起我们足够的重视。
[1]Linda M.Weigel,Rodney M.Donlan,Dong Hyeon Shin,et al.High-level vancomycin-resistant Staphylococcus aureus Isolates associated with a polymicrobial biofilm[J].Antimicrob Agents Chemother,2007,51(1):231-238.
[2]刘新,梁宇寰,陈冬梅,等 .惰性材料表面细菌生物膜构建的研究 [J].中国微生态学杂志,2009,21(2):128-130.
[3]张丽萍,李清,古丽娜依明,等.葡萄球菌生物膜检测及与耐药性的关系 [J].右江医学,2008,36(3):253-254.
[4]王源,丛延广,刘俊康,等 .细菌胞外糖染色显微镜检测技术 [J].中华医学检验杂志,1998,21(4):197-198.
[5]Nural C,Melek D,Ilknur K,et al.Evaluation of biofilm production,gelatinase activity,and mannose-resistant hemagglutination in Acinetobacter baumannii strains[J].Microbiol Immunol Infect,2008,41:513-518.
[6]Naoko W,Junichiro N,Jalaluddin S,et al.Quantitative biofilm assay using a microtiter plate to screen for Enteroaggregative escherichia Coli[J].Am JTrop Med.Hyg,2004,71(5):687-690.
[7]岳文香,黄绍光,饶洁,等 .重症监护室鲍氏不动杆菌的分子流行病学 [J].中华传染病杂志,2002,20(2):108-109.

