量子点细胞毒性及其作用机制研究进展
陆敏玉,唐萌
(东南大学公共卫生学院,环境医学工程教育部重点实验室,江苏省生物材料与器件重点实验室,江苏南京 210009)
量子点(quantum dot,QD)是一种由Ⅲ ~Ⅴ族或Ⅱ~Ⅵ族元素组成的纳米微晶体,一般是以半导体材料为内核,外面包裹第 2种半导体材料来构成,可以接受激发产生荧光。典型的 QD尺寸为 2~10 nm,具有一些传统有机荧光染料所不具备的优点:荧光强度强,稳定性好,经修饰以后生物相容性较好[1-2];耐光性好,荧光寿命长,抗漂白能力强[3-5];用同一激发光源激发不同尺寸的 QD,可获得从蓝到红的一系列不同颜色的光[6-8],可同时静态或动态观察多种亚细胞结构,使得活体多色荧光成像成为可能;发射光谱窄且不拖尾,可减少给体与受体发射光谱的重叠,从而避免相邻通道的互相干扰而方便观察[9-11]。
QD的优异性能使之具有广泛的应用前景,如研究开发新型太阳能电池、发光器件、遗传物质的标记、细胞蛋白标记与跟踪、与磁性粒子结合对肿瘤进行可视化的磁热疗等等[12-17]。随着 QD的广泛应用,其毒性与生物安全性也得到了广大科技工作者的高度重视。国内外对 QD的细胞毒性及其作用机制方面有过较多的研究,作者就近 3年来国内外对多种 QD(如CdTe、CdSe、CdS、CdSe/SiO2等 )从表面修饰、粒径大小、暴露时间、暴露浓度及环境因素等方面对细胞毒性的影响及目前所公认的细胞毒性作用机制进行综述,同时指出 QD研究方面所存在的问题,并进一步对今后的研究进行展望。
1 QD的细胞毒性研究现状
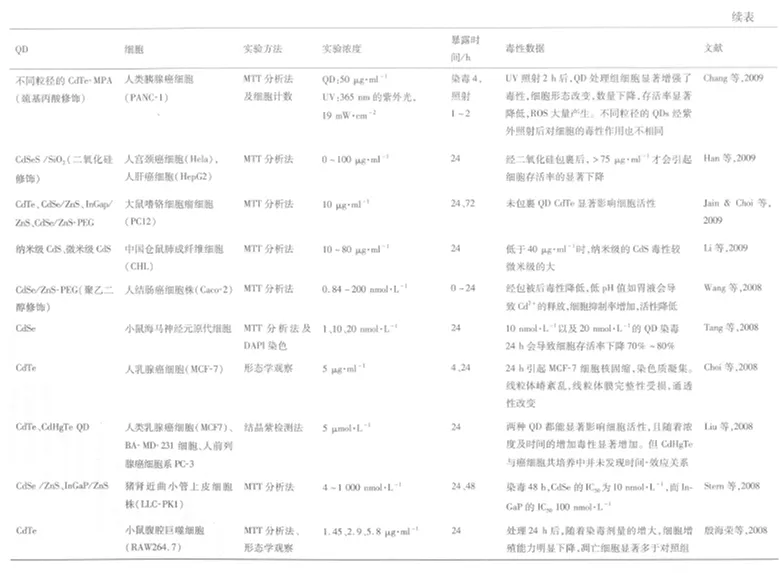
随着合成制备技术的改进,QD必将成为最有潜力的荧光标记物质,尤其是在活细胞和活体动物标记领域的应用。但是,目前 QD在生命科学领域的研究仍局限于实验室,临床及实际生活中的应用尚未推广。究其原因,主要是因为 QD是由重金属物质构成,其是否会对机体产生副作用,是否会对环境产生破坏作用,这一系列疑问至今未有定论。表 1中总结出了 2008年以来国内外对 QD细胞毒性的一系列研究。
已有的研究表明,QD表面修饰的不同、材料粒径的大小、暴露时间及浓度的不同、细胞摄入量的多少以及外界环境的变化均会导致其毒性的改变。因此,对QD进行生物安全性评价需要从多方面因素综合考虑,而不能简单将 QD定义为“有毒”或“无毒”。
1.1 表面修饰
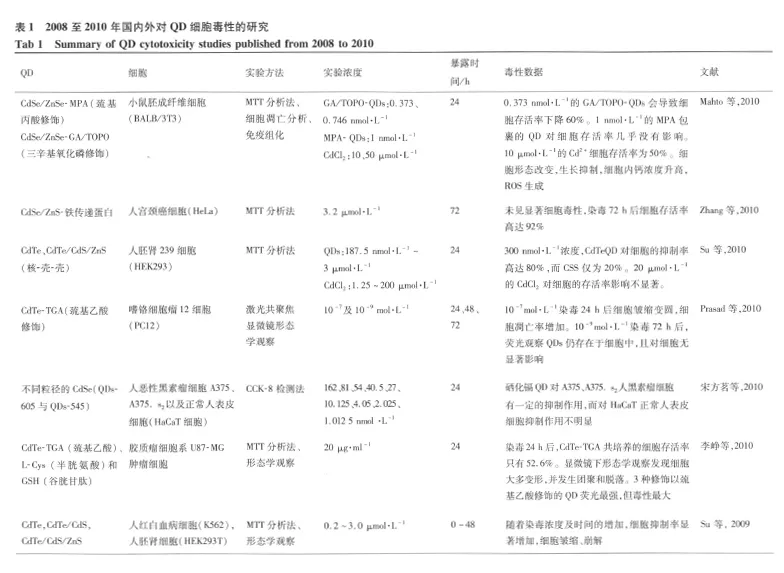
研究发现 QD的表面理化性质是影响其毒性的关键,已有不少课题组展开了对 QD表面修饰物的研究工作。Chan等[18]分析比较了未包裹 CdSe QD和硫化锌包裹的 CdSe QD的毒性大小,发现未包裹 CdSe QD可通过线粒体依赖性途径诱导人类神经母细胞瘤细胞的凋亡,引起一系列生化改变,如 JNK活化、线粒体膜电位丧失、活性氧(ROS)增加、Ras和 Raf-1蛋白表达抑制等等,而这些生化变化在硫化锌包裹的 CdSe QD染毒的细胞中则检测不到,表明对 QD表面包裹涂层如硫化锌能有效地降低毒性。Cho等[19]的研究也支持这个观点,10μg◦m l-1浓度下,与 CdSe/ZnSQD共培养的细胞存活率达 95%,而未包裹 CdTe QD共培养的细胞存活率均低于 40%,且不同化合物巯基丙酸、巯基乙胺、乙酰半胱氨酸修饰的 CdTe QD毒性也不一,以乙酰半胱氨酸修饰的 CdTe毒性最小。表面电荷的不同会影响物质与体内蛋白分子的相互作用,因此Guo等[20]对表面修饰不同电荷的 CdSe QD进行了研究,表明修饰中性粒子的 QD毒性较小。
Mahto等[21]于 2010年进一步对表面修饰的毒性进行了研究,发现不同修饰的 QD在细胞中的定位不同,共聚焦图像显示巯基乙胺 MPA包裹的 QD主要分布在胞质区,而 GA/TOPO(对表面配位基进行修饰)包裹的 QD在细胞中却没有发现。有趣的是,入胞的MPA-QD有良好的细胞相容性,而胞外的 GA/TOPOQDs细胞毒性却很大,会明显改变细胞形态,升高细胞内钙浓度,产生 ROS等。Zhang等[22]用 HeLa细胞评价了表面偶联铁传递蛋白的 CdSe/ZnSQD的毒性,发现其蛋白标记特异性较高且不会显著影响细胞活性。这些研究表明,表面修饰物质对 QD的毒性有显著的影响,且不同材料 QD的毒性机制仍需进一步研究,随着技术的发展,QD的合成修饰有望走向“绿色化、低毒化”,为 QD更广泛的应用奠定基础。
1.2 粒径大小
QD尺寸极小,较微米级颗粒物更易穿透细胞膜等生物屏障,且不同粒径的 QD在细胞中分布也不尽相同,因而其毒性作用也各有差异。最早于 2005年,Lovric等[23]以大鼠嗜铬细胞瘤细胞(PC12)和小鼠神经胶质细胞(N9)对 CdTe QD的毒性进行了研究,发现小的发绿色荧光的 CdTe QD可以通过核孔进入细胞核,而体积较大的发红色荧光 QD则分布于胞质中。10 g◦L-1浓度下,小粒径的 CdTe QD具有更加显著的细胞毒作用,可引起细胞染色质凝集和细胞膜空泡变性从而导致细胞死亡。2009年,Li等[24]研究结果再次证实粒径大小对其毒性的影响,低于 40μg◦ml-1时,纳米级的 CdSQD毒性显著大于微米级的 CdS。
1.3 暴露时间与暴露浓度
对于 QD的时间-效应与剂量-效应关系,研究者们一致认为随着时间的延长、剂量的增加,对细胞的毒性作用是呈正比的。2006年,Delehanty等[25]以人中肾细胞(HEK293T/17)和非洲绿猴肾细胞(COS-1)对表面连接有肽的 CdSe/ZnSQD进行了一系列研究,发现 60~250 nmol◦L-1浓度的 QD溶液作用 24 h后会对细胞产生显著的毒性作用,而作用 1 h的则几乎没有毒性作用,认为不同的作用时间会导致 QD的毒性产生差异。Choi等[26]的研究结果也得出了相似的结论,以 5μg◦m l-1浓度的 CdTe QD分别与人乳腺癌细胞(MCF-7)共培养 4 h和 24 h,发现染毒 24 h可引起MCF-7细胞核固缩、染色质凝集、线粒体嵴紊乱、线粒体膜通透性改变。Choi等研究过程中还发现低浓度的 CdTe与细胞共培养虽然会引起细胞轻微的染色质重组现象,但是细胞并没有进一步走向死亡程序,表明并未显著影响细胞活性。
Tang等[27]分别以 1 nmol◦L-1和 20 nmol◦L-1的未包被 CdSe QD溶液对小鼠海马神经元原代细胞进行染毒,发现 20 nmol◦L-1的 CdSe QD会引起细胞胞内钙稳态的失调,进而导致细胞死亡,而低浓度 QD溶液毒性较小,存在明显的剂量依赖关系。Liu等[28]以不同的细胞株对不同的 QD进行了系统研究,也证实其毒性大小与暴露浓度和暴露时间有关。因此合理控制这两个参数,可以在无毒作用或最低毒作用的条件下达到生物应用的目的。
1.4 环境因素
在实际研究过程中,研究者们会根据具体需要对QD进行包被或修饰,如偶联不同的功能基团、包裹不同的壳层从而改变 QD的物理、化学性质。这些修饰将会在一定程度上影响 QD结构的稳定性,进而影响QD在环境中的“状态”。Wang等[29]评估商用聚乙二醇包裹的 CdSe/ZnSQD的稳定性,发现环境低 pH值会导致 QD的完整性被破坏以及 Cd2+粒子的释放,使得 QD的毒性增加。
其他外界环境因素,如光照、溶剂等对 QD的毒性也具有一定的影响作用。Chang等[30]研究紫外线的照射对 MPA-CdTe QD毒性的影响,发现经紫外照射的 MPA-CdTe与细胞共培养后能显著抑制细胞活性,诱导 ROS的大量产生。Su等[31]发现非水溶性 QD制备过程中所残留的有机溶剂也有可能对细胞产生毒性作用。这些研究结果表明,降低 QD的毒性不仅要着重于材料本身的选择,还要充分考虑环境因素的交互作用。同时也表明,QD进入环境中可能会产生一些结构性的变化从而具有潜在危害,为新的研究指明了方向。
2 QD毒性作用机制
QD由于其尺寸、制备原料、合成方法的多样性,导致不同的 QD在化学性质上可能有较大的差异,其引起细胞毒性机制也复杂多样。目前公认的毒性机制归纳如下。
2.1 合成材料本身的毒性
QD进入生物体以后,被生物体微环境腐蚀、降解或氧化光解,如在胃液等低 pH条件下,连接体质子化后溶解发生核壳解离,使 QD稳定降低,释放金属离子,对细胞产生损伤作用。
2005年,Kirchner等[32]研究发现 QD溶液中游离的 Cd2+浓度与 QD的细胞毒性有关,之后人们曾一度关注于 Cd2+的释放所引起的毒性。众所周知,Cd2+可以通过与巯基的相互作用使线粒体蛋白失活,影响线粒体生化功能。Cd2+可以与 DNA直接作用,如与DNA分子中的磷酸、碱基等结合[33],对机体具有极大的危害性。国内外学者们对 QD的毒性与 Cd2+的相关性进行了一系列研究。CHO等[19]分析未包裹CdTe QD作用后的人乳腺癌细胞(MCF-7)中 Cd2+的浓度,发现与 CdTe QD共培养后细胞内 Cd2+浓度升高,表明 QD在培养液基质中缓慢释放出了重金属内核,从而对 MCF-7细胞产生了毒性作用。
2009年 Su等[34]设计了一系列实验,研究了 QD毒性与 Cd2+离子的关系,以 CdCl2溶液富含 Cd2+作为对照,发现经处理后细胞内 Cd2+离子浓度相同的情况下,CdTe的毒性远大于 CdCl2溶液。表明 Cd2+的确是QD毒性的重要影响因素,但是 QD的毒性不能仅仅归结于游离的 Cd2+离子。Stern等[35]制备了非重金属内核铟镓磷化物为内核的 QD(InGaP),并与 CdSe为核的 QD进行比较,发现 CdSe的毒性大约是 InGaP的10倍,100 nmol◦L-1的 InGaP也会显著降低细胞活性。因此,可以认为除了 Cd2+的释放,其他金属离子也是细胞受损的影响因素,且不同材料在细胞中的分布不同,其具体的毒性机制还有待更深入的研究。
2.2 活性氧(ROS)自由基产生的毒性
研究表明,自由基通过连锁反应可导致生物膜结构和功能的损伤,使膜蛋白流动性下降,脂质过氧化物含量增加,与膜脂交联形成高聚物,膜通透性改变。当自由基浓度达到一定程度时,自由基对细胞的作用除直接损伤细胞线粒体等超微结构,更重要的是造成DNA损伤,使得染色质凝集,细胞发生凋亡。Cd2+在有氧条件下可产生自由基,诱发细胞内脂质过氧化物生成,造成生物大分子氧化损伤,导致 DNA单链断裂。
2004年,Hoshino等[36]通过 SCGE技术检测出 QD能诱发 Vero细胞显著的 DNA损伤。2005年,Lovric等[23]发表文章认为 CdTe QD的细胞毒性作用是由胞内外环境中 ROS介导的细胞损伤所引起的,且实验证实可被抗氧化剂所拮抗。由此掀起了学术界对 QD细胞毒性与 ROS相关性的研究。Choi等[37]研究发现,CdTe QD可以引起成纤维瘤细胞脂质过氧化,并且可以诱导 Fas受体表达上调从而导致细胞凋亡。殷海荣等[38]探讨 CdTe对小鼠腹腔巨噬细胞 RAW 264.7凋亡和脂质过氧化水平的影响时发现,QD处理组细胞的增殖能力明显受到抑制,且 NO、MDA含量及 SOD活性显著上升。Tang等[39]研究也表明,QD细胞毒性是由于 ROS的产生,以及引起胞外钙内流、胞内钙释放对细胞造成损伤。由此可见,ROS自由基的产生是QD细胞毒性的重要机制之一。
3 QD的不足
(1)QD本身粒径极小,但经过修饰后可能会很大,可产生明显的空间位阻,在一定程度上限制其在分子生物学的应用。
(2)某些品种 QD的生产制备技术尚未完全成熟,由于其制备方法的多样性,加之成本较高,使得成品价格昂贵,因此推广不易。
(3)对 QD进入生物体后的长期毒性研究甚少,进入机体的稳定性、分散度、生物相容性等研究仍很匮乏,以至于尚不能应用于人体。
4 总结与展望
为了更深入地了解 QD的性能、毒性,从而将其更广泛地应用于各个领域,研究工作可从以下几个方面着手:
(1)QD合成工艺多元化。不同的合成原料、合成方法、表面修饰,导致 QD的种类繁多、毒性不一、机制不同。如何从源头降低 QD的毒性,而又保证其荧光性能是一个至关重要的问题。
(2)加强对 QD毒性标准的研究。研究所采用的条件,如实验细胞株、暴露浓度、暴露时间各不相同,无标准统一评价 QD的毒性大小。如何制定出统一标准对 QD的毒性进行定量研究迫在眉睫。
(3)增加 QD在各领域的应用。建立合适的模型,在基因、分子、细胞以及动物水平上进行研究,对经口、静脉、呼吸等多种暴露途径产生的毒作用效应进行研究,从不同领域如免疫系统、神经系统、生殖系统、毒物代谢动力学等多角度进行综合研究,以提高 QD的使用价值以及扩大 QD的应用范围。
(4)注意对环境的保护。由于某些 QD如镉本身就是有毒重金属,进入环境中会有潜在的危害,但是防止 QD对生态环境及人类健康损害的保护措施并未出台。如何防止商品化 QD产物泄漏对环境的影响以及如何处理实验室废弃 QD也是人们应该关心的问题。
综上所述,若想真正实现 QD在各领域的广泛应用,就需要从各方面来考虑如何降低其毒性,增加其生物相容性和水溶性,进一步完善其生物效应和安全性评价,并制定相关措施防止 QD对生态环境造成影响,真正实现“绿色科技”。
[1]TUC,MA X,PANTAZIS P,etal.Paramagnetic,silicon quantum dots formagnetic resonance and two-photon imaging ofmacrophages[J].JAm Chem Soc,2010,132(6):2016-2023.
[2]HSIEH SC,WANG F F,LIN C S,et al.The inhibition of osteogenesiswith human bonemarrow mesenchymal stem cells by CdSe/ZnSquantum dot labels[J].Biomaterials,2006,27(6):1656-1664.
[3]HILDERBRAND SA,WEISSLEDER R.Near-infrared fluorescence:app lication to in vivo molecu lar imaging[J].Curr Opin Chem Biol,2010,14(1):71-79.
[4]HAN R,YU M,ZHENG Q,et al.A facile synthesis of small-sized,highly photoluminescent,and monodisperse Cd-SeSQD/SiO(2)for live cell imaging[J].Langmuir,2009,25(20):12250-12255.
[5]YONGK T,ROY I,DINGH,etal.Biocompatib le near-infrared quantum dots as ultrasensitive probes for long-term in vivo imaging applications[J].Small,2009,5(17):1997-2004.
[6]WU C,SHIL,LIQ,etal.Probing the dynamic effectof cys-CdTe quantum dots toward cancer cells in vitro[J].Chem Res Toxicol,2010,23(1):82-88.
[7]PRADHAN N,BATTAGLIA D M,LIU Y C,etal.Efficient,stable,small,and water-soluble doped ZnSe nanocrystalemitters as non-cadm ium biomedical labels[J].Nano Lett,2007,7(2):312-3l7.
[8]COSTA-FERNANDEZ JM,PEREIROR,SANZ-MEDEL A,et al.The use of luminescent quantum dots for opticalsensing[J].Trends Analyt Chem,2006,25(3):207-218.
[9]王璐,王德平,黄文显,等.水相制备硒化镉半导体 QD的荧光性能[J].硅酸盐学报,2005,33(10):1223-1230.
[10]PELLEY J L,DAAR A S,SANER M A.State of academic know ledge on toxicity and biological fate of quantum dots[J].Toxicol Sci,2009,112(2):276-296.
[11]RON H.A toxicologic review of quantum dots:toxicity depends on physicochem icaland environmental factors[J].Environ Health Perspect,2006,114(2):165-171.
[12]MEDINTZ IL,UYEDA H T,GOLDMAN ER,et al.Quantum dot bioconjugates for imaging,labelling and sensing[J].Nat Mater,2005,4(6):435-446.
[13]CHEN L D,LI Y,YUAN H Y,et al.Quantum dots and their app lications in cancer research[J].Cancer,2005,25:651-656.
[14]GAO X H,CHUNG LW,NIE SM.Quantum dots for in vivo molecular and cellularimaging[J].Methods Mol Biol,2007,374:135-146.
[15]YUW W,CHANG E,FALKNER JC,et al.Forming biocom patible and nonaggregated nanocrystals in water using amphiphilie polymers[J].Abstr Pap Am Chem Soc,2007,129(10):2871-2879.
[16]胡亮,周家华,余泽前,等.纳米免疫磁珠联合 RT-nest-PCR法检测胰腺癌外周血微转移的敏感度及特异性[J].东南大学学报:医学版,2009,28(4):287-290.
[17]周颐,姜藻,顾晓怡.磁性纳米四氧化三铁协同顺铂作用于肺癌A 549细胞的初步研究[J].东南大学学报:医学版,2009,28(4):297-301.
[18]CHANW H,SHIAO N H,LU P Z.CdSe quantum dots induce apoptosis in human neuroblastomacells via mitochondrial-dependentpathways and inhibition of survival signals[J].Toxicol Lett,2006,167(3):191-200.
[19]CHO SJ,MAYSINGER D,JAIN M,etal.Long-term exposure to CdTe quantum dots causes functional impairments in live cells[J].Langmuir,2007,23:1974-1980.
[20]GUO G N,LIUW,LIANG JG,et al.Probing the cytotoxicity of CdSe quantum dots with surface modification[J].Mater Lett,2007,61(8/9):1641-1644.
[21]MAHTO SK,PARKC K,YOON TH,etal.Assessmentof cytocompatibility of surface-modified CdSe/ZnSe quantum dots for BALB3T3 fibrob last cells[J].Toxicol In Vitro,2010,24(4):1070-1077.
[22]ZHANG H L,LIY Q,WANG JH,etal.Specialmethod to prepare quantum dot p robeswith reduced cytotoxicity and increased optical property[J].JBiomed Opt,2010,15(1):1-8.
[23]LOVRIC J,BAZZIH S,CUIE Y,et al.Differences in subcellu lar distribution and toxicity of green and red emitting CdTe quantum dots[J].JMol Med,2005,83(5):377-385.
[24]LI K G,CHEN J T,BAI S S,et al.Intracellular oxidative stress and cadmium ions release induce cytotoxicity of unmodified cadm ium sulfide quantum dots[J].Toxicology In Vitro,2009,23(6):1007-1013.
[25]DELEHANTY JB,MATTOUSSIH,MEDINTZ IL.Self-assemb led quantum dot-peptide bioconjugates for selective intracellular delivery[J].Bioconjug Chem,2006,17(4):920-927.
[26]CHOI A O,BROWN SE,SZYF M,et al.Quantum dot-induced epigenetic and genotoxic changes in human breast cancer cells[J].JMol Med,2008,86(3):291-302.
[27]TANG M L,XING T R,ZENG J,et al.Unmodified CdSe quantum dots induce elevation of cytoplasmic calcium levels and impairment of functional properties of sodium channels in rat p rimary cu ltured hippocampal neurons[J].Environ Health Perspect,2008,116(7):915-922.
[28]LIU L,ZHANG J,SU X,etal.In vitro and in vivo assessment of CdTe and CdHgTe toxicity and clearance[J].JBiomed Nanotechnol,2008,4(4):524-528.
[29]WANG L,NAGESHA D K,SELVARASAH S,etal.Toxicity of CdSe nanoparticles in Caco-2 cell cultures[J].J Nanobiotechnol,2008,6(11):1-15.
[30]CHANG SQ,DAIY D,KANG B,etal.UV-enhanced cytotoxicity of thiol-capped CdTe quantum dots in human pancreatic carcinoma cells[J].Toxicol Lett,2009,188(2):104-111.
[31]SU Y,HE Y,LU H,et al.The cytotoxicity of cadmium based,aqueous phase-Synthesized,quantum dots and its modu lation by surface coating[J].Biomaterials,2009,30(1):19-25.
[32]KIRCHNERC,LIEDL T,KUREDA S,et al.Cytotoxicity of colloidal CdSe and CdSe/ZnSnanoparticles[J].Nano Lett,2005,5(2):331-338.
[33]叶记林,毛伟平,吴爱莲,等.镉诱导HEK293细胞凋亡及其线粒体凋亡途径[J].分子细胞生物学,2007,40(1):7-16.
[34]SU Y,HU M,FANC,etal.The cytotoxicity of CdTe quantum dots and the relative contributions from released cadm ium ions and nanoparticle properties[J].Biomaterials,2010,31(18):4829-4834.
[35]STERN S T,ZOLNIK B S,MCLELAND C B,etal.Induction ofautophagy in porcine kidney cells by quantum dots:a common cellular response to nanomaterials[J].Toxicol Sci,2008,106(1):140-152.
[36]HOSH INO A,FUJIOKA K,OKU T,et al.Physicochem ical properties and cellular toxicity of nanocrystal quantum dots depend on their surfacemodification[J].Nano Lett,2004,4(11):2163-2169.
[37]CHOIA O,CHO S J,DESBARATS J,et al.Quantum dotinduced cell death involves Fas upregulation and lipid peroxidation in human neurob lastoma cells[J].JNanobiotechnology,2007,5:1-13.
[38]殷海荣,唐萌,夏婷,等.量子点 CdTe对 RAW264.7细胞凋亡和脂质过氧化水平的影响[J].中国现代医学杂志,2008,18(18):2593-2596.
[39]TANG M L,WANGM,XINGT R,et al.Mechanisms of unmodified CdSe quantum dot-induced elevation of cytoplasmic calcium levels in primary cultures of rat hippocampal neurons[J].Biomaterials,2008,29(33):4383-4391.

