转录因子EGR-3在肝细胞肝癌中的表达及意义
靳江,孙世仁,聂勇战,刘杰,樊代明
转录因子EGR-3在肝细胞肝癌中的表达及意义
靳江,孙世仁,聂勇战,刘杰,樊代明
【摘要】
目的研究早期生长反应基因(EGR-3)在肝癌组织中的表达,并探讨其在肝癌发生发展中的作用。
方法选取 125 例肝癌及癌旁组织、5 例正常肝组织标本,采用免疫组织化学方法检测标本中 EGR-3 的表达分布,并分析其与肝癌临床病理因素的关系。另提取 15 例新鲜肝癌及相应癌旁组织标本和人肝癌 HepG2、HepG2.2.15、SMMC7721、FHCC98 细胞的总蛋白,采用蛋白质印迹法检测 EGR-3 的表达水平。
结果①免疫组织化学检测结果显示,EGR-3 在肝癌组织中的表达阳性率(30/125,24%)明显低于癌旁组织(100/125,80%)(χ2= 72.5,P < 0.001);EGR-3 主要表达于肝癌组织的细胞质中,而在癌旁组织的细胞质和细胞核均有表达;此外,EGR-3 在肝癌组织中的表达强弱与患者年龄、性别以及肿瘤大小、肿瘤分化程度等均无明显相关性(P > 0.05);②蛋白质印迹技术检测结果也显示 EGR-3 在肝癌组织中的表达水平均明显低于相应癌旁组织(P < 0.05);EGR-3 在4 种肝癌细胞系中都有表达,并在 HepG2.2.15 细胞中表达水平最高。
结论EGR-3 在肝癌组织中的表达明显低于癌旁组织,推测其与肝癌的发生密切相关,为肝癌的临床诊断提供了线索。
【关键词】转录因子; 早期生长反应转录因子类; 癌,肝细胞; 印记法,蛋白质
www.cmbp.net.cn 中国医药生物技术, 2010, 5(3):191-195
肝癌是我国最常见的恶性肿瘤之一,是我国位居第二的癌症“杀手”,但是其发病机制至今尚不明确[1]。早期生长反应基因(EGR)是一类能被多种刺激比如缺氧、感染等快速诱导产生的转录因子[2-3],是即刻早期基因转录因子(immediate early genes-transcription factors,IEG-TF)家族中的一员,该家族共包括 EGR-1、EGR-2、EGR-3、EGR-4 共4 个家庭成员,其共同特点是都含有一个高度保守的可以和 DNA 结合的结构域,该结构域由三个Cys2His2 锌指结构组成,能特定识别并与其下游调控基因的启动子区 GCG(G/T)GGGCG 序列结合,从而发挥转录调控作用[4-5]。其中 EGR-1 与肿瘤的发生、发展和侵袭有着密切的关系,但 EGR-3与消化系统肿瘤的相关研究目前尚未见报道(根据PubMed 数据库检索)。基于此,本研究应用蛋白质印迹法和免疫组织化学方法检测转录因子 EGR-3在人肝细胞肝癌组织中的表达状况,以探讨其在肝癌发生发展中的作用及临床诊断意义。
1 材料与方法
1.1 材料
1.1.1 标本来源 125 例肝癌及癌旁组织、5 例正常肝组织(2006 年 1 月至 2009 年 1 月手术切除标本)和 15 例新鲜肝癌及相应癌旁组织标本均取自第四军医大学西京消化病医院病理科。125 例患者中,男性 100 例,女性 25 例,年龄 35 ~ 84 岁,中位年龄 50 岁,平均年龄 54 岁。所有病例术前均未经放疗及化疗,其中 125 例肝癌及癌旁组织、5 例正常肝组织标本取材后经 4% 甲醛固定、脱水,常规石蜡包埋,制成 5 μm 厚连续切片。
1.1.2 细胞系 人肝癌 HepG2、HepG2.2.15、SMMC7721、FHCC98 细胞均为第四军医大学西京消化病医院肿瘤生物实验室保存,均培养在含 10%胎牛血清的 DMEM 培养基中。
1.1.3 试剂 兔抗人 EGR-3 多克隆抗体(SC-191)、HRP 标记的山羊抗兔 IgG 抗体和兔抗鼠 IgG 抗体均购自美国 Santa Cruz 公司;En Vision 试剂购自丹麦 Dako 公司;小鼠抗 β-肌动蛋白(β-actin)单克隆抗体购自美国 Sigma 公司。
1.2 方法
1.2.1 EGR-3 的表达分布 采用免疫组织化学En Vision 法检测。125 例肝癌及癌旁组织、5 例正常肝组织切片常规脱蜡脱水;EDTA 缓冲液微波修复 10 min,3% H2O2处理 15 min,消除内源性过氧化物酶;PBS 洗 5 min × 3 次;室温正常山羊血清封闭 1 h,甩干多余血清;滴加兔抗人 EGR-3多克隆抗体(1∶50),用 PBS 代替一抗作为阴性对照,4 ℃ 冰箱过夜。第 2 天用 PBST 洗 5 min × 2 次,再用 PBS 洗 5 min × 2 次;滴加 En Vision试剂(原液)室温孵育 30 min,PBST 洗 5 min × 2 次,再用 PBS 洗 5 min × 2 次;经 DAB 显色1 min 后,自来水冲洗 30 min,苏木素复染细胞核,自来水冲洗,梯度酒精水化,二甲苯透明,中性树脂封片。
1.2.2 结果判定 以细胞质或细胞核中出现清晰的黄色、棕黄色颗粒为 EGR-3 表达阳性。镜下观察染色阳性细胞数和染色强度,根据染色阳性细胞数和染色强度评分之和判定各标本的染色结果。染色阳性细胞数评分:0 分,阳性细胞比例为 0;1 分,阳性细胞比例为 1% ~ 25%;2 分,阳性细胞比例为 26% ~ 50%;3 分,阳性细胞比例为 51% ~100%。染色强度评分:0 分,阴性(细胞无着色);1 分,弱阳性(着色颗粒呈黄色);2 分,中等阳性(着色颗粒呈棕色);3 分,强阳性(着色颗粒呈深褐色)。染色结果判定:≥ 3 分,强阳性(++);< 3 分,弱阳性(–/+)。
1.2.3 组织总蛋白的提取 15 例新鲜肝癌组织及相应癌旁组织分别添加蛋白裂解液(150 mmol/L NaCl、0.1% SDS、1% TritonX-100、5 μg/ml 抑肽酶、20 mmol/L Tris-HCl,pH7.4),该操作在冰上完成。4 ℃ 10 000 × g 离心 10 min,Bradford 法测定蛋白浓度。分装后储于 –70 ℃ 备用。
1.2.4 细胞总蛋白的提取 分别收获对数生长期人肝癌 HepG2、HepG2.2.15、SMMC7721、FHCC98细胞约 5 × 106,以 0.1 mol/L 冷 PBS(pH7.4)离心洗涤并重悬 2 次;加入 100 μl 细胞裂解液(含1% NP-40、50 mmol/L Tris-HCl、150 mmol/L NaCl、1% SDS、5% 去氧胆氨酸、0.1 mmol/L PMSF 和1 mg/L 抑肽酶)重悬细胞并反复吹打 3 ~ 5 min,混匀后于 4 ℃ 冰浴 30 min,4 ℃ 12 000 × g 离心10 min,取上清作为细胞总蛋白,采用 Bradford 法测定样品蛋白浓度。分装后储于 –70 ℃ 备用,同时以牛血清白蛋白作为标准品。
1.2.5 EGR-3 蛋白表达检测 取蛋白行 10% SDS-PAGE 后,电转移法将蛋白质转移至硝酸纤维素(NC)膜上,10% 脱脂奶粉室温封闭 2 h。加入 2% 脱脂奶粉稀释的兔抗人 EGR-3 多克隆抗体(1∶500),以加入小鼠抗 β-actin 单克隆抗体(1∶5000)作为内参照,4 ℃ 孵育过夜。TBST(含10 mmol/L Tris-HCl、150 mmol/L NaCl、0.05% Tween-20,pH8.0)摇洗 3 次 × 15 min。分别加入2% 脱脂奶粉稀释的 HRP 标记的山羊抗兔 IgG抗体(1∶2000)和兔抗鼠 IgG 抗体(1∶3000),室温孵育 1 ~ 2 h 后,TBST 摇洗 4 次 × 15 min;ECL 显色。采用 Bandscan 5.0 凝胶图像分析软件测定计算目的蛋白条带与对应 β-actin 条带的吸光度积分灰度值之比,确定目的蛋白表达水平。实验重复 3 次。
1.3 统计学处理
采用 SPSS13.0 统计学软件进行数据的统计分析。免疫组化与临床病理因素之间关系采用 χ2检验分析,以 P < 0.05 为差异有统计学意义。
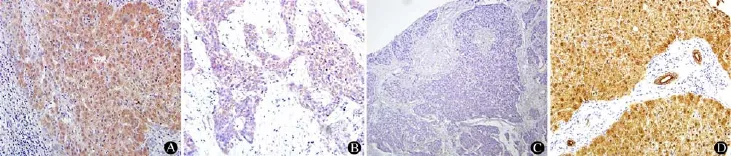
图 1 肝癌及癌旁组织、正常肝组织标本中 EGR-3 表达的免疫组织化学检测 En Vision × 200(A:癌旁组织细胞质和细胞核中 EGR-3 呈阳性表达;B:肝癌组织细胞质中 EGR-3 呈阳性表达;C:肝癌组织 PBS 阴性对照;D:正常肝组织细胞质和细胞核中 EGR-3 呈强阳性表达)Figure 1 Immunohistochemistry of the expression of EGR-3 in HCC tissues, adjacent nontumor liver tissues, and normal liver tissues (En Vision × 200). A: Positive expression of EGR-3 in the cytoplasm and nucleus of adjacent nontumor liver tissues; B: Positive expression of EGR-3 in the cytoplasm of HCC tissues; C: Negative control of HCC tissues; D: Strong positive expression of EGR-3 in the cytoplasm and nucleus of normal liver tissues.

表 1 EGR-3在肝癌和癌旁组织中的表达Table 1 Expression of EGR-3 in HCC tissues and adjacent nontumor liver tissues
2 结果
2.1 EGR-3 在肝癌及癌旁组织中的表达分布
125 例肝癌组织中,30 例高表达 EGR-3,约占总例数的 24%(30/125),其中 EGR-3 主要表达于细胞质中,细胞核中几乎没有表达;95 例EGR-3 呈低表达或不表达。125 例癌旁组织中,100例高表达 EGR-3,约占总例数的 80%(100/125),EGR-3 在细胞质和细胞核均有表达,且大多呈强阳性颗粒样染色;25 例 EGR-3 呈低表达或不表达。由此可见肝癌组织中 EGR-3 的表达明显低于其在癌旁组织中的表达(χ2= 72.5,P < 0.001)(图 1,表 1)。
在 5 例正常肝组织中,EGR-3 在细胞质和细胞核中均呈强阳性表达。
2.2 EGR-3 表达与肝癌临床病理因素的关系
将患者按性别、年龄以及肿瘤大小、肿瘤分化程度分组进行 EGR-3 表达阳性率比较,结果显示EGR-3 在肝癌组织中的表达强弱与患者年龄、性别以及肿瘤大小、肿瘤分化程度等均无明显相关性(P > 0.05)(表 2)。
2.3 EGR-3 在肝癌及癌旁组织中的表达水平
应用蛋白质印迹技术检测 15 例新鲜肝癌及相应癌旁组织,结果显示 EGR-3 在 13 例肝癌组织中的表达均明显低于相应癌旁组织(图 2、3)(P < 0.05),这与免疫组织化学的检测结果相一致。
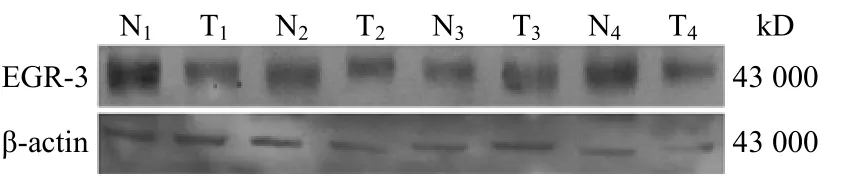
图 2 4 例肝癌及相应癌旁组织中EGR-3表达的蛋白质印迹检测Figure 2 Expression of EGR-3 protein in four cases of HCC tissues and matched adjacent nontumor liver tissues detected by Western blot

图 3 4 例肝癌及相应癌旁组织中 EGR-3 的表达水平(a与相应癌旁组织相比,P < 0.05)Figure 3 Expression level of EGR-3 in four cases of HCC tissues and matched adjacent nontumor liver tissues.aCompared with the matched adjacent nontumor liver tissues, P < 0.05
2.4 EGR-3 蛋白在肝癌细胞系中的表达
应用蛋白质印迹技术检测人肝癌 HepG2、HepG2.2.15、SMMC7721、FHCC98 细胞中 EGR-3蛋白的表达,结果显示其在肝癌细胞系中都有表达;并在 HepG2.2.15 细胞中表达水平最高,FHCC98
细胞中表达水平最低(图 4)。而 HepG2.2.15细胞是支持 HBV 复制的肝癌细胞系,说明 EGR-3与病毒复制有关。
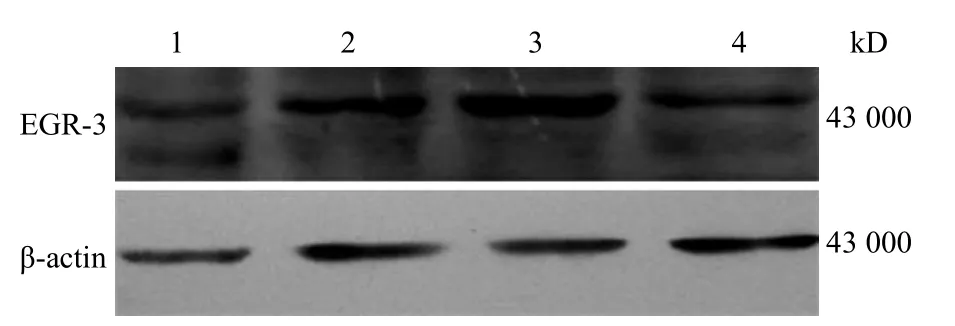
图 4 人肝癌细胞系中 EGR-3 表达的蛋白质印迹检测Figure 4 Expression of EGR-3 protein in human liver cancer cell lines detected by Western blot
3 讨论
IEG-TF 家族中 EGR-1、EGR-2、EGR-3、EGR-4 分子,除 DNA 结合区域以外的侧翼序列并不相同,因此发挥的生物学功能也各不相同[3]。自 1991 年报道 EGR-3 至今,相关的研究主要集中在神经科学、免疫学和病毒学方面[5]。有研究发现 EGR-3 主要表达于大脑皮层、海马、基底神经节、视交叉神经核以及肌梭中[6-7]。
本研究发现 EGR-3 在肝癌组织中的表达明显低于癌旁组织,其在肝癌组织主要表达于细胞质中,而在正常组织的细胞质和细胞核中均呈高表达。但还有研究发现 EGR-3 在胆管细胞中也呈高表达,Yoo 和 Lee[8]报道乙型肝炎病毒 X(HBX)蛋白通过增强 EGR-2、EGR-3 的转录活性进而促进 fasL 在肝癌细胞中的表达,诱导 T 细胞凋亡,从而导致肿瘤细胞的免疫逃避;同时证明了在HBV 相关的肝癌细胞诱导 fasL 的表达方面,EGR-3 是最有潜力的一个转录因子。这也间接的解释了本实验肝癌细胞系的蛋白质印迹检测结果,即EGR-3 在 HepG2.2.15 细胞中表达水平最高。但是对于不含 HBX 的肝癌细胞,其发挥的作用及信号通路可能不同。本实验中,EGR-3 在 4 种肝癌细胞系都有表达,说明 EGR-3 普遍存在于肝癌细胞中,但以 HepG2.2.15 为最高,因为其内有 HBV复制及 HBX 的影响。这也与 Yoo和 Lee[8]的研究没有冲突,他们所用是人肝脏 Chang 细胞和转染 HBX 基因的人肝脏 ChangX-34 细胞,发现肝癌细胞中 fasL 的表达升高,但他们并没有检测EGR-3 在 HepG2 细胞中的表达情况;另外他们主要对体外细胞系中机制进行了研究,通过荧光素酶报告基因,证实 pVP16-HBX 同 pGal4-EGR-2、pGal4-EGR-3 分别共转染 HepG2 细胞,荧光素酶活性显著升高,说明 HBX 是通过 EGR-2 和EGR-3 发挥作用。本实验主要是在临床标本中发现EGR-3 在肝癌组织中的表达低于癌旁组织,并且其主要集中表达在肝癌组织的细胞质中,而转录因子在核内才能发挥作用,这一现象说明核转位与肿瘤的形成可能相关。EGR-3 作为转录因子作用广泛,不可能仅通过一条信号通路发挥作用,其可能的作用机制尚需进一步实验探讨。
此外,免疫组化结果还显示 EGR-3 的表达与患者年龄、性别、肿瘤的分化程度以及大小等无关。主要原因是 EGR-3 在肝癌组织中为低表达,故分析其表达与肿瘤分化程度不相关。
最新有文献报道 EGR-3 与新生血管生成有密切关系,VEGF 可以激活 EGR-3,进一步促使活化 T 细胞核因子(NFATc)、血清反应因子(SRF)和 cAMP 效应元件结合(CREB)因子分别与EGR-3 上游启动子区结合,促进新生血管的生成,而降低 EGR-3 表达可以抑制内皮细胞的增殖、迁移和血管形成,表明 EGR-3 是 VEGF 激活内皮细胞信号通路中的关键因子之一,并在黑色素瘤实验中得以验证[9-10]。本实验研究对象是消化道肿瘤,结果显示 EGR-3 在肝癌组织中的表达低于癌旁组织,蛋白质印迹检测和免疫组织化学染色的结果基本一致,这也进一步肯定了本研究结果。比较其他肿瘤研究,认为 EGR-3 发挥作用可能具有组织特异性,推测其在肝脏组织中可能是通过其他信号通路发挥功能,或者在肿瘤发展过程中具有双重作用,可在不同环境下发挥抑癌或者促癌作用。
目前关于转录因子 EGR-3 与肿瘤的研究较少,其在肿瘤发生发展中的作用机制尚不清楚,这也促使我们对此有必要继续深入探索。
参考文献
[1] Li X, Pan Y, Fan R, et al. Adenovirus-delivered CIAPIN1 small interfering RNA inhibits HCC growth in vitro and in vivo. Carcinogenesis, 2008, 29(8):1587-1593.
[2] Worden B, Yang XP, Lee TL, et al. Hepatocyte growth factor/scatter factor differentially regulates expression of proangiogenic factors through Egr-1 in head and neck squamous cell carcinoma. Cancer Res, 2005, 65(16):7071-7080.
[3] Grotegut S, von Schweinitz D, Christofori G, et al. Hepatocyte growth factor induces cell scattering through MAPK/Egr-1-mediated upregulation of Snail. EMBO J, 2006, 25(15):3534-3545.
[4] Droin NM, Pinkoski MJ, Dejardin E, et al. Egr family members regulate nonlymphoid expression of Fas ligand, TRAIL, and tumor necrosis factor during immune responses. Mol Cell Biol, 2003, 23(21): 7638-7647.
[5] Patwardhan S, Gashler A, Siegel MG, et al. EGR3, a novel member of the Egr family of genes encoding immediate-early transcription factors. Oncogene, 1991, 6(6):917-928.
[6] Gallitano-Mendel A, Izumi Y, Tokuda K, et al. The immediate early gene early growth response gene 3 mediates adaptation to stress and novelty. Neuroscience, 2007, 148(3):633-643.
[7] Tourtellotte WG, Keller-Peck C, Milbrandt J, et al. The transcription factor Egr3 modulates sensory axon-myotube interactions during muscle spindle morphogenesis. Dev Biol, 2001, 232(2):388-399.
[8] Yoo YG, Lee MO. Hepatitis B virus X protein induces expression of Fas ligand gene through enhancing transcriptional activity of early growth response factor. J Biol Chem, 2004, 279(35):36242-36249.
[9] Liu D, Evans I, Britton G, et al. The zinc-finger transcription factor, early growth response 3, mediates VEGF-induced angiogenesis. Oncogene, 2008, 27(21):2989-2998.
[10] Suehiro J, Hamakubo T, Kodama T, et al. Vascular endothelial growth factor activation of endothelial cells is mediated by early growth response-3. Blood, 2009, 115(12):2520-2532.
ObjectiveTo discuss the expression of early growth factor-3(EGR-3) in hepatocellular carcinoma(HCC), and investigate its role in the development of HCC.
MethodsImmunohistochemistry method was used to detect the expression and distribution of EGR-3 in 125 cases of HCC tissues and adjacent nontumor liver tissues samples, and 5 cases of normal liver tissues samples. To analyze the relationship between EGR-3 expression and clinicopathological factors in HCC. Western blot was also applied to detect the expression level of EGR-3 in the total protein of 15 cases of fresh HCC tissues and matched adjacent nontumour liver tissues samples, and four human hepatoma cell lines of HepG2, HepG2.2.15, SMMC7721, FHCC98 cells.
Results①The results of Immunohistochemistry showed that the positive expression ratio of EGR-3 in HCC tissues (30/125, 24%) was significantly lower than that in adjacent nontumor liver tissues (100/125, 80%) (χ2= 72.5, P < 0.05); EGR-3 was mainly expressed in the cytoplasm of HCC tissues, and expressed both in the cytoplasm and nucleus of adjacent nontumor liver tissues; In addition, the expression of EGR-3 was not associated with patient’s gender, age, and tumor size and differentiation (P > 0.05); ②The results of Western blot showed that the expression level of EGR-3 in HCC tissues was also significantly lower than that in matched adjacent nontumour liver tissues (P < 0.05); EGR-3 expressed both in four human hepatoma cell lines, and it expressed at a higher level in HepG2.2.15 cell line than others.
ConclusionThe expression of EGR-3 in HCC tissues was significantly lower than that in adjacent nontumor liver tissues, EGR-3 may be closely associated with the development of HCC, and to provide a clue for clinical diagnosis of hepatocellular carcinoma.
【Key words】Transcription factors; Early growth response transcription factors; Carcinoma, hepatocellular; Blotting, western
Author Affiliation:State Key Laboratory of Tumor Biology (JIN Jiang, NIE Yong-zhan, LIU Jie, FAN Dai-ming), Department of Nephrology (SUN Shi-ren), Xijing Hospital of Digestive Diseases, Fourth Military Medical University, Xi’an 710032, China
Corresponding Authors: LIU Jie, Email: jieliu28@hotmail.com; FAN Dai-ming, Email: fandaim@fmmu.edu.cn www.cmbp.net.cn Chin Med Biotechnol, 2010, 5(3):191-195
作者单位:710032 西安,第四军医大学西京消化病医院肿瘤生物学国家重点实验室(靳江、聂勇战、刘杰、樊代明),肾脏内科(孙世仁)
通讯作者:刘杰,Email:jieliu28@hotmail.com;樊代明,Email:fandaim@fmmu.edu.cn
收稿日期:2010-02-25
DOI:10.3969/cmba.j.issn.1673-713X.2010.03.006
The expression of transcription factor EGR-3 in hepatocellular carcinoma
JIN Jiang, SUN Shi-ren, NIE Yong-zhan, LIU Jie, FAN Dai-ming
【Abstract】

