共患糖尿病的抑郁症患者皮质醇分泌节律的对照研究
仲爱芳,王晓辉,何益民,宋梓祥,陈 琪,徐乐平
(解放军第102医院检验科,江苏 常州 213003)
近有研究发现,抑郁症患者中糖尿病有高发趋势[1,2]。糖尿病的发生增加了患者的治疗难度,并显著加重了经济负担,但目前对共病的发生原因尚无定论。一些研究者提出假说[3,4],认为抑郁患者存在的下丘脑-垂体-肾上腺 (hypothalamic-pituitary-adrenal,HPA)轴功能异常,可能是抑郁患者中糖尿病发生的重要病理机制,但尚未得到有效的验证。我们试图通过对共病患者皮质醇节律的研究,为此提供依据。
材料与方法
1对象 均为2007年1月至2008年7月解放军第102医院精神科的住院患者。入组标准:(1)年龄18~60岁;(2)符合中国精神障碍分类与诊断标准第3版的复发性抑郁症(抑郁发作次数≥2次)诊断标准,17项汉密尔顿抑郁量表(HAMD17)评分≥18分;(3)无精神病性症状;(4)体质指数(BMI)在中国人正常范围内(18.5~23.9 kg/m2)[5];(5)研究前 6 月内无重大的应激性生活事件;(6)研究前至少2周,未使用过可能影响HPA轴功能的药物(如抗抑郁药、神经阻滞剂、糖皮质激素等)、影响血糖水平的药物(口服降糖药、胰岛素)。排除标准:(1)同时患有高血压、恶性肿瘤、糖尿病以外的其他内分泌疾病、脑器质性疾病者;(2)妊娠期女性。均获本人及监护人签署的知情同意书,共60例。根据患者是否同时伴发糖尿病分为2组,每组30例(男、女性各15例),两组间的年龄、性别相互匹配。
1.1 共患糖尿病的抑郁症组 (病例组) 为根据WHO标准,首次确诊糖尿病的抑郁症患者,诊断标准为空腹血糖 (FPG)≥7.8mmol/L和/或糖负荷后2小时血糖(2hPG)≥11.1mmol/L。年龄平均(44.1±5.0)岁;BMI平均(21.7±1.6)kg/m2;抑郁症病程 2~36 月,中位数12月;本次抑郁发作病期0.5~3.5月,中位数1.4月;汉密尔顿抑郁量表(HAMD17)评分(29.2±5.7)分;有抗抑郁药物治疗史者14例,无治疗者16例;FPG 平均(7.6±1.6)mmol/L,2hPG 平均(14.6±2.8)mmol/L。
1.2 正常糖代谢的抑郁症组 (对照组):为根据WHO标准,有正常空腹血糖(FPG<5.6mmol/L)、正常糖耐量(2hPG<7.8mmol/L)的抑郁症患者。年龄平均(43.0±8.8)岁;体质指数(BMI)(21.3±1.9)kg/m2;抑郁症病程5~60月,中位数18月;本次抑郁发作病期0.7~3.0月,中位数 1.7 月;HAMD17 评分(28.5±5.9)分;有抗抑郁药物治疗史者17例、无治疗史者13例;FPG 平均 (5.2±0.5)mmol/L,2hPG 平均 (6.3±1.4)mmol/L。
上述资料中,病例组FPG、2hPG均显著高于对照组(均P=0.000);其余各项的组间差异无显著性(均P>0.05)。
2方法
2.1 皮质醇分泌节律测定 于受试者入组后的第3天进行。方法为患者同日内抽取静脉血3次(试验当日 8:00、16:00、24:00),注入肝素抗凝管备测;本测定以前,受试者暂没有接受抗抑郁药物治疗,可予认知治疗、注意加强监护,有失眠者可选用阿普唑仑(0.4~0.8)mg/d,睡前顿服。放射免疫法测定皮质醇,试剂盒由北京科美公司提供,批内、批间变异分别为3.5%、5.5%,使用放射免疫γ计数仪完成检测。皮质醇分泌节律消失的定义[6,7]:16:00或24:00血浆皮质醇水平/8:00血浆皮质醇水平≥50%者为皮质醇分泌节律消失(16:00、24:00同时符合定义者,仍计为1例)。
2.2 糖代谢指标测定:于受试者入组次日(第2天)进行,抽取空腹静脉血测定FPG后,进行75g口服葡萄糖耐量试验、测定2hPG值。糖代谢指标测定前,病例组除饮食控制外暂不使用降糖药物。
2.3 量表评定 于入组当日,由固定的1名精神科高年资主治医师负责HAMD17量表评定,计算17项总分。
4统计学处理 采用SPSS 13.0进行统计分析。组间资料的比较分别采用 χ2检验、t检验;Mann-Whitney U检验(非正态分布资料);变量间的相关性分析采用简单相关分析。
结 果
1病例组、对照组各时点血浆皮质醇浓度的比较见表1。
表1 病例组、对照组各时点血浆皮质醇浓度的比较(nmol/Ls)
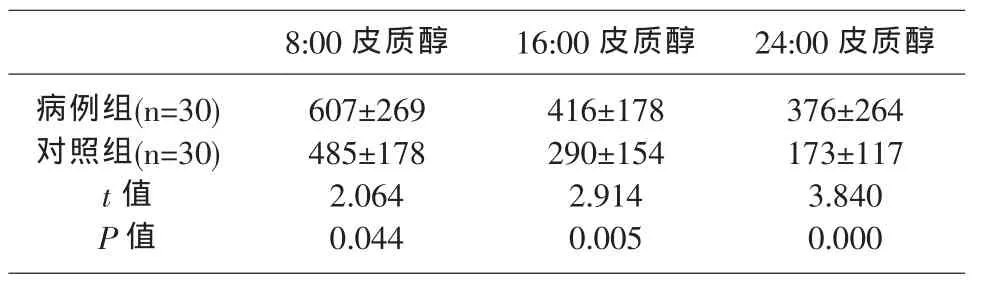
表1 病例组、对照组各时点血浆皮质醇浓度的比较(nmol/Ls)
8:00皮质醇 16:00皮质醇 24:00皮质醇病例组(n=30)对照组(n=30)t值P值607±269 485±178 2.064 0.044 416±178 290±154 2.914 0.005 376±264 173±117 3.840 0.000
由表1可见,病例组8:00、16:00、24:00的血浆皮质醇水平均显著高于对照组,差异均有统计学意义(均 P<0.05)。
2病例组、对照组皮质醇分泌节律消失者比率的比较
病例组皮质醇分泌节律消失为73.3%(22/30例),显著高于对照组的46.7%(14/30例),差异有统计学意义(χ2=4.444,P=0.035)。
3各时点血浆皮质醇浓度与糖代谢指标的相关性分析(表 2)。
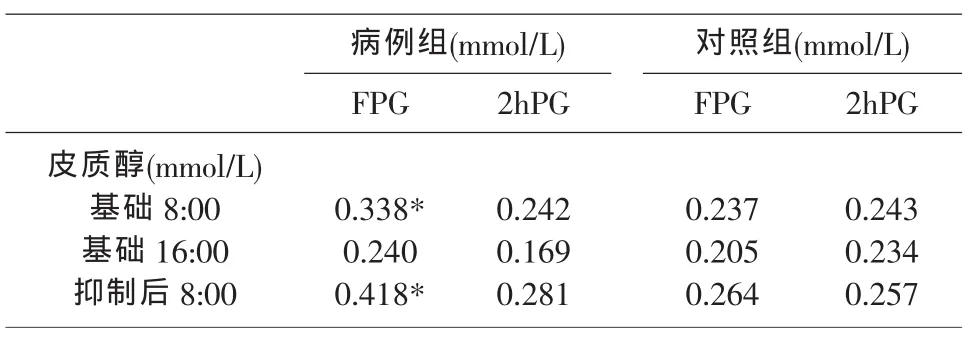
表2 病例组、对照组血浆皮质醇浓度与糖代谢指标的相关分析(γ值,n=35)
病例组8:00、24:00的血浆皮质醇浓度,均与FPG 值有正性相关(γ=0.338、0.418,P=0.022、0.012),余变量间的相关性无统计学意义(均P>0.05)。
讨 论
与抑郁症相关的神经内分泌研究,多数集中在对HPA轴功能的研究。一系列的证据表明,抑郁症患者存在显著的HPA轴的功能紊乱,如肾上腺皮质增生、促肾上腺皮质激素升高、糖皮质激素受体功能减退等[8,9],实验室检查则发现,抑郁症患者有皮质醇水平的显著升高,皮质醇昼夜节律改变、地塞米松抑制试验脱抑制等,并与抑郁症状间存在密切的联系,可随抑郁症状在治疗后的缓解而有所恢复[10]。
在本研究中,同时患有糖尿病的抑郁症患者较具有正常糖代谢功能的抑郁症患者,有更为增高的昼夜皮质醇水平,并有更多的患者出现皮质醇分泌节律的消失。目前认为,皮质醇节律,是反映HPA轴功能的敏感性最强的指标[6,7],因此,上述结果提示共患糖尿病的抑郁症患者存在更为显著的HPA轴功能异常。相关性分析进一步发现,在共患糖尿病的抑郁症患者中,作为HPA轴功能受损程度标志的血浆皮质醇水平,与患者的糖代谢功能受损程度之间有着正性的关联性。本项研究的结果,支持HPA轴功能异常与抑郁症患者所发生的糖尿病有关的假说。
既往对糖尿病患者HPA轴功能的研究结果,为此提供了另一个角度的佐证。有研究发现[11,12],即使不伴有显著抑郁症状的糖尿病患者也存在HPA轴功能的异常改变,患者有血皮质醇、尿皮质醇水平的显著增高。众所周知,皮质醇是一种重要的升糖激素(hyperglycemic hormone)[13,14],皮 质 醇 增 加 糖 原 分解、减少肝脏部位的糖原合成、并刺激糖异生;皮质醇也可影响葡萄糖转运子的功能,使外周组织中的葡萄糖利用减少、内源性葡萄糖产生增加[15,16]。此外,皮质醇对胰岛β细胞分泌胰岛素的抑制作用,也可导致高血糖的发生[17]。上述机制,有助于我们理解高皮质醇血症与胰岛素抵抗形成,这一目前公认的2型糖尿病发生的核心病理机制之间的密切联系。
综上所述,以皮质醇分泌节律消失、高皮质醇血症为特征的HPA轴功能紊乱,可能是联接抑郁症、糖尿病病理机制的一个“结点”,与抑郁患者中糖尿病的发生有关,并可能是抑郁患者共患糖尿病的重要病理机制之一。
[1]Eaton WW,Armenian H,Gallo J,et a1.Depression and risk for onset of type IIdiabtes.A prospective population based study[J].Diabetes Care,1996,19(10):1097-1102.
[2]Anderson RJ,Freeland KE,Clouse RE,et al.The prevalence of comorbid depression in adultswith diabetes:A meta-analysis[J].Diabetes Care,2001,24(6):1069-1078.
[3]Golden SH.A review of the evidence for a neuroendocrine link between stress,depression and diabetesmellitus[J].Curr Diabetes Rev,2007,3(4):252-259.
[4]Kyrou I,Tsigos C.Stressmechanisms and metabolic complications[J].Horm Metab Res,2007,39(5):430-438.
[5]编辑部.中国成人超重和肥胖症预防与控制指南(节录)[J].营养学报,2004,26(1):1-4.
[6]张 炜,汤正义,黄 昉,等.诊断库欣综合征时多种检查方法的比较[J].中华内分泌代谢杂志,2005,21(5):402-404.
[7]Findling JW,Raff H.Diagnosis and differential diagnosis of Cushing’s syndrome[J].Endocrinol Metab Clin North Am,2001,30(8):729-747.
[8]Arborelius L,OwensMJ,Plotsky PM.The role of corticotrophin releasing factor in depression and anxiety disorders[J].JEndocrinol,1999,160(1):1-12.
[9]Pariante CM,Miller AH.Glucocortcoid receptors in major depression:relevance to pathophysiology and treatment[J].Biol Psychiatry,2001,49(5):391-404.
[10]Kunugi H,Ida I,Owashi T,et al.Assement of the dexamethasone/CRH test as a state-dependentmarker for hypothalamic-pituitary-adrenal(HPA)axis abnormalities in major depressive episode:A multicenter study[J].Neuropsychopharmacology,2006,31(2):212-220.
[11]Roy MS,Roy A,Brown S.Increased urinary-free cortisol outputs in diabetic patients[J].JDiabetes Complications,1998,12(1):24-32.
[12]Caetano MS,SilvaRdo C,Kater CE.Increased diagnostic probability of subclinical Cushing's syndrome in a population sample of overweight adult patients with type 2 diabetesmellitus[J].Arq Bras EndocrinolMetabol,2007,51(10):1118-1127.
[13]Sapolsky RM,Romero LM,Munck AU.How do glucocorticoids influence stress responses?Integrating permissive,suppressive,stimulator and preparative actions[J].Endocr Rev,2000,21(1):55-89.
[14]Kleiman A,Tuekermann JP.Glucocorticoid receptor action in beneficial and side effects of steroid therapy:lessons from conditional knockoutmice[J].Mol Cell Endocrinol,2007,275(1-2):98-108.
[15]Dimitriadis G,Leighton B,Parry-Billings M,et al.Effects of glucocorticoid excess on the sensitivity of glucose transport and metabolism to insulin in rat skeletalmuscle[J].Biochem J,1997,321(3):707-712.
[16]Fehm HL,Kern W,Peters A.The selfish brain:competition for energy resources[J].Prog Brain Res,2006,153(1):129-40.
[16]Reynolds RM,Walker BR,Syddall HE,et al.Altered control of cortisol secretion in adultmen with low birth weight and cardiovascular risk factors[J].JClin Endocrinol Metab,200l,86(2):245-250.
[17]Jamieson PM,Nyirenda MJ,Walker BR,et al.Interactions between oestradiol and glucocorticoid regulatory effects on liver-specific glucocoticoid-inducible genes:possible evidence for a role of hepatic 11beta-hydroxysteroid dehydrogenase type 1[J].JEndocrinol,1999,160(1):103-109.

