湖南三个植烟地土壤根际微生物的变化研究
袁谋志,周昆,柴利广,吴芳,彭新辉
(1.湘西自治州烟草公司龙山分公司,湖南 湘西 416800;2.湖南省水稻研究所,湖南 长沙 410125;3.十堰市烟草公司,湖北 十堰 442000;4.湖南中烟工业有限责任公司技术中心,湖南 长沙 410007)
烟草种植过程中,土壤提供养分和维持烟草生长,在烤烟生产过程中有着独特的作用。而土壤微生物是土壤的重要组成部分,它对土壤肥力的形成和植物营养的转化起着积极的作用。气候条件是影响土壤形成及其理化特性的主要因素之一,它对土壤有机质的含量水平及土壤中的微生物有着重要的影响。气候、人为因素的变化影响着土壤作用机理和土壤微生物的种群、数量变化,对烟草的生长和品质起着不可低估的作用。基于此,采用盆栽和大田试验,研究了湖南三个植烟地土壤异地种植烤烟根际微生物的变化,为烟草生产育种提供必要的依据。
1 材料与方法
1.1 试验地点及处理
试验用烟为主栽品种K326,在浏阳、永州、桑植三个试验点进行,选择当地具典型土壤田块,同时,采用三地土壤异地进行旱土盆栽试验,并以当地大田栽培(旱地、水田)作对照(表1)。
注:下文写作依此表表示,如桑植点浏阳土为SL。
每个试验点,三个试验产地土壤,每个土样设40盆盆栽,每个点共120盆。每盆栽一株烟。施肥量:每株施N 8 g,N∶P∶K=1∶1∶3。即每株总用肥量为硝酸磷铵25.6 g,过磷酸钙66 g,硫酸钾47.5 g。
1.2 测定项目和方法
1.2.1 土样处理在当地烟草的移栽前、团棵期、旺长期、成熟期分别采集旱地、水田土样,同时,按三地土壤采集盆栽土壤。采集0~20 cm土层土样,每处理取样0.5 kg,随即用无菌塑料袋封装,附上标签。要求:多点采样,避开盆沿,每点采样厚度、宽窄、深浅,大体一致,取样后4℃保存(取样途中样品放于冰盒中,当天往返)。
1.2.2 土壤中微生物参照中国科学院南京土壤研究所微生物室编著的《土壤微生物研究法》进行测定。用牛肉蛋白胨培养基培养细菌;用马丁孟加拉红培养基培养真菌;用改良高氏1号培养基,临用时在已融化的培养基中每300 mL培养基加3%重铬酸钾l mL培养放线菌。采用23~27℃恒温培养、计数,全过程无菌操作。其中细菌采用混合平板法,培养24 h后计数;真菌采用涂抹平板法,培养60 h后计数;放线菌采用涂抹平板计数法,培养96 h后计数并计算每克干土含菌数。
1.2.3 土壤中脲酶和过氧化氢酶通过对新鲜土壤与尿素溶液在37℃培养2 h后测定氨释放量,计算脲酶的活性。采用滴定法,定量测定滴定酶促反应后剩余的过氧化氢量。
1.2.4 数据分析采用Excel、DPS和SPSS等软件对土壤微生物变化规律进行分析。
2 结果与分析
2.1 不同类型土壤菌类及酶的数量变化
由表2可知:在烟株全生育期内,土壤中的微生物以细菌占绝对优势,其次是放线菌,真菌量最少。细菌占总菌数的68.38%~78.05%;放线菌占21.93%~31.59%;真菌只占0.02%~0.06%。细菌、放线菌、真菌数量在三种类型栽培方式中依次为盆栽>水田>旱地。相比于旱地和水田烟,盆栽烟土壤微生物中真菌所占比例有大幅度的提高,三大类群微生物数量以真菌差异较大,放线菌次之,细菌差异最小。这表明盆栽环境有利于微生物的富积,旱地不利于土壤微生物的生长,由于土壤利用方式的不同,呈现出非常独特的微生物功能多样性。
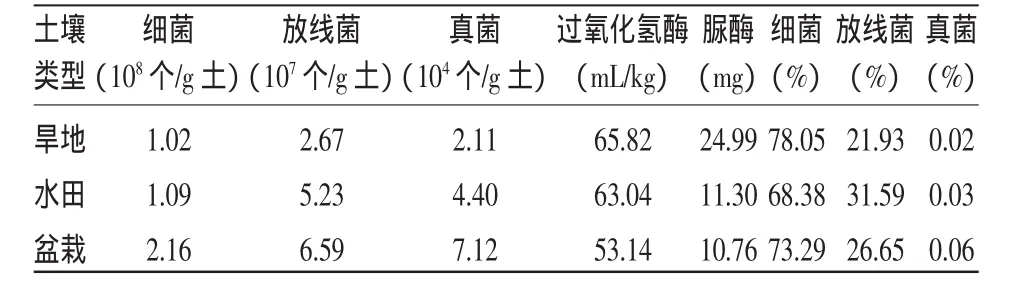
表2 不同利用类型土壤菌类及酶的数量比较
本试验对三种利用类型土壤中过氧化氢酶和脲酶的测定表明:两种酶类中过氧化氢酶活性差异较小,脲酶活性以旱地为最大,但过氧化氢酶和脲酶活性大小在三种类型栽培方式中与菌类恰好相反,即旱地>水田>盆栽。
2.2 不同土壤和气候条件下土壤中微生物的变化
由表3可以看出,同一生育期不同的土壤、气候条件下土壤微生物的数量不同,相同的土壤、气候处理不同生育期土壤微生物的数量变化也不相同,且三大类菌数量的变化在各个生育期各不相同。各个盆栽烟的微生物在整个烟草生长时期的变化相异,但总体上仍体现出各微生物(细菌、放线菌、真菌)数量随烟草生长而大幅增加的趋势。在烟草生长的团棵期,桑植气候条件下的浏阳土盆栽细菌数量达到最大值,其次为浏阳点浏阳土盆栽;而在烟草生长的旺长期和成熟期,均以浏阳点浏阳土盆栽细菌最多,明显高于同时期的其他处理。烟草移栽后,放线菌数量以浏阳点浏阳土盆栽最多,这表明浏阳的气候和土壤环境比较适合烟草根际微生物的生长。整个盆栽烟草生育期,不同处理的土壤真菌数量差异不大。
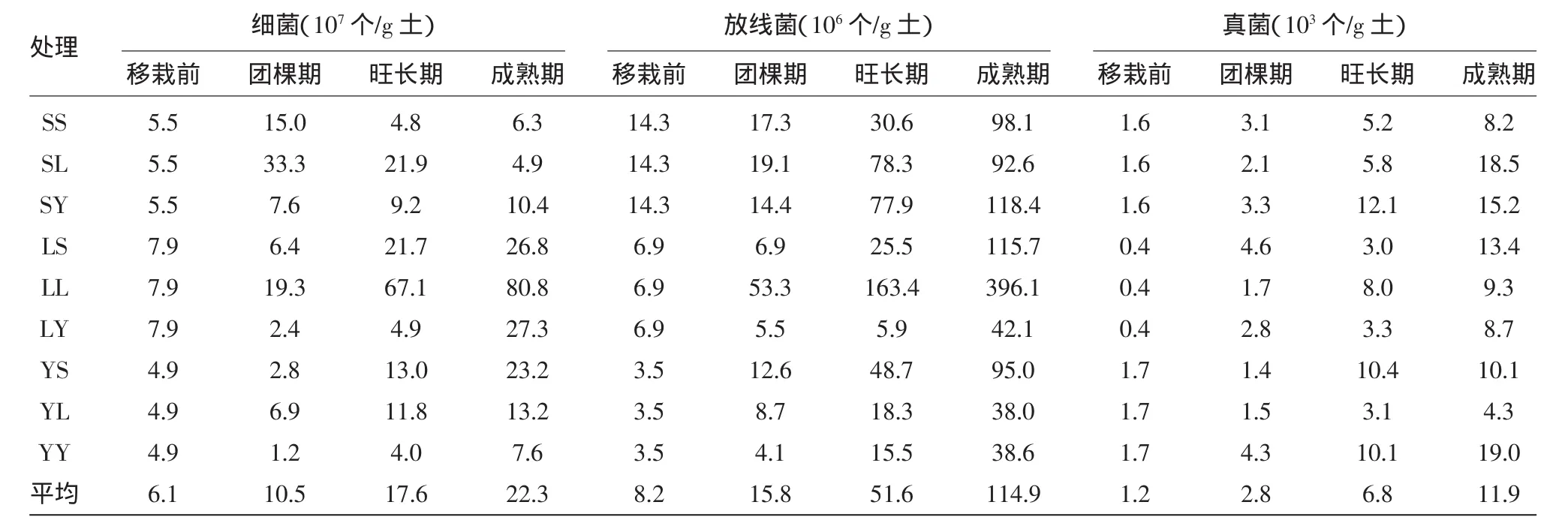
表3 不同盆栽处理下微生物的变化
表4显示的是不同处理下土壤过氧化氢酶和脲酶的活性变化,在所有的处理中可以看到过氧化氢酶活性在各处理中最大值为89.796 mL/kg,最小值为22.449 mL/kg;脲酶活性则在4.837~19.211 mg之间变化。平均显示,在烟草生长的旺长期,过氧化氢酶的活性低于团棵期和成熟期;脲酶活性随烟草的生长逐渐降低。大田栽培中过氧化氢酶活性桑植(SCK)点<永州(YCK)点<浏阳(LCK)点,脲酶活性则是浏阳点最低。各盆栽试验中过氧化氢酶和脲酶活性都随着气候和土壤的不同而不同,如:过氧化氢酶在桑植点栽培中活性大小为浏阳土>桑植土>永州土,而在浏阳点栽培中则是桑植土最大,永州和浏阳土的栽培没有太大差异。总言之,土壤酶活性在烟草生产的各个时期以及同一时期的各个处理间不同。

表4 不同处理下土壤过氧化氢酶和脲酶活性变化
由表5可以看出,细菌、放线菌在不同气候条件下变化较大,真菌变化较小。桑植气候条件下的细菌在团棵期达到最大值,浏阳、永州气候条件下则在成熟期达到最大值,其中浏阳气候条件下的细菌在烟草旺长、成熟期明显高于另外两地同时期的水平。放线菌则在各地的气候条件下都保持一定的增长趋势,但是永州气候条件下的增长幅度低于另外两地。真菌在各个气候条件之间的变化不明显,以浏阳气候条件下的增长缓慢,但在各地的气候条件下都保持随烟草生长而增加的趋势。

表5 不同气候条件下微生物的变化
2.3 土壤微生物和酶在大田栽培和盆栽试验中的变化比较
根际微生物的数量、组成及根际效应受到植物类型、土壤物理条件和化学性质等多种因素的影响;同时在生长发育的不同阶段,植物根系的生长也会对根际微生物产生影响[1-3]。图1显示,大田栽培和盆栽试验中土壤中的细菌、真菌、放线菌总数都随着烟草生长而增加,在各烟草生长时期,盆栽微生物(细菌、放线菌、真菌)数量都大于大田栽培。其中大田栽培中的微生物数量在烟草的移栽前、团棵期变化不大,细菌甚至直到成熟期才有大幅度的提高,而盆栽土壤微生物数量变化明显早于大田栽培。
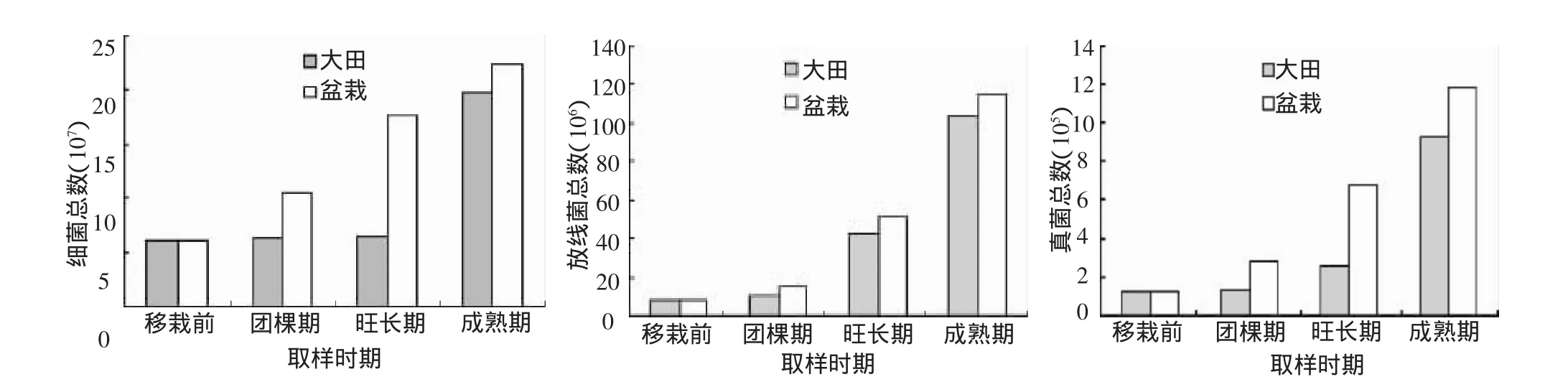
图1 大田与盆栽土壤微生物变化
从图2可知,过氧化氢酶活性在盆栽和大田中的变化不一致;而脲酶活性在盆栽和大田中的变化一致,呈现先增加后减少的趋势,至烟草生长的团棵期达到最大值。两种酶的活性均以大田栽培中高,这可能由于微生物的活动对过氧化氢酶和脲酶活性存在一定的抑制作用。
2.4 植烟土壤微生物与酶类相关性分析

图2 大田与盆栽土壤酶活性
土壤微生物和土壤酶之间相互作用、相互影响,促进土壤中物质的循环,进而促进植株的生长。由表6可知,细菌与放线菌数量相关系数为0.8084,呈极显著正相关;放线菌数量与真菌数量显著正相关;细菌与真菌相关性不显著;过氧化氢酶与脲酶活性相关系数达到了0.4206,呈显著正相关。此外,三大微生物数量与脲酶活性呈现一定的负相关性;过氧化氢酶活性与细菌、放线菌呈一定的负相关,但均未达显著水平。
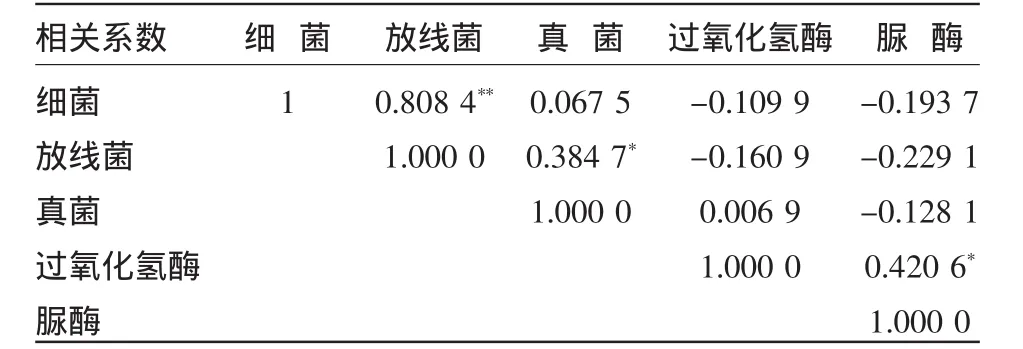
表6 微生物与酶类相关分析
3 结论与讨论
土壤微生物和土壤酶是土壤的重要组成部分和最活跃的部分,能加速营养元素在土壤生态系统中的循环,提高营养元素的有效性,在协调植物养分供应与利用的关系中发挥着关键作用。
一般来说,土壤中的微生物以细菌占绝对优势,其次是放线菌,真菌量最少。本试验结果表明在烟株整个生育期,细菌占总菌数的68.38%~78.05%;放线菌占21.93%~31.59%;真菌只占0.02%~0.06%。,三大类群微生物数量以真菌差异较大,放线菌次之,细菌差异最小,这与张艳玲[4]等的研究结果大致相同,但细菌所占的比例有所下降,放线菌比例有所上升。
大田栽培和盆栽试验中土壤中的细菌、真菌、放线菌总数都随着烟草生长而增加,盆栽在各时期的数量都大于大田栽培。其中大田栽培中的微生物(细菌、放线菌、真菌)数量在烟草的移栽前、团棵期变化不大,细菌甚至直到成熟期才有大幅度的提高,而盆栽土壤微生物数量变化明显早于大田栽培,这可能因为土壤微生物受到了根系分泌物的较大影响[5]。在盆栽环境中,根际环境对烟草根系发展有所限制,而植物根系分泌物可为土壤微生物的生命活动提供能源物质从而使其聚集在根际区域,从而影响着土壤微生物的区系、分布以及数量变化,进而影响微生物数量的变化。另外,盆栽条件下,微生物生存环境比较稳定也是各项指标高于大田栽培的一个重要因素。这与孔维栋[6]等的结论符合。另外,过氧化氢酶活性在盆栽和大田中的变化不一致,而脲酶活性在盆栽和大田中的变化一致,呈现先增加、后减少的规律,至烟草生长的团棵期达到最大值。但是两种酶的活性都是以大田栽培为大,这与细菌、放线菌、真菌的结果相反,说明土壤酶类活性与土壤微生物存在一定的负相关性。
相关分析表明,细菌与放线菌数量呈极显著正相关,放线菌数量与真菌数量、过氧化氢酶与脲酶活性呈显著正相关,三大微生物数量与脲酶呈现一定的负相关性。
利用植物和微生物之间互惠的关系,选育优良烟草品种,对生产有一定的指导意义。在植烟土壤微生物研究中,一方面烟草的根系分泌物为微生物生长繁殖提供了碳源和能源,有利于微生物的生长发育;另一方面,微生物的活动和代谢作用,又从影响根细胞的膜透性、根的代谢活动、根系分泌物的吸收利用、改变根际矿质成分的生物有效性等4个途径促进或抑制根系分泌物的释放。这样就在植物根际形成了新的有机成分,维持了根际环境的微生物活性[7-8]。根际微生物生物数量和种类越多,土壤生物活性越强,越能促进植物的生长[9]。从这个角度而言,在烟草栽培中,应加大套种和轮作的应用,提高微生物多样性,为烟叶种植提供更加优良的生长环境,从而进一步提高烟叶品质。
[1]田永辉.不同基因型茶树根际微生物动态及根际效应[J].贵州茶叶,2000,101(1):35-37.
[2]Miki B.Transgene expression and control[J].In Vitro Cellular&Developmental Biology Plant,2002,38(2):139-145.
[3]Marcial Gomes N C,Fagbola O,Costa R,et a1.Dynamics of fungal communities in bulk an d maize rhizosphere soil in the tropics[J].Applied and Environmental Microbiology,2003,69(7):3758-3766.
[4]张艳玲,蔡宪杰,王信民.烟田土壤微生物组成及其垂直分布特征[J].烟草科技,2006,(9):61-64.
[5]李阜棣.土壤微生物学[M].北京:中国农业出版社,1996.
[6]孔维栋,刘可星,廖宗文.有机物料种类及腐熟水平对土壤微生物群落的影响[J].应用生态学报,2004,15(3):487-492.
[7]孟颂东,关桂兰,王卫平,等.根际微生物产生的植物激素对小麦生长的作用[J].植物生理学通讯,1998,34(6):427-429.
[8]刘子雄,朱天辉,张建,等.林木根系分泌物与根际微生物研究进展[J].世界林业研究,2005,18(6):25-31.
[9]Prosser J I.Molecular and functional diversity in soil micro-organisms[J].Plant and Soil,2002,244(1-2):9-17.

