蕲蛇酶联合肝素治疗对兔下腔静脉血栓血管内膜的影响研究Δ
孙一来,向志,赵渝,邹中辉,孙一圣(.重庆医科大学附属第一医院血管外科,重庆市40006;.山东省泰山疗养院,泰安市 7000)
静脉血栓形成的病变过程中会伴发静脉壁的炎症、内皮细胞损伤、内膜增生等情况,这一系列的病变会促进血栓的形成,影响静脉血栓的预后。抗凝、溶栓(TL)是治疗下肢深静脉血栓形成(DVT)的主要方法之一。笔者通过蕲蛇酶联合肝素治疗兔下腔静脉血栓,对比尿激酶联合肝素及单纯应用肝素治疗方案,探讨蕲蛇酶联合肝素治疗对兔下腔静脉血栓血管内膜、胶原纤维沉积、内皮细胞的影响。
1 材料
1.1 仪器
S-3000N型扫描电镜(日本Hitachi公司);ECLIPSE E200型光学显微镜(日本Nikon公司)。
1.2 试药
蕲蛇酶(福建汇天生物药业有限公司,批号:080404);肝素钠(苏州新宝制药有限公司,批号:080409);尿激酶(广东丽珠集团丽珠制药厂,批号:080402)。
1.3 动物
健康新西兰大白兔72只,体质量2.5~3.0 kg,由重庆医科大学动物实验中心提供(动物许可证号:SCXK(渝)2007-001)。
2 方法
2.1 模型的复制
3%苯巴比妥钠(40 mg·kg-1)静脉麻醉,游离左肾静脉与下腔静脉汇合处和髂总静脉分叉处之间的下腔静脉段。分别在左肾静脉汇合下腔静脉处下方用1#丝线结扎下腔静脉,在髂总静脉分叉处上方用显微血管夹暂时阻断下腔静脉1.5 h,经25 G细针穿刺无血液流出,证实该段静脉内血栓已形成,血栓形成模型制作成功率为100%。
2.2 分组及给药
实验分为3组,即肝素(A)、尿激酶联合肝素(B)及蕲蛇酶联合肝素(C)组。其中,A、B、C组再分为术后3、7、10 d 3个时相亚组,每个亚组8只兔子。
2.3 药物治疗
成功复制模型后3 d,A、B、C组分别于耳缘静脉注入肝素钠500 IU·kg-1,尿激酶10 000 IU·kg-1和肝素钠500 IU·kg-1,蕲蛇酶0.5 IU·kg-1和肝素钠500 IU·kg-1。
2.4 观察指标
2.4.1 光镜下观察内膜变化情况:血栓形成3 d后开始用药,分别于用药后第3、7、10天取各组病变的下腔静脉血管,用生理盐水将残余的血栓冲洗干净,纵行切开血管,从血管中间横断,取其中一段标本用10%的甲醛溶液固定,采用Masson染色,在光镜下观察腔静脉内膜增生情况。
2.4.2 光镜下观察胶原纤维沉积情况:观察Masson染色的腔静脉血管胶原纤维沉积情况,通过IMS计算机彩色图像分析系统采集胶原纤维沉积数据。
2.4.3 扫描电镜观察内皮细胞损伤情况:将各组纵行切开的另一段血管用25%戊二醛溶液固定,扫描电镜观察各组的内皮细胞损伤情况。电镜下内皮损伤各级表现为Ⅰ级(内皮细胞脱落0~10%,内皮层完整×1 000)、Ⅱ级(内皮细胞脱落11%~25%,内皮层轻微断裂伴白细胞及血小板沉积×1 000)、Ⅲ级(内皮细胞脱落26%~50%,片状内皮脱落,明显的内皮下基质显露×1 000)、Ⅳ级(内皮细胞脱落51%~75%,内皮肿胀伴明显组织坏死×1 000)、Ⅴ级(内皮细胞脱落76%~100%,严重的内皮脱落伴明显的内皮下基质暴露×1 000)。内皮损伤分级见图1。

图1 内皮损伤分级Fig 1 Endothelium injury degree
2.5 统计学方法
胶原纤维沉积比例指标采用单因素方差分析,内皮层损伤分级以等级资料表示,采用多个样本两两比较的秩和检验。
3 结果
3.1 光镜下腔静脉内膜病理变化结果
用药3、7、10 d时,A组的内膜增生程度逐渐加重,程度均较B、C组重;B组和C组的内膜增生程度较轻,第10天时A组的增生程度较C组重。内膜增生情况见图2。
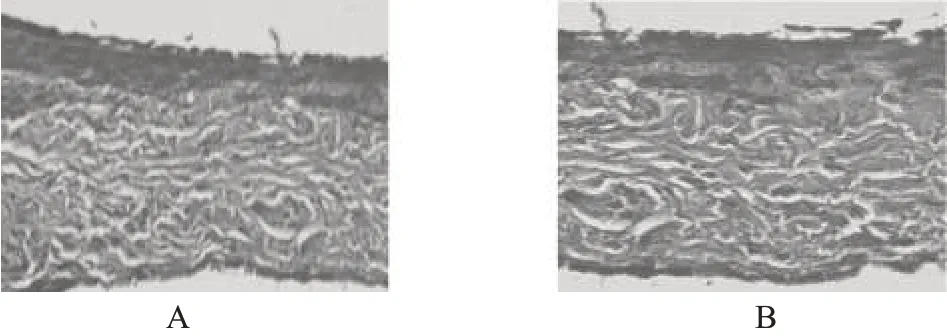
图2 腔静脉内膜增生情况Fig 2 Intimal hyperplasia of vena cava
3.2 光镜下腔静脉胶原纤维染色面积检测结果
用药3 d时,C组较A组的胶原纤维沉积轻(P<0.05),其中在7、10 d时,C组和A组有显著性差异(P<0.01);在用药3、7、10 d时,B组和C组损伤程度均较轻,2组比较无显著差异(P>0.05)。各组在用药后3个时相的胶原纤维染色面积比较结果见表1。
表1 各组在治疗后3个时相的胶原纤维染色面积比较结果(±s,%)Tab 1 Comparison of collagen fiber staining area of three groups after treatment at three time phase(s±s,%)
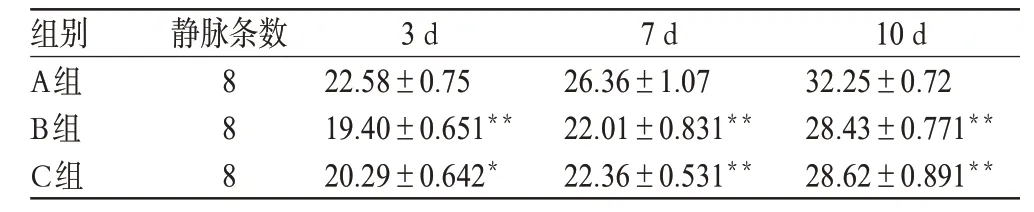
表1 各组在治疗后3个时相的胶原纤维染色面积比较结果(±s,%)Tab 1 Comparison of collagen fiber staining area of three groups after treatment at three time phase(s±s,%)
与A组比较:*P<0.05,**P<0.01 vs.A group:*P<0.05,**P<0.01
组别A组B组C组7 d 26.36±1.07 22.01±0.831**22.36±0.531**静脉条数888 3 d 22.58±0.75 19.40±0.651**20.29±0.642*10 d 32.25±0.72 28.43±0.771**28.62±0.891**
3.3 腔静脉内皮细胞扫描电镜检查结果[1]
A组抗凝治疗后,内皮细胞损伤程度随血栓形成病程进行性增大,给药3 d时多为Ⅱ~Ⅲ级;给药7 d时多为Ⅲ级;给药10 d时多为Ⅲ~Ⅳ级,内皮细胞脱落程度逐渐加重,内皮下基质暴露明显。B组和C组溶栓治疗后,给药3 d时多为Ⅱ~Ⅲ级,内皮层相对较完整,但细胞轻度肿胀,细胞间隙增宽,略有细胞脱落,内皮下基质轻微暴露,有少许白细胞黏附;给药7 d时多为Ⅱ级,内皮细胞肿胀减轻,细胞间隙较前变窄,未见白细胞黏附;给药10 d时多为Ⅱ级,有少许达到Ⅰ级,内皮细胞形态逐渐趋于正常,内皮下未见明显基质。B、C组与A组比较,在溶栓术后3、7、10 d有显著性差异(P<0.01);B组与C组比较,在溶栓术后3、7、10 d无显著差异(P>0.05)。各组内皮细胞损伤比较结果见表2;组间不同时相内皮损伤比较结果见表3。

表2 各组内皮细胞损伤比较结果Tab 2 Comparison of endothelial cell damage among three groups
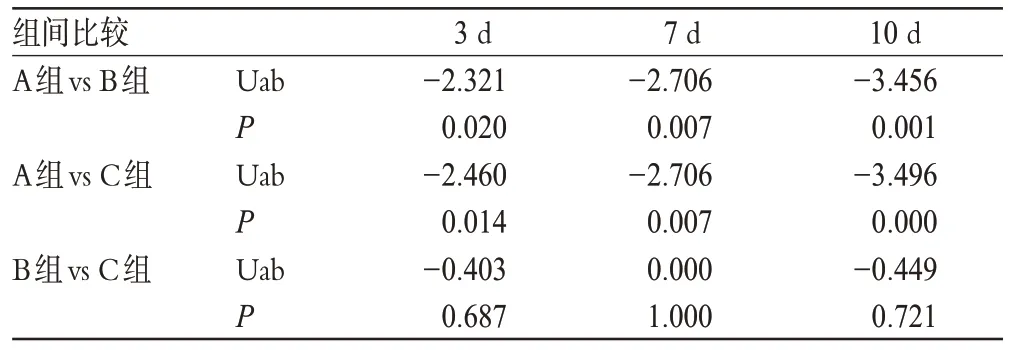
表3 组间不同时相内皮损伤比较结果Tab 3 The comparison of endothelial cell injury at different phases among groups
4 讨论
抗凝、溶栓是目前治疗急性下肢深静脉血栓的主要方法,但外周溶栓治疗也加大了大出血的风险[2,3]。目前,尿激酶是治疗下肢静脉血栓的主要溶栓药物,尿激酶和肝素的主要副作用是出血,二者同时应用更容易发生[4]。蕲蛇酶是从尖吻蝮蛇毒中分离、纯化的凝血酶样酶,是用于防止血栓性疾病的新型药。这种药品作用于血浆纤维蛋白原,使其转变为不稳定的纤维蛋白产物。用药后使纤维蛋白原量下降,凝血酶时间延长,优球蛋白溶解时间缩短,血小板解聚,从而阻止血栓的形成,现已经广泛应用于临床。蕲蛇酶主要降解纤维蛋白原,而激发纤溶系统作用弱,其存在出血的风险性较小。
抗凝、溶栓治疗还具有较好保护内皮细胞结构的作用[5,6]。内皮细胞在抑制平滑肌细胞(SMC)生长及从中膜到内膜的移行中起着重要作用;内皮细胞能够合成抑制SMC生长的类肝素样物质[7]。血栓在形成的过程中会引起静脉壁发生炎症反应,而内皮细胞的受损也会失去抗栓作用而导致内膜增生,加重静脉壁的炎症。可见,内皮细胞在血栓形成、复发的过程中具有重要作用。本研究扫描电镜结果表明,A组内皮细胞损伤程度随血栓形成的病程发展,第10天时损伤大多在Ⅲ~Ⅳ级,说明单纯的抗凝治疗并不能有效阻止静脉内皮细胞损伤的进一步加剧。尿激酶不仅具有溶解血栓作用,还能减轻血栓引起的血管壁急性炎症反应[8]。C组和B组在用药后的不同时间段内皮损伤程度的差异无统计学意义(P>0.05),用药后第3天内皮损伤程度大多为Ⅱ~Ⅲ级,第10天时内皮损伤程度大多为Ⅰ~Ⅱ级,说明2组均能够有效地保护内皮细胞,在疗效方面相近,无差异性。蕲蛇酶能够促进血管内皮细胞释放组织型纤溶酶原激活物(t-PA),溶解内皮表面附着的血栓,对减轻血管内皮的损伤可能起到一定的作用。本研究光镜检查结果发现,在用药后的不同时相,A组的内膜增生程度均较B组、C组严重,并一直保持较高的水平,A组胶原纤维沉积的比例也较B组和C组大,而B组和C组的内膜增生程度和胶原纤维沉积的比例无显著差异,说明C组能够有效减轻内膜的增生,抑制胶原纤维的沉积。
综上所述,本研究进一步提示了蕲蛇酶联合肝素在减轻内皮细胞损伤、避免血小板与内皮下细胞外基质(ECM)接触而被激活、降低血管内膜增生的程度、减轻血管壁急性炎症方面是有效的,对兔下腔静脉血栓有着较好的治疗及预后效果,可为静脉血栓的抗凝、溶栓治疗提供一种新的方案。
[1]Cho JS,Martelli E,Mozes G,et al.Effect of thrombolysis and venous thrombectomy on valvular competence,thrombogenicity,morphology,and function[J].J Vasc Surg,1998,28(5):787.
[2]Schweizer J,Kirch W,Koch R,et al.Short-and long-term results after thrombolytic treatment of deep venous thrombosis[J].J Am Coll Cardiol,2000,36(4):1 336.
[3]Levine MN,ColdhaberSZ,GoreJM,et al.Hemorrhagic complications of thrombolytic.Therapy in the treatment of myocardial infarction and venous thromboembolism[J].Chest,1995,108(4 suppl):291S.
[4]蔡清明,贺江南.尿激酶治疗下肢深静脉血栓形成[J].陕西医学杂志,1998,27(7):437.
[5]Segal JB,Streiff MB,Hofmann LV,et al.Management of venous thromboembolism:a systematicreview for practice guideline[J].Ann Intern Med,2007,146(3):211.
[6]Cynamon J,Stein EG,Dym RJ,et al.A new method for aggressive of deep veinthrombosis:retrospective study of the power pulse technique[J].J Vasc Intery Radiol,2006,17(6):1 043.
[7]Davis MR,Ortegon DP,Kerby JD,et al.Endothelial dysfunction after arterial thrombosis is ameliorated by Larginine in combination with thrombolysis[J].J Vasc Intery Radiol,2003,14(2):233.
[8]Thomas WW,Robert MS,Carol AW,et al.Venous thrombosis associated inflammation and attenuation with neutralizing antibodies to cytokines and adhension molecules[J].Arterioscler Thromb Vasc Biol,1995,15:258.

