硫甙葡萄糖苷降解研究进展
李 晨,薛 峰,缪文华,潘思轶*
(华中农业大学食品科学技术学院,湖北 武汉 430070)
硫甙葡萄糖苷降解研究进展
李 晨,薛 峰,缪文华,潘思轶*
(华中农业大学食品科学技术学院,湖北 武汉 430070)
通过硫苷生物合成、降解途径、降解产物分析方法和降解产物功能作用对十字花科植物中次级代谢产物硫甙葡萄糖苷降解情况进行综述。硫苷生物合成以氨基酸为底物经过3个步骤完成;硫苷降解存在酶降解、热降解、化学降解;硫苷降解产物分析方法主要采用化学分析和色谱分析;硫苷降解产物既有抗癌的积极作用又有抗营养化的消极作用。
硫苷;降解途径;分析方法;功能作用
硫甙葡萄糖苷(glucosinlates,以下简称硫苷)是十字花科植物的次级代谢产物,位于植物液泡内[1]。它是一组含硫化合物的总称,大部分经由植物体内的α-氨基酸的生物合成得到,结构包括β-D-硫葡糖基,磺酸肟,以及由氨基酸衍生而成的支链。根据支链种类的不同,可将硫苷分为脂肪族、芳香族和吲哚型3大类[2]。
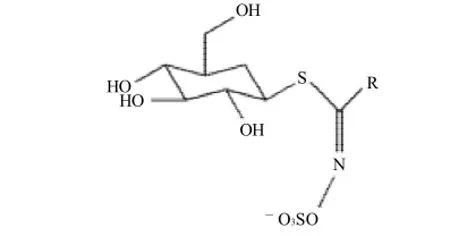
图1 硫甙葡萄糖苷结构[3]Fig.1 Structure of glucosinolates
当植物组织遭受外界损伤时,位于液泡中的硫苷就会与分布在芥子酶细胞质中的黑芥子苷酶相结合,发生酶解反应,生成具有热辣气味的风味物质,主要的3大类风味物质包括异硫氰酸酯、硫氰酸盐和腈[4]。除酶解反应之外,硫苷还会发生非酶解反应,包括热降解和化学降解等。根据降解机制或降解条件的不同,生成不同种类的风味物质。
硫苷降解产物由于其特殊的气味和生化特性,尤其由于其抗癌和植物防御功能[5],从上世纪50年代开始,就引起了研究者们的广泛关注。到目前为止,已有多篇关于硫苷的降解途径和各种降解产物的报道,本文对硫苷的降解途径和降解产物进行综述,旨在为其降解机制的进一步研究提供参考。
1 硫甙葡萄糖苷的生物合成
硫苷的生物合成可分为3个步骤:首先是氨基酸通过转氨作用产生α-酮酸,经过异构化使链延长形成长链酮酸,再通过转氨作用形成长链氨基酸;第2步为葡萄糖苷核心部分的生物合成,即细胞中的氧化酶系将长
链氨基酸氧化为不同形式的肟,再由谷胱甘肽转移酶和CS裂解酶催化肟产生硫甙肟,最后硫甙肟产生的脱硫葡萄糖苷经硫甙转移酶的催化,产生硫甙葡萄糖苷;第3步为侧链的修饰,侧链修饰情况错综复杂,不同的修饰途径可能产生不同硫苷,也可能导致同种产物,因此在侧链修饰的研究上,还存有很大的空间[6]。
影响硫苷种类和含量的原因有:基因和环境状况;蔬菜烹饪过程中的工艺影响;包装和贮藏条件等。由于硫苷是十字花科植物中风味成分的前体物质,其种类和含量将直接决定其降解后生成的风味成分的种类和含量[7]。
2 硫甙葡萄糖苷的降解途径
硫苷可以通过3种途径发生降解,分别是酶降解、热降解和化学降解。发生降解时,硫苷产生等物质的量的葡萄糖、糖苷配基以及硫酸盐。糖苷配基不稳定,发生进一步降解,生成硫氰酸盐、腈、异硫氰酸盐、唑烷以及环硫腈等。其中最主要的具有冲辣气味的风味成分是异硫氰酸酯,它通过Lossen重排产生,能够使真菌或昆虫对植物的侵犯起到防御作用[8]。硫苷的降解产物随着硫苷结构以及反应条件的变化而变化。
2.1 酶降解
Lüthy等[9]于1984年提出了“芥子油弹”的模型结构。硫苷位于植物细胞的液泡内,能促使硫苷降解的黑芥子苷酶则附着于细胞内膜上,当植物受到损伤,细胞遭到破坏,液泡内的硫苷就会与黑芥子酶相遇,发生降解反应。
在植物中,酶降解的特征是植物体内的抗坏血酸对黑芥子酶活性的控制。Grob等[10]对辣根根部组织进行了检测,发现有99.5%的抗坏血酸都位于液泡中。硫苷、抗坏血酸、黑芥子酶在植物中有3种分布方式:分别位于不同细胞;位于同一细胞的不同区间;以非活化的形式存在于同一细胞的同一区间。由于高浓度的抗坏血酸抑制酶活性,而低浓度增强酶活[11],因此,当植物未受损伤时,黑芥子酶活性受到高浓度抗坏血酸的抑制,不与硫苷发生反应;而遭受破坏时,液泡膜受损,抗坏血酸会因为细胞液的稀释而降低浓度,使酶解反应得以发生,因此硫苷、抗坏血酸和黑芥子酶位于同一细胞的同一区间是完全有可能的。
某些昆虫和微生物体内由于也含有黑芥子酶,能酶解硫苷。硫苷的水解产物尤其是异硫氰酸盐,对食草昆虫有毒副作用。为适应这种植物,昆虫逐渐演化出生化适应性。有不少研究者们从蚜虫体内检测到了黑芥子酶。其中Francis等[12]通过硫酸铵分馏、DEAE和凝胶过滤色谱3个步骤从甘蓝蚜体内分离出了高纯度的蚜虫黑芥子酶,并利用这种黑芥子酶研究了其对黑芥子糖苷等8种硫苷纯品的降解作用及产生的不同降解产物。微生物也会显示出黑芥子酶活性:人体内肠道细菌含有黑芥子酶,能够将硫苷在肠道系统内消化[13];真菌如黑曲霉中也被检测出具有黑芥子酶活性[14]。
硫苷酶酶解的降解产物多样,酶解最初产生硫甙肟-O-磺酸盐,通过Lossen重排释放硫酸盐后会产生异硫氰酸盐、硫氰酸盐、腈和重要的硫化物。不同的降解条件决定了产物的不同。在中性条件下,通常会产生异硫氰酸盐和硫酮类化合物;pH值较低时,则产生腈和硫氰酸盐[15]。自然界中能通过酶解过程产生硫氰酸盐的硫苷只有3种:烯丙基硫苷、苯甲基硫苷和4-丁基硫苷。姜子涛等[16]研究了辣根中酶解反应进行的水浴温度、时间、pH值和抗坏血酸添加量对酶解反应的影响,得到了最优酶解条件,并检测出辣根酶解后9种风味成分,其中烯丙基异硫氰酸酯、3-丁烯基异硫氰酸酯、2-戊基异硫氰酸酯和β-苯乙基异硫氰酸酯是主要成分。此外,Rakariyatham等[17]发现曲霉NR-4201能够对芥末籽饼中的硫苷进行生物降解,固体培养下未检测出硫苷降解产物,而液体培养下检测出烯丙基腈的存在。感染了芜菁花叶病毒的快速增值野生芸薹属植物,也检测出两种主要的降解产物:3-丁烯基异硫氰酸酯和1-腈基-3,4-环硫丁烷,可能是由此植物体内最丰富的3-丁烯基硫苷转变而来[18]。
2.2 热降解
研究热降解常用的方法为建立模型分析,但由于植物体内的其他因素如金属离子等会对分析过程产生影响,因此分析数据时就要考虑热之外的因素。十字花科蔬菜制品在成为商品之前,加热操作是不可避免的。而在蔬菜中硫苷发生热降解之时,其降解还有可能包括酶降解和热介质浸提两种,然而在研究十字花科植物热降解的很多情况下,并未将这两种因素分开考虑[19]。
MacLeod等[20]首次证明异硫氰酸盐可以由非酶解反应得到,他们采用控制气相色谱柱温的方式,发现当柱温达到200℃时,2-丙烯基硫苷会分解成为44%腈,32%异硫氰酸盐,而苯甲基硫苷则降解为63%腈和13%的异硫氰酸盐。亦有研究发现(R)-2-羟基-3-烯基硫苷在100℃加热3h会完全分解,吲哚硫苷也在热降解条件下会大量分解,并产生异硫氰酸盐和吲哚乙酸腈等风味产物[21]。Oerlemans等[22]首次将红球甘蓝中的黑芥子酶在实验进行前灭活,以排除酶降解的干扰,专门研究热降解对其中硫苷的影响,发现在110℃温度以下,吲哚类硫苷的降解速率大于脂肪族硫苷,并且将热烫、蒸煮、罐装3种热处理条件对硫苷的热降解进行了模拟,研究表明,硫苷的热降解程度在罐装条件下最大,蒸煮次之,最小为热烫。
2.3 化学降解
硫苷还能够被酸、碱以及盐溶液降解。在酸溶液中,硫苷的一般降解产物为相应羧酸、D-葡萄糖、羟胺离子和氢硫酸盐,也可能产生新的硫苷[23]。而在碱溶液中,硫苷的降解产物则比较复杂,有硫氰酸盐、硫酸盐、硫化氢、腈、烯丙基腈、吲哚等。Fensick等[24]从2-丙烯基硫苷的NaOH水溶液中得到了硫代葡萄糖,Friis等[25]在2-丙烯基硫苷和苯甲基硫苷中加入2mol/L NaOH溶液,产生了相应氨基酸,并猜测其可能是由于Neber重排产生。不仅是在酸碱溶液,在盐溶液如2-丙烯基硫苷在BaCl2中,会产生BaSO4、S、KCl和丙烯腈,而在AgNO3水溶液中,有H2S存在时,生成丙烯腈和AgS;有Na2S2O3存在时,则生成异硫氰丙烯和AgS。硫苷的化学降解涉及较少,且降解机制还未被研究,因此,在这方面存有较大的空间供以后深入探讨。
2.4 硫苷降解影响因素
影响硫苷降解的因素有很多。首先是蔬菜的制作过程中工艺过程的影响。工艺过程可能会使黑芥子酶部分失活、使硫苷或硫苷降解产物发生热降解、酶解硫苷或减少能增大酶活的物质(如抗坏血酸、Fe2+)等。当代研究者们的研究也主要集中在工艺因素对硫苷降解的作用上,主要的工艺因素有打碎、煮制、冷冻、脱水、发酵以及凉菜烹调工艺例如添加剂、调味料的添加等[26]。Volden等[27]研究了3种工艺过程:热烫、煮沸和蒸气加工对花椰菜硫苷含量和其他抗氧化参数的影响,得出蒸气加工对硫苷的影响最小,只降解了19%,其次为热烫,42%,影响最大的是煮沸,55%,且吲哚类比脂肪族硫苷耐热性强。Wenngerg等[28]研究了热烫以及乙酸处理对两个不同品种白菜中碳水化合物和硫苷组成的影响,发现热烫会使两种白菜内的硫苷含量都降低,而乙酸只降低其中一种白菜中的硫苷含量,这项研究还对单个硫苷的含量进行了分析,使工艺因素的作用程度更加具体化。Martinez-Villaluenga等[29]研究了白菜发酵条件下硫苷的变化,发现硫苷含量急剧降低,而且在发酵7d后,仅有微量单个硫苷被检测出。
其次是蔬菜前处理方式的不同,Ildikó等[30]研究了微波热处理对白芥末营养和胶状化学性质的影响,其研究表明,处理过后的硫苷含量保持不变,而释放出的异硫氰酸盐的含量有较为显著的降低,从这个角度说明了黑芥子酶的活性被抑制。van Eylen等[31]研究了压力/温度处理对花椰菜内源黑芥子酶的稳定性和活性以及细胞可渗透性的影响。表明压力/温度对黑芥子酶活性的影响有先增大后降低的趋势,且在45℃、100MPa达到最大,因此用压力/温度处理食品可以先增大酶活使硫苷降解产生风味物质,再降低酶活抑制反应以保持食品的感官性质。这项研究也为温度/压力对于风味物质保存的应用提供了理论依据。
再次在反应条件的不同上,Uda等[32]从Tanaka种子中提取黑芥子酶,用此酶水解黑芥子糖苷,并研究了pH值和Fe2+两因素对硫苷降解作用的影响,发现在pH4.5和5.5时,Fe2+能严重抑制异硫氰酸盐的产生,这种抑制作用在pH6.5时降低,并与pH7.5时消失。又通过此酶水解金龟草种子中提取出的硫苷,验证了Fe2+不影响酶解过程中葡萄糖的释放,而只影响风味物质的生成。Pan等[33]也研究了金属离子对辣根风味形成的影响,另外还研究了p H值、水浴温度、时间、湿度、抗坏血酸、干燥方法等诸多因素对辣根风味成分中的烯丙基异硫氰酸酯和β-苯乙基异硫氰酸酯含量的影响,以及β-环糊精、变性淀粉和大豆蛋白对风味物质的保留作用。陈虹霞等[34]以辣根为原料,研究硫代葡萄糖苷水解为异硫氰酸酯的转化率。结果表明,在温度40℃、pH7、料液比1∶20(m/V)的条件下,水中加入VC 0.2%(以辣根粉计),水解2h,水蒸气蒸馏法得到的异硫氰酸酯质量分数最高。Jia等[35]又发现完全气调储藏比部分气调储藏更能保持花椰菜内硫苷的含量,进而也更能保持蔬菜的风味成分。
由此可见影响硫苷降解产物因素的多样化。除此之外,张清峰等[36]研究了硫苷降解产物异硫氰酸酯的水解稳定性,并对其水解机理做出推测,将硫苷的降解又延伸到了深一层次。由于很多研究都没有对降解后产生的风味物质变化的原因作出阐述,因此就需要以后的研究进行拓展。
3 硫甙葡萄糖苷降解产物的分析方法
检测硫苷降解产物的化学方法很多,张清峰等[37]在化学方法分析硫苷降解产物上做出了很多研究。吗啉滴定法、哌啶滴定法、氯胺-T间接氧化法等都是很成功的检测方法。但为获得较为精确的风味组成,一般来说,主要利用的分析方法是用溶剂将其从植物组织中提取出来,再利用色谱技术进行分析,最常用的是GC-MS联用。Jiang等[16]利用哌啶滴定法测辣根水解后的异硫氰酸盐含量,再将辣根组织于65℃水解120min,水解液经过水蒸气蒸馏后用乙醚提取,用GC-MS分析风味物质的具体组成。Blaevi等[38]则利用Clevenger-type装置从辣根的叶、茎中提取硫苷降解产物和其他挥发性成分后,采用GC加GC-MS的方法进行性质分析。而若要获得纯度较高的降解产物,则需要色谱分离技术的应用。Vaughn等[39]研究了葱芥中的风味成分,采用有机溶剂旋蒸提取可挥发性成分,过亲脂性Sephadex LH-20柱进一步纯化,得到的组分经GC-MS测定,检测出烯丙基异硫氰酸酯、苯甲基异硫氰酸酯和2,3-环硫丙基腈。Vaughn等[40]创新的运用不同pH值的缓冲液,从
白芥末中提取出纯度高于97%的硫苷水解物,再进行GC-MS分析,开创了不用色谱方法而直接用化学方法提取高纯度硫苷水解物的先河。
应用色谱方法检测十字花科中风味物质上,LC-MS也是较为常用的一种。Song等[41]利用氨水将异硫氰酸盐类转化为相应的脲硫衍生物,再用LC-MS/MS方法检测异硫氰酸盐的组分及含量。随着新型检测食品风味物质的方法——固相微萃取法(SPME)的兴起,越来越多的风味研究用到这项技术,肖华志等[42]利用固相微萃取/气相色谱-质谱(SPME/GC-MS)联用技术检测出芥末油中6种风味成分,青芥辣中12种风味成分,以及冲菜中的17种风味组成。Zhao等[43]也利用SPME/GC-MS对雪里蕻腌菜发酵过程中的挥发性组分进行了分析,检测出87种组分,其中异硫氰酸盐有5种,腈类有4种。用SPME/ GC-MS分析方法简单、灵敏度高,且不用对分析物中的挥发性物质进行提取,进一步减少了实验的耗时和结果误差。
除以上较为常用的风味成分分析方法之外,还有Likens-Nickerson装置从罗马花椰菜中提取风味物质[44],或采用β-环糊精包埋风味物质再进行GC-MS检测等方法[45],只限于提取方法的改善,分析组分时所用的仪器手段没有太大变化。但Karcher等[46]利用毛细管电泳法测定硫苷降解产物,则是对风味成分进行分析的另辟蹊径。
4 硫甙葡萄糖苷降解产物的功能作用
硫苷降解产物因其功能作用的复杂而受到研究者们的广泛关注。硫苷降解产物一方面被认为能够有效抑制癌细胞的产生。其主要机制一是作为阻遏因子抑制阶段Ⅰ和诱导阶段Ⅱ生物转化酶的活性:其中阶段Ⅰ酶不仅能代谢某些毒素,还能激活某些致癌物质,因而可能导致致癌程度的增加。而阶段Ⅱ酶能催化阶段Ⅰ酶生成的一系列水解物或氧化还原产物解毒,使这些产物发生结合反应进而生成较易分泌的分子;一些阶段Ⅱ酶还能通过氧化还原反应破坏具有高度活化中央结构的致癌剂,进而抑制癌症[47];机制二是硫苷能作为抑制因子诱导癌细胞程序化死亡,由于癌细胞都具有基因毒性,修补基因组损伤的难度较大,利用癌细胞具有高代谢速率而较易程序化死亡的特点,可以诱导癌细胞程序化死亡以消灭癌细胞[48]。
另一方面,硫苷降解产物还在高等动物中表现出一系列毒性和抗营养化效应,其中研究最透彻的是对甲状腺的副作用。含有β-OH的硫苷能降解生成异硫氰酸盐和唑烷-2-硫,这两种降解产物都能导致甲状腺肿大。其中异硫氰酸盐会竞争碘离子,因此可在猪或鼠的饲料中增加碘离子浓度以减少甲状腺肿大的现象;而5-乙烯基唑烷-2-硫则直接抑制甲状腺合成。硫苷降解产物能通过不同的方式作用于动物或人体的甲状腺造成危害。
硫苷降解产物还有不少其他功能。Brabban等[49]研究表明硫苷对微生物的生长无任何影响,而它的水解产物则对微生物的生长具有抑制作用;Depree等[50]指出山葵中的异硫氰酸盐有较强的抗细菌、真菌作用,从山葵叶、叶柄、根等中提取的精油也能抑制血小板凝集作用;从洋葱中提取的物质也被证明具有抗哮喘效应。诸多研究都表明硫苷水解产物有着很强的功能作用,若能广泛开发,将极大程度的造福于人类。
随着人们消费水平的提高和消费方式的改变,追求辛辣刺激又健康的饮食方式逐渐被人们所喜爱,很多以十字花科蔬菜为主要原料的具有强烈辛辣冲味的调味品如辣根酱、芥末油等在近年来越来越广泛的进入人们的日常饮食[51]。硫苷降解产物,是这一辛辣冲味的主要来源,研究它的降解途径、降解机理和降解产物,必将积极推动此项研究在工业生产当中的应用,并在很大程度上推进我国在辛辣冲味调味品上落后于他国、依赖进口的劣势,满足消费者的需求。
[1]钱骅, 赵伯涛, 黄晓穗. 西兰花中β-硫甙葡萄糖苷总量的测定[J]. 中国野生植物资源, 2008, 27(2)∶ 52-53.
[2]BUROW M, ZHANG Z Y, OBER J A, et al. ESP and ESM1 mediate indol-3-acetonitrile production from indol-3-ylmethyl glucosinolate in Arabidopsis[J]. Phytochemistry, 2008, 69(3)∶ 663-664.
[3]ELFAKIR C, DREUX M. Simultaneous analysis of intact and desulfated glucosinoaltes with a porous graphitized carbon column[J]. Journal of Chromatography A, 1996, 727∶ 71-72.
[4]BONES A M, ROSSITER J T. The myrosinase-glucosinolate system, its organization and biochemistry[J]. Physiologia Plantarum, 1996, 97∶204-205.
[5]KLIEBENSTEIN D J, KROYMANN J, MITCHELL-OLDS T. The glucosinolate-myrosinase system in an ecological and evolutionary context [J]. Current Opinion in Plant Biology, 2005, 8∶ 264-271.
[6]MITHEN R F, DEKKER M, VERKERK R, et al. The nutritional significance, biosynthesis and bioavailability of glucosinolates in human foods[J]. Journal of Science and Food Agricultural, 2000, 80(7)∶973-974.
[7]DEKKER M, VERKERK R, JONGEN W M F. Predictive modeling of health aspects in the food production chain∶ a case study on glucosinolates in cabbage[J]. Trends in Food Sci Tech, 2000, 11∶ 177-178.
[8]FRANCIS F, LOGNAY G, WATHELET J P, et al. Effects of allelochemicals from first (Brassicaceae) and second (Myzus persicae and Brevicoryne brassicae) trophic levels on Adalia bipunctata[J]. Journal of Chemical Ecology, 2001, 27(2)∶ 243-244.
[9]LüTHY B, MATILE P H. The mustard oil bomb∶ rectified analysis of the subcellular organization of the myrosinase system[J]. Biochem. Physiol Pflanz, 1984, 179∶ 5-12.
[10]GROB K, MATILE P H. Compartmentation of ascorbic acid in vacuoles of horseradish root cells. Note on vacular peroxidase[J]. Z Pflanzenphysiol, 1980, 98∶ 235-243.
[11]BONES A M, SLUPPHAUG G. Purification, characterization and par-
tial amino acid sequencing of β-thioglucosidase from Brassica napus L.[J]. Journal of Plant Physiol, 1989, 134∶ 722-729.
[12]FRANCIS F, LOGNAY G, WATHELET J P, et al. Characterisation of aphid myrosinase and degradation studies of glucosinolates[J]. Archives of Insect Biochemistry and Physiology, 2002, 50∶ 173-182.
[13]GETAHUN S M, CHUNG F L. Conversion of glucosinolates to isothiocyanates in humans after ingestion of cooked watercress[J]. Cancer Epi Bio Pre, 1999, 8∶ 447-451.
[14]SMITS J P, KNOL W, BOL J. Glucosinolate degradation by Aspergillus clavatus and Fusarium oxysporum in liquid and solid-state fermentation [J]. Applied Microbiology and Biotechnology, 1993, 38∶ 696-697.
[15]SHEN L Q, SU G Y, WANG X Y. Endogenous and exogenous enzymolysis of vegetable-sourced glucosinolates and in uencing factors [J]. Food Chemistry, 2009, 8(3)∶ 1-2.
[16]JIANG Zitao, LI Rong, YU J C. Pungent components from thioglucosides in Armoracia rusticana grown in China, obtained by enzymatic hydrolysis [J]. Food Technol Biotechnol, 2006, 44(1)∶ 41-45.
[17]RAKARIYATHAM N, SAKORN P. Biodegration of glucosinolates in brown mustard seed meal (Brassica juncea) by Aspergillus sp.NR-4201 in liquid and solid-state cultures[J]. Biodegradation, 2002, 13∶ 395-399.
[18]SHATTUCK V I. Glucosinolates and glucosinolate degradation in seeds from turnip mosaic virus-infected rapid cycle Brassica campestris L. plants[J]. Journal of Experimental Botany, 1993, 44(5)∶ 963-970.
[19]VOLDEN J, BORGE G I A, BENGTSSON G B. Effect of thermal treatment on glucosinolates and antioxidant-related parameters in red cabbage (Brassica oleracea L. ssp. capitata f. rubra)[J]. Food Chemistry, 2008, 109∶ 595-596.
[20]MACLEOD A J, ROSSITER J T. Non-enzymic degradation of 2-hydroxybut-3-enylglucosinolate (progoitrin)[J].Phytochemistry, 1986, 25∶ 855-858.
[21]BONES A M, ROSSITER J T. The enzymic and chemically induced decomposition of glucosinolates[J]. Phytochemistry, 2006, 67∶ 1053-1067.
[22]OERLEMANS K, BARRETT D M. Thermal degradation of glucosinolates in red cabbage[J]. Food Chemistry, 2006, 95∶ 19-29.
[23]OLSEN O, SφRENSEN H S. Recent advances in the analysis of glucosinolates[J]. Journal of the American Oil Chemists Society, 1981, 9∶ 858-860.
[24]FENSICK G R, HEANEY R K, GEMLIN R, et al. Glucosinalbin in Brassica napus∶ a re-evaluation[J]. Zeitschrift fuer Pflanzenzuechtung, 1981, 87∶ 254-259.
[25]FRIIS P, LARSEN P O, OLSEN C E. Base-catalyzed neber-type rearrangement of glucosinolates [1-(β-D-glucosylthio)-N-(sulfonatooxy) alkylideneamines][J]. Journal of the Chemical Society∶ Perkin Transactions 1, 1977(6)∶ 661-665.
[26]de VOS R H, BLIJLEVEN W G H. The effect of processing conditions on glucosinolates in cruciferous vegetables[J]. Ubersichtsbericht, 1988, 187∶ 526-529.
[27]VOLDEN J, BORGE G I A, HANSEN M, et al. Processing (blanching, boiling, steaming) effects on the content of glucosinolates and antioxidant-related parameters in cauliflower (Brassica oleracea L. ssp. botrytis) [J]. Food Science and Technology, 2009, 42∶ 63-73.
[28]WENNGERG M, EKVALL J, OLSSON K, et al. Changes in carbohydrate and glucosinolate composition in white cabbage (Brassica oleracea var. capitata) during blanching and treatment with acetic acid[J]. Food Chemistry, 2006, 95∶ 226-236.
[29]MARTINEZ-VILLALUENGA C, PENAS E, FRIAS J, et al. Influence of fermentation conditions on glucosinolates, ascorbigen, and ascorbic acid content in white cabbage (Brassica oleracea var. capitata cv. Taler) cultivated in different seasons[J]. Food Chemistry, 2009, 74(1)∶ 62-67.
[30]ILDIKO S G, KLARA K A, MARIANNA T M, et al. The effect of radio frequency heat treatment on nutritional and colloid-chemical properties of different white mustard (Sinapis alba L.) varieties[J]. Innovative Food Science Emerging Technologies, 2006, 7∶ 74-79.
[31]van EYLEN D, OEY I, HENDRICKX M, et al. Effects of pressure/ temperature treatments on stability and activity of endogenous broccoli (Brassica oleracea L.cv. Italica) myrosinase and on cell permeability[J]. Journal of Food Engineering, 2008, 89∶ 178-186.
[32]UDA Y, KURATA T, ARAKAWA N. Effects of pH and ferrous ion on the degradation of glucosinolates by myrosinase[J]. Agric Biol Chem, 1986, 50(11)∶ 2735-2740.
[33]PAN S Y, HYDAMAKA A, KUO A. Horseradish flavor formation optimization[J]. Transactions of the CSAE, 2003, 19(5)∶ 141-145.
[34]陈虹霞, 王成章, 叶建中, 等. 辣根硫代葡萄糖苷水解工艺比较及其水解产物的结构鉴定[J]. 林产化学与工业, 2009, 29(2)∶ 100-104.
[35]JIA Chengguo, XU Chaojiong, WEI Jia, et al. Effect of modied atmosphere packaging on visual quality and glucosinolates of broccoli orets [J]. Food Chemistry, 2009, 114(1)∶ 28-37.
[36]张清峰, 姜子涛, 张云华. 辣根油中异硫氰酸酯的水解稳定性研究[J]. 食品科学, 2005, 26(11)∶ 125-127.
[37]张清峰, 姜子涛, 董峰光, 等. 二乙胺滴定法测定辣根及芥末制品中异硫氰酸酯含量的研究[J]. 中国调味品, 2005(2)∶ 48-51.
[38]BLAZEVIC I, MASTELIC J. Glucosinolates degradation products and other bound and free volatiles in the leaves and roots of radish(Raphanus sativus L.)[J]. Food Chemistry, 2009, 113∶ 96-102.
[39]VAUGHN S F, BERHOW M A. Allelochemicals isolated from tissues of the invasive weed garlic mustard (Alliaria petiolata)[J]. Journal of Chemical Ecology, 1999, 25 (11)∶ 2495-2502.
[40]VAUGHN S F, BERHOW M A. Glucosinolate hydrolysis products from various plant sources∶ pH effects, isolation, and purification[J]. Industrial Crops and Products, 2005, 21∶ 193-202.
[41]SONG L J, MORRISON J J, BOTTING N P. Analysis of glucosinolates, isothiocyanates, and amine degradation products in vegetable extracts and blood plasma by LC-MS/MS[J]. Analytical Biochemistry, 2005, 347∶ 234-243.
[42]肖华志, 牛丽影, 廖小军, 等. 芥末油、青芥辣、冲菜的挥发性风味成分的SPME-GC-MS测定[J]. 中国调味品, 2004(6)∶ 44-45.
[43]ZHAO Dayun, TANG Jiang, DING Xiaolin. Analysis of volatile components during potherb mustard (Brassica juncea, Coss.) pickle fermentation using SPME-GC-MS[J]. LWT, 2007, 40∶ 439-447.
[44]VALETTE L, FERNANDEZ X, POULAIN S, et al. Volatile constituents from Romanesco cauliflower[J]. Food Chemistry, 2003, 80∶ 353-358.
[45]YU J C, JIANG Zitao, LIU Hoyan, et al. β-Cyclodextrin epichlorohydrin copolymer as a solid-phase extraction adsorbent for aromatic compounds in water samples[J]. Analytica Chemica Acta, 2003, 477(1)∶ 93-101.
[46]KARCHER A, RASSI Z E. Capillary electrophoresis of glucosinolates and their degradation products[J]. Electrophresis, 1999, 20∶ 3181-3189.
[47]修丽丽, 钮昆亮. 十字花科植物中的硫甙葡萄糖苷及其降解产物[J].浙江科技学院学报, 2004, 16(3)∶ 189-190.
[48]汪俏梅, ABEL S. 异硫代氰酸盐的抗癌机理及其相关研究[J]. 细胞生物学杂志, 2002, 24(3)∶ 171-173.
[49]BRABBAN A D, EDWARDS C. The effects of glucosinolates and their hydrolysis products on microbial growth[J]. Journal of Applied Bacteriology, 1995, 79∶ 171-177.
[50]DEPREE J A, HOWARD T M, SAVAGE G P. Flavour and pharmaceutical properties of the volatile sulphur compounds of Wasabi (Wasabia japonica)[J]. Food Research International, 1999, 31(5)∶ 329-337.
[51]牛丽影,肖华志, 胡小松, 等. 冲菜辛辣风味物质的顶空固相微萃取-气质联用法测定[J]. 中国食品学报, 2005, 5(3)∶ 122-123.
Research Progress in the Degradation of Glucosinolates
LI Chen,XUE Feng,MIAO Wen-hua,PAN Si-yi*
(College of Food Science and Technology, Huazhong Agricultural University, Wuhan 430070, China)
Biosynthesis, degradation pathways, degradation product analysis, degradation product functions of glucosinolates play important roles in the secondary metabolites in Cruciferae plants, which has been reviewed in this paper. The biosynthesis of glucosinolates was completed using amino acids as the substrates through three steps. The degradation pathways of glucosinolates were classified as enzymatic degradation, thermal degradation and chemical degradation. Chemical and chromatographic analyses were the major strategies for the analysis of glucosinolate degradation products. The degradation products of glucosinolates exhibited a positive role in anti-cancer as well as a negative role in anti-nutrient.
glucosinolates;degradation pathway;degradation product analysis;degradation product function
TS255.1
A
1002-6630(2010)09-0313-05
2009-10-23
李晨(1987—),女,硕士研究生,研究方向为食品科学。E-mail:lichen@webmail.hzau.edu.cn
*通信作者:潘思轶(1964—),男,教授,博士,研究方向为食品生物技术。E-mail:pansiyi@mail.hzau.edu.cn

