水菖蒲内生菌分离与抗菌活性菌株筛选
周晓坤,陈 钧,*,韩邦兴,2,何 佳,刘长风
(1.江苏大学药学院,江苏 镇江 212013;2.植物细胞工程安徽省工程技术研究中心,安徽 六安 237012)
水菖蒲内生菌分离与抗菌活性菌株筛选
周晓坤1,陈 钧1,*,韩邦兴1,2,何 佳1,刘长风1
(1.江苏大学药学院,江苏 镇江 212013;2.植物细胞工程安徽省工程技术研究中心,安徽 六安 237012)
对水菖蒲内生真菌进行分离,并进行抗菌活性的筛选。采用改良氯化三苯四氮唑显色(TTC)微量稀释法筛选抗菌活性菌株。以18种常见导致食品腐败的细菌、酵母菌和霉菌为指示菌研究活性菌株的抗菌能力。结果显示,水菖蒲内存在广泛的具有抗菌活性的内生菌,占内生菌总数的40.7%,高活性菌株占内生菌总数的12.39%。其中S9菌株发酵液具有抗细菌、酵母菌和丝状真菌的广谱抗菌能力,是潜在的食品防腐抗菌资源。
水菖蒲;内生菌;抗菌活性
植物内生菌是指那些在其生活史的一定阶段或全部阶段生活在健康植物组织或器官内部的并不引起宿主植物出现明显病害症状的真菌[1-2]。由于内生菌与宿主植物协同进化,可以产生和宿主相同或相似的生理活性成分[3-4],因此,从传统药用植物及一些特殊环境植物内生菌中筛选活性菌株,已成为微生物领域的研究热点[5-6]。
水菖蒲(Acorus calamus L.)为天南星科植物,药用根茎,具有化痰开窍、杀虫止痒之功效[7]。现代研究表明水菖蒲具有抗炎、抑菌杀虫、抗糖尿病等多种药理活性[8-9]。目前,关于水菖蒲的研究多集中于化学成分和药理作用等方面[8-10],尚未见对水菖蒲内生菌分离及其代谢产物活性方面的报道。本实验对水菖蒲内生菌进行分离纯化,并对其抗菌活性菌株进行筛选,以为水菖蒲内生菌资源的开发利用提供参考。
1 材料与方法
1.1 材料
在镇江江苏大学内采摘无可见病斑的健康水菖蒲根茎和叶,原植物由江苏大学药学院韩邦兴博士鉴定,确认为水菖蒲(Acorus calamus L.)。
1.2 指示菌
常见食品腐败菌:铜绿假单胞菌(Pseudomonas aeruginos,P.a)ATCC27853、大肠杆菌 (Escherichia coli,E.c)、金黄色葡萄球菌(Staphyloccus au reus,S.a)、枯草芽孢杆菌 (Bacillus su btilis,B.s)、普通变形杆菌 (Proteus vulgar is,P.v)、产气杆菌(Bacillus aerogenes,B.a)、纳豆芽孢杆菌Bacillus natto,B.n)蜡状芽孢杆菌 (Bacillus cereu s,B.c)、热带假丝酵母(Candida tropicalis,C.t)、酿酒酵母 (Saccharomyces cerevisiae,S.c)、黑曲霉(Aspergillus niger,A.n)、康
宁木霉(Trichoderma koningii,T.k)11种指示菌均由江苏大学药学院制药工程系保存。
常见农业病原菌:水稻纹枯病菌 (C o r t i c i u m sasakii,C.s)AS3.2872、亚麻刺盘孢(Colletotrichum lini,C.l)AS3.4486、禾谷镰孢 (Fusarium graminearum,F.g)AS3.4598由中国科学院微生物研究所提供;棉灰星盘多毛孢菌Pestalotia gossypii Hori,P.g)由江苏农业科学院植物保护研究所提供。
常见人体病原真菌:新型隐球菌(Cryptococcus neoformans,C.n)、白色念珠菌(Candida albicans,C.a)由江苏大学医学技术学院提供。
1.3 培养基
分离培养基:马铃薯葡萄糖液体培养基配方为:马铃薯2g/100mL、葡萄糖0.2g/100mL,其中加入0.15g/100mL琼脂为固体培养基(PDA);加入150μg/mL青霉素钾和120μg/mL硫酸链霉素为双抗培养基;真菌培养基、沙堡氏培养基 南京博尔迪生物科技有限公司。
1.4 试剂
二甲基亚砜(DMSO)、吐温-80、次氯酸钠溶液(活性氯含量5.2%) 国药集团化学试剂有限公司;两性霉素B(AmB) Sunshine公司;青霉素钾、硫酸链霉素、硫酸阿米卡星(Ak) 华北制药有限公司;氯化三苯四氮唑(TTC) 上海试剂三厂。
1.5 仪器与设备
TS100倒置显微镜 Nikon公司;SPX-250B生化培养箱 上海跃进医疗器械厂;QYC-211全控温摇床 上海福玛试验设备有限公司;SW-CJ-2FD超净工作台 江苏苏净集团有限公司;U410-86超低温冷冻冰箱 New Brunswick Scientific公司;96孔微量板 Corning公司。
1.6 方法
1.6.1 内生菌的分离纯化
水菖蒲洗净晾干后,摘下叶和根茎。在超净工作台上进行以下操作:75%乙醇浸泡根茎、叶120s后,用不同浓度次氯酸钠溶液浸泡2~600s,无菌水漂洗4次。去根茎两头褐变部分,并剪成0.5cm小段,将叶剪成0.5cm×0.5cm小片。上述材料植入马铃薯葡萄糖双抗固体培养基、10%马铃薯葡萄糖双抗培养基平板中,每皿4~5片(段),22~28℃倒置培养。待根茎、叶培养基切面处长出菌丝后,挑取其尖端部分移至PDA平板上,28℃培养,反复纯化得水菖蒲内生真菌纯培养物,根据形态学特征去除相同菌株。各菌株编号后于4℃冰箱保藏备用。设置环境对照、组织印迹对照和漂洗对照确保各环节无菌操作。
1.6.2 分类鉴定
根据内生真菌主要的群体形态特点和个体形态特点,参考文献[11]进行分类鉴定。
1.6.3 内生真菌发酵液的制备
于250mL三角瓶中加入50mL马铃薯葡萄糖液体培养基,灭菌,接入内生菌,28℃、120r/min振荡培养7d。将内生菌发酵液在-70℃和20℃条件下反复冻融3次,以释放胞内产物,滤去菌丝体,滤液过细菌过滤器得供试药液。
1.6.4 指示菌菌悬液制备
各细菌在牛肉膏蛋白胨培养基中增菌至108CFU/mL后,用牛肉膏蛋白胨培养基稀释至含菌量为106CFU/mL。
用沙堡氏斜面培养基活化酵母样真菌,以液体培养基稀释至菌含量为104CFU/mL。
丝状真菌在PDA斜面上28℃培养7~10d,产生孢子。加入含有0.1%吐温-80的沙堡氏液体培养基制备悬液,悬液静置3~5min,取上层均质液体(含孢子以及菌丝片段)至无菌试管,振荡5s,镜检,用沙堡氏液体培养基调整菌悬液至104CFU/mL。
1.6.5 抗菌活性菌株的筛选
参考NCCLSM38-A和M27实验方案[12-14],采用微量稀释法,以金黄色葡萄球菌为革兰氏阳性菌初筛指示菌、大肠杆菌为革兰氏阴性菌初筛指示菌,对内生菌进行抗细菌活性初筛。
1.6.6 高活性菌株的抗菌活性研究
参考NCCLSM38-A和M27实验方案[12-14],采用微量稀释法,测定内生菌S9、S15、S24、S70菌株最小抑菌浓度(MIC)、最小杀菌浓度(MBC)。以硫酸阿米卡星为抗细菌实验阳性对照或加入两性霉素B为抗真菌实验阳性对照,以无菌水为阴性对照。
2 结果与分析
2.1 水菖蒲内生真菌分离结果

表1 水菖蒲内生真菌的种群、数量与种类分布Table 1 Genera, quantity and compositions of endophytes isolated fromAcorus calamusL.
根据菌落培养特征,先后8次共从水菖蒲根茎和叶中分离出内生菌113株,经微生物形态观察,初步鉴定为2纲4目5科15属(表1),种类繁多,其中以从梗科居多,为48株,占所有菌株的42.5%。根茎、叶中均有分布,叶中的内生菌数量明显少于根茎中。
2.2 抑菌活性菌株初筛选
经反复筛选,从113株内生菌中筛选出了46株对大肠杆菌或金黄色葡萄球菌有抗菌活性的菌株,占所有菌株的40.7%。其中42株对金黄色葡萄球菌有抗菌能力,占所有菌株的37.2%;30株对大肠杆菌有抗菌活性,占所有菌株的26.5%;26株对金黄色葡萄球菌和大肠杆菌都有抑菌活性,占所有菌株的23.0%。有14株表现出了较强的抑菌效果,在发酵液体积分数为25%时,对金黄色葡萄球菌和大肠杆菌有明显的抑制效果。其中S9、S15、S24、S70抑菌效果最强(表2),故对以上4株菌抗菌能力进一步研究。
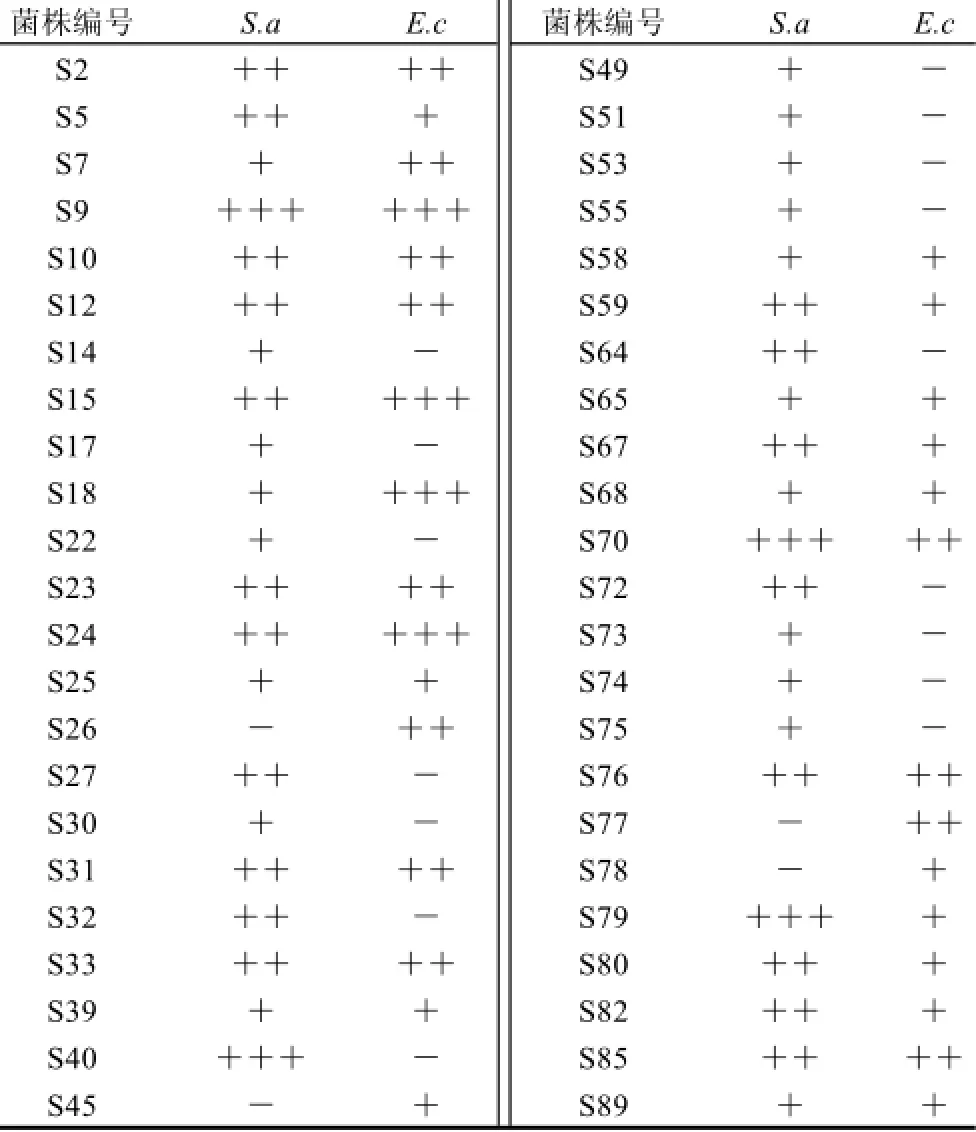
表2 46株对细菌有抗菌活性的水菖蒲内生真菌及抗菌活性Table 2 Antibacterial activities of 46 active endophytic strains
2.3 S9、S15、S24、S70 抑菌活性菌株的能力研究
2.3.1 抑制细菌活性菌株的能力
表3、4表明,S9、S15、S24、S70都具有不同程度的广谱抑菌、杀菌能力。其中,S 9抑菌、杀菌能力较强,对大肠杆菌和纳豆芽孢杆菌的MIC仅为发酵原液的0.75%,对其余6种指示菌的MIC也仅为发酵原液的1.5%。S15、S24、S70的MIC(除部分未测出外)在12.5%发酵原液到25%发酵原液之间。S9的MBC也普遍较低,在发酵原液的1.5%~6.2%之间,对大肠杆菌和纳豆芽孢杆菌的杀菌作用尤为突出,仅为1.5%发酵原液。其他3株菌的杀菌浓度在25%~50%发酵原液之间,部分未测出,对纳豆芽孢杆菌都无杀菌作用。综合以上实验结果,S9具有很好的抑菌、杀菌能力,效果明显优于S15、S24、S70。

表3 抑菌活性菌株对细菌指示菌的MICTable 3 MICs of active endophytic strains
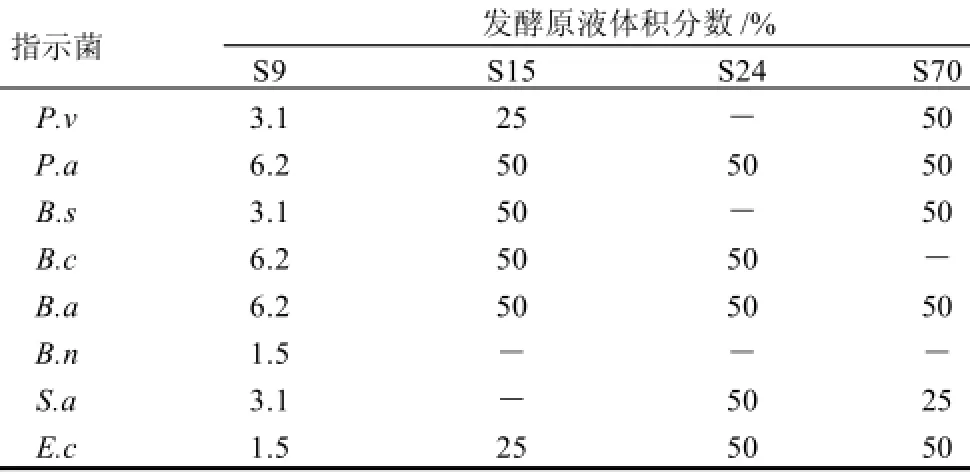
表4 抑菌活性菌株对细菌指示菌的MBCTable 4 MBCs of active endophytic strains
2.3.2 抑制酵母样真菌活性菌株的能力

表 5 抑菌活性菌株对酵母样真菌指示菌的MICTable 5 MICs of active endophytic strains
如表5所示:S9、S15、S24、S70 4种内生菌对4种酵母样指示菌有不同程度的抑制作用。其中S9和S15
对4种酵母样真菌有一定的抑制作用,其中对酿酒酵母的抑制作用明显,MIC分别为6.2%发酵原液和3.1%发酵原液。S70对除酿酒酵母以外的3株酵母样指示菌均有抑制作用,对白色念珠菌的抑制作用明显,M I C为6.2%发酵原液。S24对白色念珠菌的最小抑菌浓度为50%发酵原液,对其余3种酵母样真菌基本无抑制作用。
2.3.3 抑制丝状真菌活性菌株的能力

表 6 抑菌活性菌株对丝状真菌指示菌的MICTable 6 MICs of active endophytic strains to filamentous fungi
如表6所示,S9、S15、S24、S70 4种内生菌对6 种农业病原菌有不同程度的抑制作用。S9除对木霉没有抑制作用外,对其他5种丝状真菌有明显的抑制作用,对水稻纹枯病菌的抑制作用最强,MIC为0.75%发酵原液;S15和S70对3种丝状真菌有抑制作用,S70对稻瘟霉的抑制作用较强,MIC为6.2%发酵原液;S24对稻瘟霉的最小抑菌浓度为50%发酵原液,对其他真菌无明显抑制作用。
2.4 S9、S15、S24、S70 的形态学鉴定
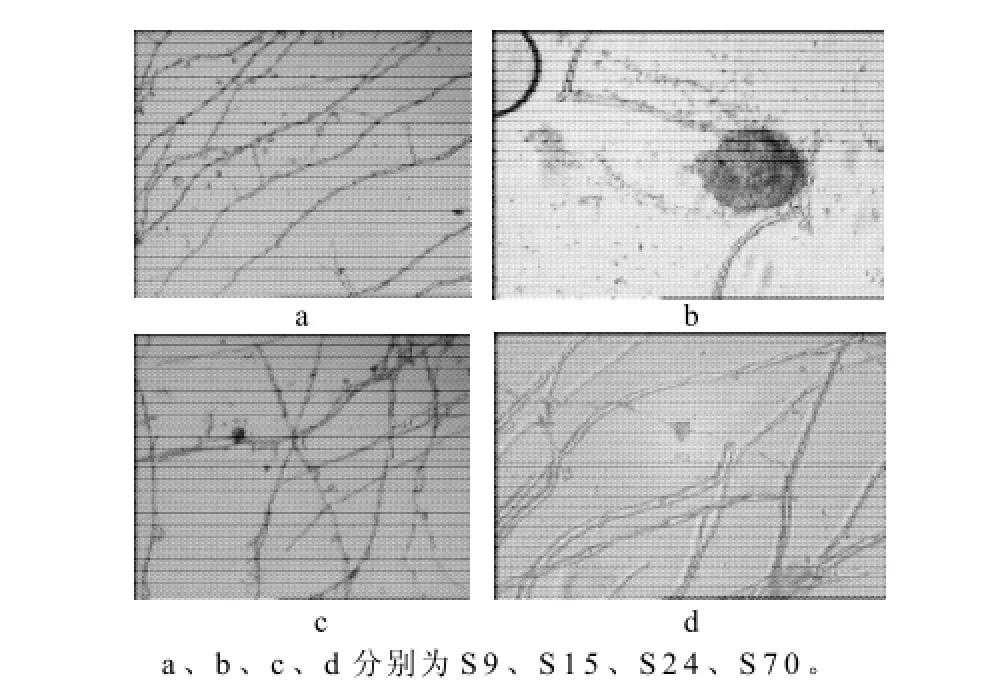
图1 分离菌株的显微形态(×40)Fig.1 Micro-morphology of S9, S15, S24 and S70 strains (×40)
S9菌落灰绿色,边缘菌丝白色,菌丝不光滑,分隔,大量分生孢子,分生孢子梗,孢子串生。鉴定为木霉属(Trichoderma sp.)。
S15菌落具有不规则的放射状皱纹,绒状,产生大量的分生孢子,暗褐至黑色,反面呈较暗的黄褐色。分生孢子梗发生于基质;孢梗茎壁平滑;顶囊球形或近球形,分生孢子球形或近球形。鉴定为为曲霉属(Aspergillus sp.)。
S24菌落白色,菌丝密集,基质白色。显微特征为分生孢子梗分枝,分生孢子聚生成葡萄穗状,球形、椭圆形或圆筒形,单细胞,无色,菌核黑色。鉴定为葡萄孢属(Botrytis sp.)。
S70菌落为白色,菌丝长绒毛状,可见绿色孢子,菌丝有隔膜,孢子着生在树枝状分生孢子梗上。鉴定为青霉属(Penicillium sp.)。
3 讨 论
植物内生菌可以工业化发酵培养,大规模生产有效成分,开发出新的农药、医药和食品防腐剂等。如Strobel研究小组从锡兰肉桂(Cinnam omumzeylanicum)、心叶船形果木(Eucryphia cordifolia)等植物分离到内生菌Muscodor albus和黏帚霉(Gliocladium sp.),能够产生抗菌活性较强的挥发性物质,并成功开发出真菌熏蒸剂[15]。
本实验选用大肠杆菌和金黄色葡萄球菌作为初筛指示菌,分别代表了G+、G-菌,对分离得到的113株水菖蒲内生菌进行了抗菌活性初筛,选用18种常见导致食品腐败的细菌、酵母菌和霉菌为指示菌研究活性菌株的抗菌能力。结果表明,有40.7%的菌株对至少一种指示菌有抗菌活性,12.39%的菌株具有较高的抗菌活性,尤其是S9具有明显的抗细菌、酵母菌和丝状真菌的广谱抗菌能力,表明水菖蒲中有丰富的内生菌资源,其代谢产物有潜在的抗菌物质存在。在此基础上,可以针对性地分离有效活性物质,开发成食品防腐抗菌资源。
[1]CLAY K, HOLAH J. Fungal endophyte symbiosis and plant diversity in successional fields[J]. Science, 1999, 285(5434)∶ 1742-1744.
[2]SAIKKONEN K, WALI P, HELANDERM, et al. Evolution of endophyte pant symbioses[J]. Trends Plant Sci, 2004, 9(8)∶ 275-280.
[3]STROBEL G A, DAISY B. Bioprospecting for microbial endophytes and their natural products[J]. Microbiol Molbiolrev, 2003, 6(7)∶ 491-502.
[4]TAN Renxiang, ZOU Wenxin. Endophytes∶ A rich source of functional metabolites[J]. Nat Prod Rep, 2001, 18(4)∶ 448-459.
[5]赫荣乔. 植物内生菌成为我国当前微生物研究领域的热点[J]. 微生物学通报, 2009, 36(1)∶ 1.
[6]皱文欣, 谭仁祥. 植物内生菌研究新进展[J]. 植物学报, 2001, 43(9)∶881-892.
[7]《中华本草》编委会. 中华本草∶ 第八册[M]. 上海∶ 上海科学技术出版社, 1999∶ 468-472.
[8]WU Haoshu, ZHU Difeng, ZHOU Changxin, et al. Insulin sensitizing
activity of ethyl acetate fraction of Acorus calamus L. in vitro and in vivo [J]. Journal of Ethnopharmacology, 2009, 123 (2)∶ 288-292.
[9]KIM H, HAN T H, LEE S G. Anti-inflammatory activity of a water extract of Acorus calamus L. leaves on keratinocyte HaCaT cells[J]. Journal of Ethnopharmacology, 2009, 122(1)∶ 149-156.
[10]龚先玲, 典灵辉, 张立坚, 等. 水菖蒲根状茎与根挥发油化学成分研究[J]. 中国药房, 2007, 18(3)∶ 176-178.
[11]魏景超. 真菌鉴定手册[M]. 上海∶ 上海科学技术出版社, l982.
[12]李厚敏, 刘伟, 李若瑜. 美国临床实验室标准化委员会2003年版产孢丝状真菌药敏试验方案简介[J]. 中华检验医学杂志, 2005, 28(1)∶121.
[13]ESPINEL A, RODRIGUEZ J L, MARTINEZ J V. Comparison of two altenative emicrodilution procedures with the national committee for clinical laboratory standards reference macrodilution method M27-P for in vitro testing off luconazole-resistant and susceptible isolates of Candida albicans[J]. J Clin Microbiol,1995, 33(2)∶ 31-41.
[14]徐叔云, 卞如濂, 陈修. 药理实验方法学[M]. 3版. 北京∶ 人民卫生出版社, 2002∶ 1658-1712.
[15]STROBEL G A, EZRA D. The application of volatile antibiotics and non-volatile inhibitors from Muscodor spp. to control harmful microbes in human and animal wastes∶ US, EP20040758618[P]. 2006-04-01.
Screening and Inhibitory Activity of Endophytic Fungi from Acorus calamus L.
ZHOU Xiao-kun1,CHEN Jun1,*,HAN Bang-xing1,2,HE Jia1,LIU Chang-feng1
(1.College of Pharmacy, Jiangsu University, Zhenjiang 212013, China;2. Anhui Engineering Technology Research Center of Plant Cell Engineering, Lu’an 237012, China)
In order to isolate and screen endophytic fungi with inhibitory activity from Acorus calamus L., active strains were screened through modified TTC micro-dilution method. MIC (minimum inhibitory concentration) and MBC (minimum bactericidal concentration) were detected using 18 food spoilage strains. Results indicated that 40.7% endophytes exhibited antimicrobial activity and 12.39% endophytes exhibited higher antimicrobial activity. In addition, strain S9 exhibited the broadspectrum antimicrobial activity to bacteria, yeast and mycelia fungi. Active endophytic strains from A. calamus L. are potential resources for food preservation.
Acorus calamus L.;endophytic fungi;antibacterial activity
Q933
A
1002-6630(2010)09-0211-05
2009-07-09
周晓坤(1984—),女,硕士研究生,主要从事微生物来源活性物质研究。E-mail:zhouxiaokun1984@126.com
*通信作者:陈钧(1967—),男,教授,博士,主要从事微生物来源活性物质研究。 E-mail:syxchenjun@126.com

