泰和乌骨鸡活性肽补血作用研究
王 勇,刘建华,田颖刚,朱 胜,谢明勇*
泰和乌骨鸡活性肽补血作用研究
王 勇,刘建华,田颖刚,朱 胜,谢明勇*
(南昌大学 食品科学与技术国家重点实验室,江西 南昌 330047)
目的:探讨泰和乌骨鸡活性肽体内补血作用。方法:利用失血法和骨髓抑制药物氟尿嘧啶注射法联合建立小鼠血虚模型,并测定红细胞(RBC)和血红蛋白(HGB)水平,观察乌骨鸡活性肽及其一种分离活性肽(简称组分A)对血虚小鼠的补血作用。结果:活性肽组RBC水平在第12天时与血虚组相比差异显著(P<0.05);活性肽组在第6至12天期间升高RBC和HGB作用水平与阿胶组相比明显加快,具有显著性差异(P<0.05)。第18天时活性肽组HGB水平已超过各组水平,且与正常组相比具有显著性差异(P<0.05)。活性肽组分A组的RBC水平在各个时间点均高于血虚组,但均无显著性差异(P>0.05),活性肽组分A组在第20天时HGB水平已与正常组无显著性差异(P>0.05),而血虚组和阿胶组仍与正常组有极显著差异(P<0.01)。结论:泰和乌骨鸡活性肽及活性肽组分A能够在一定程度上提高氟尿嘧啶血虚模型小鼠的红细胞和血红蛋白水平,具有一定的补血作用。
泰和乌骨鸡;活性肽;血虚模型;补血
泰和乌骨鸡又名中国泰和鸡、武山鸡,原产江西泰和县,它具有乌皮、乌骨、乌肉等十大特征,集观赏、肉用、药用于一身,是我国传统意义上公认的天然药用鸡种[1-4]。目前,泰和乌骨鸡营养和活性成分及功效已得到了较为系统的研究,已发现泰和乌骨鸡具有高肌肽[5]、高磷脂[6]、低脂肪,在其脂肪酸组成中多不饱和脂肪酸、必需脂肪酸和花生四烯酸比例较高等特点[7-8],且其总脂质具有明确的补血作用[9]。《本草便
读》中称乌骨鸡为“补肝家血液之亏,理产治劳,甘平无毒,治肺肾虚羸之疾……故肝肺肾三脏血液不足者最宜”[10]。以乌骨鸡为主药的乌鸡白凤丸具有补养气血、调经止带的主要功效[11]。乌骨鸡活性肽即为乌骨鸡肌肉蛋白通过一定优化工艺酶促水解后而获得的具有一定分子质量范围的多肽产物[12]。目前对于乌骨鸡的确切药理作用还不明确,关于乌骨鸡活性肽补血作用的研究尚未见报道。本实验利用失血法和骨髓抑制药物氟尿嘧啶注射法联合建立小鼠血虚模型,对实验室制备的乌骨鸡活性肽,及对其分离所得一种活性肽的补血作用进行研究,以期为乌骨鸡的综合利用和进一步开发乌骨鸡活性肽资源提供依据。
1 材料与方法
1.1 材料、试剂与仪器
昆明种小鼠,雄性,体质量18~22g,由南昌大学医学院实验动物中心提供,合格证号:医动字第021-9602号;泰和乌骨鸡由深圳生物谷集团江西泰和乌鸡原种鸡场提供。
氟尿嘧啶注射液(5-FU,国药准字H31020593,批号090810) 上海旭东海普药业有限公司;阿胶补血口服液(国药准字Z10920057,批号090901) 山东福胶集团有限公司。
TEK-3600全自动三分群血细胞分析仪 江西特康科技有限公司。
1.2 方法
1.2.1 活性肽及活性肽组分A的制备
泰和乌骨鸡活性肽是由新鲜泰和乌骨鸡,经脱毛、去内脏、绞成肉泥,然后采用木瓜蛋白酶酶解制得(加酶量为0.3%);活性肽组分A是由泰和乌骨鸡活性肽经制备型高效液相色谱制备获得。
色谱条件:仪器:Waters 4000制备型高效液相色谱仪;流动相:0.01mol/L pH6.8磷酸盐溶液;色谱柱:Bondapak C18(30mm×300mm,15μm);活性总肽质量浓度:50mg/mL;流动相流速:18mL/min;进样量:1000μL;柱温:27℃;检测器:PAD 2996;检测波长:214nm。
1.2.2 乌骨鸡活性肽血虚模型的建立及实验设计
经前期实验发现,当乌骨鸡活性肽剂量为5g/kg bw时具有相对较好的补血效果,故在本模型建立时采用此剂量。建立血虚动物模型通常是使动物外周血红细胞或白细胞数量下降,或是使动物骨髓抑制,减少外周血细胞的生成[13]。本实验中,血虚模型的制备参考吴宏忠等[14]的方法,并作一定修改。取雄性昆明小鼠48只,体质量30~35g,编号随机均分为4组,每组分别灌胃:乌骨鸡活性肽(5g/kg bw)、阿胶补血口服液(13mL/kg bw)和同体积生理盐水(正常组和血虚模型组)。建立血虚模型方法如下:第1天,除正常组外,其他各组小鼠尾静脉注射氟尿嘧啶150mg/kg bw[15],2h后全体小鼠即开始灌胃各试剂,连续给药18d;第2天用内径为1mm的毛细管给每只小鼠一次性眼眶放血0.7mL。于第6、12和18天眼眶取血0.2mL,EDTA二钾抗凝,用全自动血细胞分析仪测定小鼠红细胞(RBC)和血红蛋白(HGB)值。
1.2.3 乌骨鸡活性肽组分A血虚模型的建立及实验设计
取雄性昆明小鼠48只,体质量30~35g,编号,随机均分为4组,每组分别灌胃:乌骨鸡活性肽组分A (500mg/kg bw)、阿胶补血口服液(13mL/kg bw)和同体积生理盐水(正常组和血虚模型组)建立血虚模型方法如下:第1天,除正常组外,其他各组小鼠尾静脉注射氟尿嘧啶150mg/kg bw,2h后全体小鼠即开始灌胃各试剂,连续给药20d;第2天用内径为1mm的毛细管给每只小鼠一次性眼眶放血0.7mL。于第5、10、15和20天眼眶取血0.2mL,EDTA二钾抗凝,用自动血细胞分析仪测定小鼠RBC、HGB值。
1.3 统计学处理
采用SPSS 13.0数据处理软件,各组数据结果以均数±标准差(x±s)表示,各组数据采用O n e-W a y ANOVA进行单因素方差分析,并进行LSD两两比较,P<0.05为差异具有显著性。
2 结果与分析
2.1 泰和乌骨鸡活性肽对小鼠RBC、HGB值的影响
表1 泰和乌骨鸡活性肽对血虚小鼠RBC的影响(x±s,n=12)Table 1 Effect of bioactive peptides from TBSF on RBC of blood deficiency mice (±s,n=12)
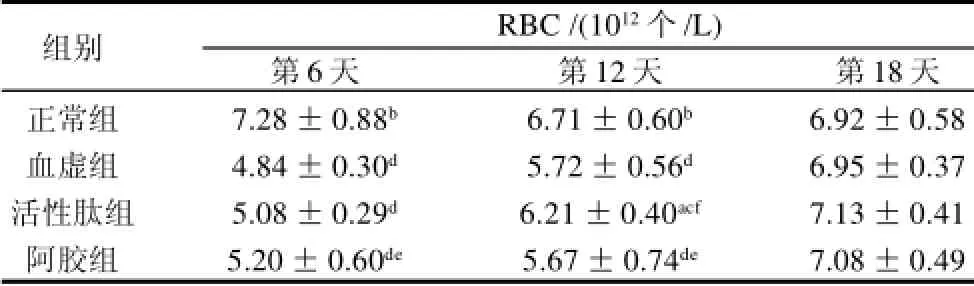
表1 泰和乌骨鸡活性肽对血虚小鼠RBC的影响(x±s,n=12)Table 1 Effect of bioactive peptides from TBSF on RBC of blood deficiency mice (±s,n=12)
注:a.与血虚组相比,有显著性差异(P<0.05);b.与血虚组相比,有极显著性差异(P<0.01);c.与正常组相比,有显著性差异(P<0.05);d.与正常组相比,有极显著性差异(P<0.01);e.与活性肽组相比,有显著性差异(P<0.05);f.与阿胶组相比,有显著性差异(P<0.05)。下同。
组别RBC /(1012个/L)第6天第12天第18天正常组7.28±0.88b6.71±0.60b6.92±0.58血虚组4.84±0.30d5.72±0.56d6.95±0.37活性肽组5.08±0.29d6.21±0.40acf7.13±0.41阿胶组5.20±0.60de5.67±0.74de7.08±0.49
由表1可见,造模后活性肽组的红细胞水平在各个时间点均高于血虚组。与血虚组相比,活性肽组RBC水平分别增长了5.0%、8.6%、2.6%。第12天时二者相比RBC值差异显著(P<0.05)。与正常组相比,在第18天时活性肽组及血虚组RBC水平与正常组已无显著性
差异(P>0.05),但超过正常组3.0%,而阿胶组RBC水平虽也与正常组无显著性差异(P>0.05),但超过幅度仅为正常组2.3%,不及活性肽组。与活性肽组相比,阿胶组升高RBC的作用更快,第6天时其RBC水平与活性肽组相比具有显著性差异(P<0.05),但在第12天时活性肽组RBC水平即超过阿胶组达9.5%,且与阿胶组相比具有显著性差异(P<0.05),说明活性肽在第6至12天期间升高RBC水平的作用与阿胶相比明显加快。在第18天时活性肽组RBC水平已超过各组水平。提示活性肽能促进血虚小鼠红细胞的增殖,具有一定的补血作用。由表2可见,第6、12、18天活性肽组的HGB水平均比血虚组高,分别增长了6.4%、9.6%、4.4%,但无显著性差异(P>0.05)。与活性肽组相比,阿胶组升高HGB的作用更快,且具有显著性差异(P<0.05),但在第12天时活性肽组即超过阿胶组HGB水平达11.5%,且与阿胶组相比具有显著性差异(P<0.05),说明活性肽在第6至12天期间升高HGB水平的作用与阿胶相比明显加快。在第12天时,活性肽组HGB水平已与正常组无显著性差异(P>0.05),而血虚组和阿胶组仍与正常组有极显著差异(P<0.01);第18天时活性肽组已超过其他各组HGB水平。提示活性肽能够促进血虚小鼠血红蛋白水平的提高,具有一定程度的补血作用。
表2 泰和乌骨鸡活性肽对血虚小鼠HGB的影响(x±s,n=12)Table 2 Effect of bioactive peptides from TBSF on HGB of blood deficiency mice (±s,n=12)
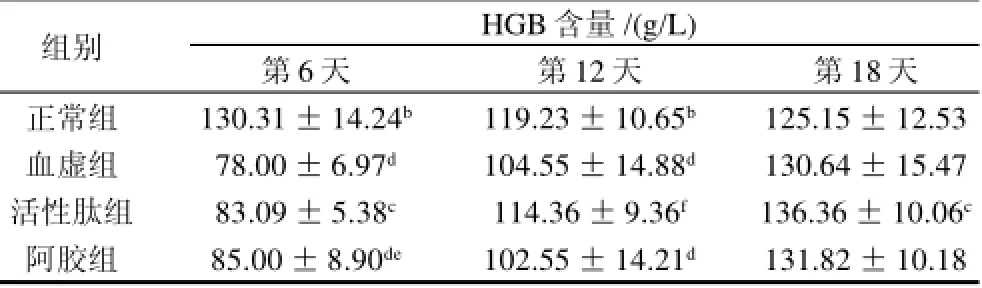
表2 泰和乌骨鸡活性肽对血虚小鼠HGB的影响(x±s,n=12)Table 2 Effect of bioactive peptides from TBSF on HGB of blood deficiency mice (±s,n=12)
组别HGB含量 /(g/L)第6天第12天第18天正常组130.31±14.24b119.23±10.65b125.15±12.53血虚组78.00±6.97d104.55±14.88d130.64±15.47活性肽组83.09±5.38c114.36±9.36f136.36±10.06c阿胶组85.00±8.90de102.55±14.21d131.82±10.18
2.2 泰和乌骨鸡活性肽组分A对小鼠RBC、HGB值的影响
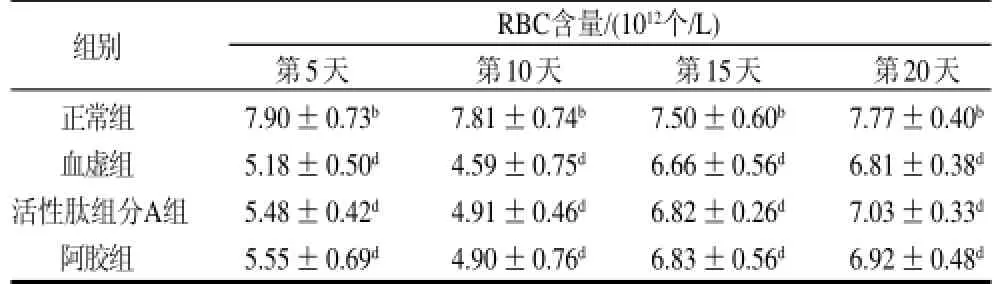
表3 泰和乌骨鸡活性肽组分A对血虚小鼠RBC的影响(x±s,n=12)Table 3 Effect of bioactive peptide fraction A from TBSF on RBC of blood deficiency mice (x±s,n=12)
由表3可见,造模后活性肽组分A组和阿胶组的红细胞恢复水平在各个时间点均高于血虚组。在连续给予小鼠活性肽A组分5d后,活性肽组分A组RBC水平就已开始大于血虚组小鼠。与血虚组相比,活性肽组分A组RBC值分别比血虚组高5.8%、7.0%、2.4%、3.2%,但均无显著性差异(P>0.05)。与阿胶组相比,两组之间亦无显著性差异(P>0.05)。提示活性肽组分A有可以促进血虚小鼠红细胞增殖的趋势,具有一定程度的补血作用。
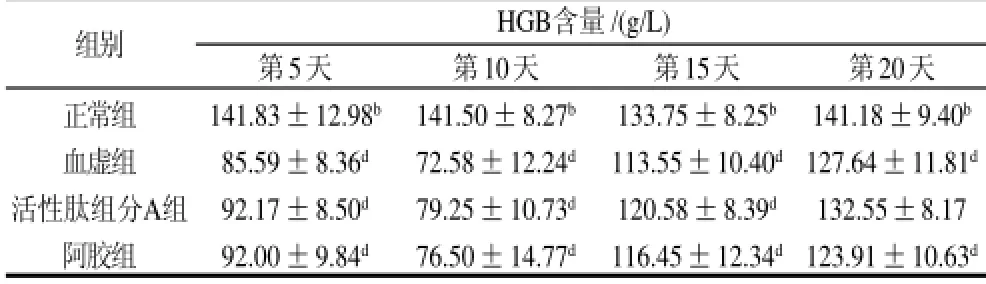
表4 泰和乌骨鸡活性肽组分A对血虚小鼠HGB的影响(x±s,n=12)Table 4 Effect of bioactive peptide fraction A from TBSF on HGB of blood deficiency mice (x±s,n=12)
由表4可见,与血虚组相比,活性肽组分A组在第5、10、15、20天的HGB值分别高出了7.7%、9.2%、6.2%、3.8%,但无显著性差异(P>0.05);阿胶组与血虚组相比,HGB水平在前三个时间点均略高于血虚组,但同样无显著性差异(P>0.05),而且在第20天时反而略低于血虚组2.7%。与阿胶组相比,活性肽组分A升高HGB水平的作用更快,且在各个时间段分别比阿胶组的HGB水平高出0.2%、3.6%、3.5%、7.0%。与正常组相比,血虚组和阿胶组在各个时间点都与正常组有极显著差异(P<0.01),而活性肽组分A组在第20天时已与正常组无显著性差异(P>0.05),而血虚组和阿胶组仍与正常组有极显著差异(P<0.01),说明第20天时活性肽组分A组已先于其他组恢复到正常水平。提示活性肽组分A具有促进血虚小鼠血红蛋白水平的提高,具有一定程度的补血作用。
3 讨 论
乌骨鸡是我国民间常用的滋补佳品,具有益气血、补肝肾等功效。田颖刚等[9]发现乌骨鸡正己烷提取物能够升高血虚小鼠红细胞、白细胞、血红蛋白等水平,具有补血作用,但是关于乌骨鸡肌肉蛋白酶促水解物即乌骨鸡活性肽的补血功能的研究目前尚未见报道。
本研究利用失血法和氟尿嘧啶(癌症化疗药物,具有骨髓抑制作用)注射法联合建立了小鼠血虚模型,测定了小鼠红细胞和血红蛋白水平,以观察乌骨鸡活性肽及其一种分离活性肽对血虚小鼠的补血作用。结果显示,在小鼠血虚模型中,乌骨鸡活性肽及其分离所得的活性肽组分A均能够在一定程度上提高血虚小鼠的红
细胞数和血红蛋白含量。有研究表明,阿胶具有抵抗化疗造成的骨髓抑制的功能[16-18],但到目前为止,未见阿胶对氟尿嘧啶和眼眶放血联合致血虚小鼠具有补血作用的报道。本研究以阿胶为阳性对照,结果表明,阿胶在此模型中未发挥显著的补血作用(P>0.05)。在本实验的结果中,乌骨鸡活性肽能够在一定程度上升高RBC和HGB水平,说明其具有抵抗放血和氟尿嘧啶联合造成的小鼠血虚的作用。
乌骨鸡活性肽和活性肽A二者的补血作用效果相比,在升高RBC水平方面,活性肽A在第5天时提升RBC的百分率比活性肽高,且比活性肽提升速度快,在以后几天二者差别不大,但活性肽比活性肽A总体作用稍好,这可能与活性肽A的剂量较低有关;在提升HGB水平方面,活性肽A提升血虚组HGB的百分率高于活性肽组,且提升速度快于活性肽。以上说明活性肽A能较早地开始恢复RBC水平,而恢复速度比活性肽稍慢,但是活性肽A在提升HGB水平方面作用优于活性肽,提示活性肽A能在红细胞数量增加不多的情况下,增加红细胞内血红蛋白的含量。另外,本实验中乌骨鸡活性肽(5g/kg bw)灌胃量大于活性肽A(500mg/kg bw)。由此可以预测,当加大活性肽A灌胃量时,其补血效果可能会更好。
综上所述,泰和乌骨鸡活性肽及其一种分离活性肽A能够在一定程度上提高血虚小鼠的红细胞数和血红蛋白含量,具有一定的补血作用,为进一步研究开发乌骨鸡补血物质以及阐述其补血机理提供实验依据。另外,乌骨鸡是江西省特有药用资源,对乌骨鸡活性肽进行深入的研究,对阐明乌骨鸡在疗效中所起的作用和开发乌骨鸡系列功能产品均具有重要的意义。
[1]CHENG Fuyuan, HSU Fengwen, CHANG Hisshan, et al. Effect of different acids on the extraction of pepsin-solubilised collagen containing melanin from silky fowl feet[J]. Food Chemistry, 2009, 113(2): 563-567.
[2]吴红静, 周晓琴. 乌骨鸡种质概况及营养成分研究进展[J]. 雅安职业技术学院学报, 2008(2): 21-23.
[3]黄族豪, 肖宜安, 龙进. 泰和乌鸡遗传多样性研究进展[J]. 安徽农业科学, 2008, 36(13): 5331-5332.
[4]CHEN Sirui, JIANG Bin, ZHENG Jiangxia, et al. Isolation and characterization of natural melanin derived from silky fowl (Gallus gallus domesticus Brisson)[J]. Food Chemistry, 2008, 111(3): 745-749.
[5]TIAN Yinggang, XIE Mingyong, WANG Weiya, et al. Determination of carnosine in Black-Bone Silky Fowl (Gallus gallus domesticus Brisson) and common chicken by HPLC[J]. European Food Research and Technology, 2007, 226(1): 311-314.
[6]田颖刚, 谢明勇, 王维亚, 等. 泰和乌骨鸡鸡肉总磷脂含量及其侧链脂肪酸组成的特性[J]. 食品科学, 2007, 28(4): 48-51.
[7]田颖刚, 谢明勇, 付志红, 等. 乌骨鸡脂肪油中脂肪酸组成的气相色谱-质谱分析[J]. 南昌大学学报: 理科版, 2006, 30(3): 264-267.
[8]田颖刚, 谢明勇, 吴红静, 等. 乌骨鸡与非药用鸡种鸡肉总脂质含量及脂肪酸组成的比较[J]. 食品与生物技术学报, 2007, 26(3): 29-32. [9]田颖刚, 谢明勇, 吴红静, 等. 乌骨鸡正己烷提取物补血作用研究[J].中药药理与临床, 2007, 23(1): 48-50.
[10]张秉成. 本草便读[M]. 上海: 上海科技卫生出版社, 1958: 32.
[11]贺淹才. 我国的乌骨鸡与中国泰和鸡及其药用价值[J]. 中国农业科技导报, 2003, 5(1): 64-66.
[12]林霖, 田颖刚, 谢明勇, 等. 乌骨鸡活性肽组成成分及体外抗氧化活性研究[J]. 食品科学, 2007, 28(10): 41-45.
[13]金若敏, 宁炼, 陈长勋, 等. 血虚模型动物制备及当归补血汤的作用研究[J]. 中成药, 2001, 23(4): 268-271.
[14]吴宏忠, 杨帆, 崔书亚, 等. 阿胶酶解成分对贫血小鼠造血系统的保护机制[J]. 华东理工大学学报:自然科学版, 2008, 34(1): 47-52.
[15]GILMORE G L, DEPASQUALE D K, SHADDUCK R K. Protective effects of BB-10010 treatment on chemotherapy-induced neutropenia in mice[J]. Experimental Hematology, 1999, 27(2): 195-202.
[16]魏东, 谭勇, 刘涣义, 等. 中药阿胶治疗晚期胰腺癌化疗后骨髓抑制21例[J]. 中国中西医结合杂志, 2006, 26(7): 659-660.
[17]WU Hongzhong, YANG Fan, CUI Shuya, et al. Hematopoietic effect of fractions from the enzyme-digested colla corii asini on mice with 5-fluorouracil induced anemia[J]. The American Journal of Chinese Medicine, 2007, 35(5): 853-866.
[18]苗明三, 周立华, 侯江红, 等. 四种中成药对气血双虚模型小鼠血象及免疫水平的影响[J]. 中国组织工程研究与临床康复, 2007, 11(11): 2025-2028.
Hematopoiesis Activity of Bioactive Peptides from Taihe Black-bone Silky Fowls
WANG Yong,LIU Jian-hua,TIAN Ying-gang,ZHU Sheng,XIE Ming-yong*
(State Key Laboratory of Food Science and Technology, Nanchang University, Nanchang 330047, China)
Objective: To investigate the hematopoiesis activity of bioactive peptides from Taihe Black-bone Silky Fowls (TBSF). Methods: Blood loss combined with myelosuppression drug (Fluorouracil, 5-FU) was used to establish a blood deficiency mouse model. Red blood cells (RBC) and hemoglobin (HGB) levels were measured to evaluate the hematopoiesis effects of bioactive peptides from TBSF and isolated bioactive peptide fraction A. Results: Compared with the blood deficiency group, the RBC level of bioactive peptides group has a significant difference on the 12th day administration (P< 0.05); During the period of 6 to 12 days, RBC and HGB levels of bioactive peptides group exhibited a significant faster than the Ejiao group (P<0.05). On the 18th day, HGB level of bioactive peptides group was higher than other groups, and also significantly higher than the normal control group (P < 0.05). The RBC level in bioactive peptide fraction A group was higher than the blood deficiency group at each time point although no significant difference was observed (P> 0.05), while the blood deficiency group and the Ejiao group exhibited a significant difference (P< 0.01), compared with the normal control group. On the 20th day, there was no significant difference in HGB level (P> 0.05) between the bioactive peptide fraction A group and the normal control group, while the blood deficiency group and the Ejiao group revealed a significant difference from the normal control group (P< 0.01). Conclusion: Bioactive peptides from TBSF exhibit hematopoiesis activity by elevating RBC and HGB levels to some extent.
Taihe black-bone silky fowl;bioactive peptide;blood deficiency model;hematopoiesis
R285.5
A
1002-6630(2010)21-0340-04
2010-06-28
国家自然科学基金项目(20862012)
王勇(1986—),男,硕士研究生,研究方向为营养保健与功能食品。E-mail:wangyong1518@126.com
*通信作者:谢明勇(1957—),男,教授,博士,研究方向为天然产物。E-mail:myxie@ncu.edu.cn
——记深州市深州泰和医院

