华蟾素注射液联合化疗对小鼠原位移植H22肝癌的影响
崔智
肝癌是一种病死率极高的恶性肿瘤,目前采用手术切除加化疗介入治疗,放疗等多只是延缓症状,完全治愈非常困难[1-3]。自古中医就对肝癌的病机、症状皆有详尽的论述,现代中药药理学研究显示,很多中药复方具有抗肿瘤作用,或扶助正气,有助于机体抗御病邪;或通过调整机体免疫力、阻断细胞突变、诱导肿瘤细胞凋亡、抗炎排毒治疗恶性肿瘤;或直接对肿瘤细胞具有抑制作用;或直接特异性杀伤肿瘤细胞[4]。华蟾素注射液是以蟾皮为主要原料研制的一种水溶性制剂,具有良好的抗肿瘤作用,广泛用于恶性肿瘤临床治疗,如胃癌、食管癌、膀胱癌、白血病等[5,6]。本研究观察华蟾素注射液联合化疗对BALB/C小鼠原位移植H22肝癌肿瘤的抑制作用。
1 材料与方法
1.1 材料
1.1.1 动物:BALB/C小鼠40只,均为雄性,体重20~25 g,7~8周龄。南方医科大学实验动物中心提供,动物许可证号:SCXK(粤)2006-0015。小鼠移植性肝癌瘤株,由华西医科大学肿瘤研究所提供。
1.1.2 试药:华蟾素注射液:安徽金蟾生化股份有限公司,5 ml/支;5-氟尿嘧啶(5-Fu):天津氨基酸公司人民制药厂,针剂,250 mg/支。灭菌0.9%氯化钠溶液稀释至2.5 mg/m l后分装于EP管并用锡纸避光常温保存。
1.1.3 仪器:流式细胞仪(EPICS型):美国 Beckmancoulter公司;自动平衡离心机(DT5-6A):北京时代北利离心机有限公司;酶标仪(生物梅里埃中国有限公司);电热恒温培养箱,Eppendof管,小鼠肿瘤坏死因子α酶联免疫分析试剂盒(上海希美生物科技有限公司);LKB-V型切片机。
1.2 方法
1.2.1 分组:将BALB/C小鼠,随机分为4组,每组10只,即模型组,单纯化疗组(5-Fu),华蟾素注射液组,化疗(5-Fu)+华蟾素注射液组。
1.2.2 造模及给药方法[7]:小鼠移植性肝癌瘤株,接种于BALB/C鼠腹腔内传代,传代7 d后,无菌抽取乳白色H22肝癌腹水,0.9%氯化钠溶液洗涤2次,每次离心1 000 r/min,5 min。离心后弃去上清,0.2%台盼蓝染色镜检细胞活力 >98%,0.9%氯化钠溶液调整癌细胞数至2.5×107/ml,4℃备用。用盐酸氯胺酮(42 mg/kg)和速眠新Ⅱ(0.42 ml/kg)混合液肌内注射麻醉小鼠。将小鼠仰卧,固定于手术台上,常规消毒铺巾,于上腹正中线剑突下做一约0.8 cm的切口进入腹腔。暴露肝脏,轻压双侧肋弓以挤出左肝叶,湿纱布垫于肝叶下方进行保护,然后用1 ml注射器针头沿肝叶长轴方向与肝脏成30°斜插入肝实质约0.5 cm,缓慢注入H22肝癌腹水0.03ml(细胞数为7.5×105)。在缓慢拔出针头的同时,迅速在针眼处压一直径约0.5 cm大小的明胶海绵,并在其上用棉签轻压1 min止血,然后在针眼周围用乙醇棉球轻搽以杀死残留癌细胞。小心将肝脏轻柔回纳腹腔,逐层缝合切口,手术完毕。术中平稳进针,避免刺破肝脏,防止癌性腹水漏入腹腔。术后自由进水、进食。术后48 h小鼠仍存活,且无癌性腹水出现则视为造模成功。造模48 h后,按照以下方法给药:模型组:0.2 ml 0.9%氯化钠溶液,腹腔注射,1次/d,连续7 d;单纯化疗组(5-Fu):30 mg/kg,腹腔注射,隔日1次,连续5次;华蟾素注射液组:华蟾素注射液5 m l/kg,腹腔注射,1次/d,连续10 d;化疗(5-Fu)+华蟾素注射液组:5-Fu 30 mg/kg,腹腔注射,隔日1次,连续5次;华蟾素注射液5 ml/kg,腹腔注射,1次/d,连续10 d。
1.2.3 观察指标:①抑瘤率[8]及胸腺指数于给药结束后第3天将小鼠称重,摘除眼球法取血处死小鼠,完整剥离肿瘤组织和胸腺组织,剔除周围结缔组织和脂肪,用滤纸吸干脏器表面水分,电子天平称重,计算抑瘤率和胸腺指数。抑瘤率=(1-给药组肿瘤质量/模型组肿瘤质量)×100%;胸腺指数=[胸腺质量(mg)/小鼠质量(g)]×10。②血清肿瘤坏死因子-α(TNF-α)浓度酶联免疫分析法(ELISA)检测血清中TNF-α浓度:小鼠摘取眼球取血,于4℃保存过夜后,于1 000 r/min离心20 min,取上清液。将洗涤液用三蒸水按1∶20稀释;于临用前将标准品用样品稀释液稀释至1 ml,盖好静置10 min以上,然后反复颠倒/搓动以助溶解,其浓度2 000 pg/ml,做系列倍比稀释后,分别 稀 释 2 000 pg/ml,1 000 pg/ml,500 pg/ml,250 pg/ml,125 pg/ml,62.5 pg/ml,31.2 pg/ml,样品稀释液(0 pg/ml)直接作为空白孔。进行加样:分别设空白孔、标准孔(7孔)、待测样品孔。空白孔加样品稀释液100μl,余孔分别加标准品或待测样品100μl;轻轻晃动混匀,酶标板加上盖或覆膜,37℃反应120 min;弃去液体,甩干,不用洗涤。每孔加生物素标记抗体工作液100 μl,37℃,60 min。温育60 min后,弃去孔内液体,甩干,洗板3次,每次浸泡1~2 min,350 μl/孔,甩干;每孔加辣根过氧化物酶标记亲和素工作液 100μl,37℃,60 min;温育60 min后,弃去孔内液体,甩干,洗板5次,每次浸泡1~2 min,350μl/孔,甩干;依序每孔加底物溶液90μl,37℃避光显色;依序每孔加终止溶液50μl,终止反应;用酶联仪在450 nm波长依序测量各孔的光密度(OD值)。在加终止液后15 min以内进行检测。③细胞周期分析和细胞凋亡检测[9]取4组新鲜胸腺组织剪碎,用机械网搓法制备单细胞悬液,离心(800 r/min,5 min)洗涤3次后,调整细胞浓度为1×106个/m l,用4℃的70%乙醇固定30 min。用含Rnase及碘化丙啶染色30 min,用流式细胞仪进行DNA测量,检测速度为每秒钟1 000个细胞,测量数据输入hp-300consort 30计算机,使用Muhicycle软件分析细胞周期。以二倍体峰前出现亚二倍体峰表示凋亡百分率;以增殖指数(PI)=(S期细胞数+G2/M期细胞数)/(G1+S+G2/M细胞数)表示细胞增殖活性。
1.3 统计学分析应用SPSS 13.0统计软件,计量资料以¯x±s表示,不同组进行单因素方差分析,各组间采用SNK-q检验进行两两比较,P<0.05为差异有统计学意义。
2 结果
2.1 抑瘤率和胸腺指数 各治疗组小鼠平均肿瘤组织重量均较模型组显著降低(P<0.01),见表1;华蟾素注射液组和化疗+华蟾素注射液组较模型组胸腺平均重量和胸腺指数明显增高(P<0.01),单纯化疗组较模型组胸腺平均重量和胸腺指数明显减低(P <0.01)。见表2。
表1 4组小鼠肿瘤重量及抑瘤比较n=10,±s
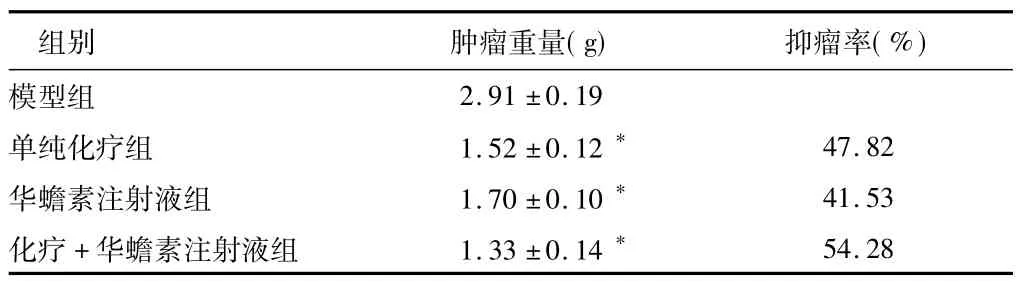
表1 4组小鼠肿瘤重量及抑瘤比较n=10,±s
注:与模型组比较,*P <0.01
组别 肿瘤重量(g) 抑瘤率(%)2.91 ±0.19单纯化疗组 1.52 ±0.12* 47.82华蟾素注射液组 1.70 ±0.10* 41.53化疗 +华蟾素注射液组 1.33 ±0.14*模型组54.28
表2 4组小鼠胸腺重量及胸腺指数比较n=10,±s

表2 4组小鼠胸腺重量及胸腺指数比较n=10,±s
注:与模型组比较,*P <0.01
胸腺指数模型组组别 胸腺重量(g)52±6 19±7单纯化疗组 24±10* 8±3*华蟾素注射液组 82±12* 36±13*化疗+华蟾素注射液组 72±10* 28±12*
2.2 血清TNF-α浓度 与模型组比较,各药物治疗组血清TNF-α浓度明显降低(P<0.05);各药物治疗组间差异无统计学意义(P >0.05)。见表3。
2.3 肿瘤细胞周期及细胞凋亡情况 与模型组比较,各药物治疗组肿瘤细胞凋亡率及PI均明显增高(P<0.05);化疗 +华蟾素注射液组较单纯化疗组细胞凋亡率及PI均明显增高(P<0.05);单纯化疗组和华蟾素注射液组间差异无统计学意义(P >0.05)。见表4。
表3 4组小鼠血清血清TNF-α浓度比较n=10,fmol/m l,±s

表3 4组小鼠血清血清TNF-α浓度比较n=10,fmol/m l,±s
注:与模型组比较,*P <0.05
浓度模型组组别 血清TNF-α 16.4 ±3.0单纯化疗组 12.0 ±2.6*华蟾素注射液组 12.2 ±3.5*化疗+华蟾素注射液组 12.2±2.7*
表4 4组小鼠肿瘤细胞凋亡率和PI情况比较n=10,±s
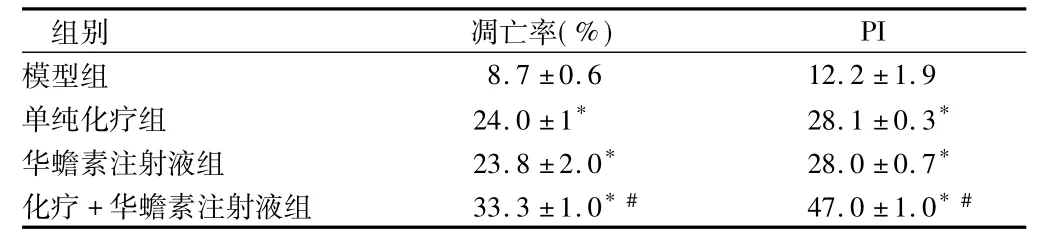
表4 4组小鼠肿瘤细胞凋亡率和PI情况比较n=10,±s
注:与模型组比较,*P <0.05;与单纯化疗组比较,#P <0.05
PI模型组组别 凋亡率(%)8.7 ±0.6 12.2 ±1.9单纯化疗组 24.0 ±1* 28.1 ±0.3*华蟾素注射液组 23.8 ±2.0* 28.0 ±0.7*化疗 +华蟾素注射液组 33.3 ±1.0*# 47.0 ±1.0*#
2.4 肿瘤细胞的周期比例 单纯化疗组对肿瘤细胞S期有阻滞作用;华蟾素注射液阻滞肿瘤细胞于S期;化疗+华蟾素注射液组同时作用于细胞周期的S期及G2/M期。见表5。
表5 4组小鼠肿瘤细胞的周期比例n=10,±s
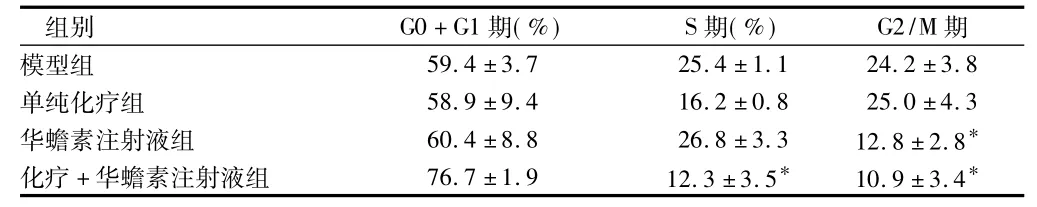
表5 4组小鼠肿瘤细胞的周期比例n=10,±s
注:与模型组比较,*P <0.05
组别 G0+G1期(%) S期(%) G2/M期59.4 ±3.7 25.4 ±1.1 24.2 ± 3.8单纯化疗组 58.9 ±9.4 16.2 ±0.8 25.0 ±4.3华蟾素注射液组 60.4 ±8.8 26.8 ±3.3 12.8 ±2.8*化疗 +华蟾素注射液组 76.7±1.9 12.3±3.5* 10.9±3.4模型组*
3 讨论
原发性肝癌(HG)是最常见的恶性肿瘤之一,全球2002年肝癌的发病人数626 000人,死亡人数598 000人[10]。目前在我国已属癌症死因的第2位,农村地区则为第1位。肝癌对化疗不敏感,尤其对于晚期肝癌患者,至今没有可靠的证据证明全身化疗可以提高晚期肝癌的总生存期(overall survival,OS)。
中医治疗肝癌历史悠久,从《内经》到《诸病源候论》、《外台秘要》等,认为肝癌是以脏腑气血亏虚为本,气、血、湿、热、瘀、毒互结为标,主病在肝,逐渐徵积而成。临床上肝癌病情复杂,本虚标实明显,临床施治时,既要注意其本虚,常用健脾益气,养血柔肝,滋补阴液等法以补虚,更要顾及邪实,以活血化瘀,消积理气,利水消肿等法以祛邪,达到攻补兼施,祛邪不伤正,扶正以达邪的功效。
经过各种治疗手段的摸索,很多研究表明联合治疗优于单一治疗,而且近年来多项研究发现很多中药成分具有很强的抗癌作用。蟾蜍(蟾酥)便是中医较早用于治疗癌症的药物。李时珍在《本草纲目》中指出其主治“疔疮恶肿,一切疮毒”等,唐人段成式也在其《酉阳杂俎》中提到“蟾蜍矢能已毒疮”。近代科学家从中分离出以含氨酸代替精氨酸的一系列蟾蜍毒素化合物,发现其药物作用包括对抑制Na+-K+-ATP酶,强心作用,局部麻醉作用,抗肿瘤作用。临床多用于治疗痈疽、肿瘤、疳积、瘰疬等症。机制认为与下列途径有关:(1)抑制肿瘤细胞的糖酵解和呼吸过程。(2)通过抑制Na+-K+-ATP酶的作用,使细胞内K+浓度下降,DNA合成被抑制,进而影响细胞的增殖。(3)提高细胞内CAMP浓度,促进非组蛋白型蛋白质的磷酸化,启动遗传信息的转录和促进细胞向正常分化。(4)提高机体免疫能力,促进巨噬细胞吞噬能力。(5)通过机体必须微量元素( 锌、硒、铜、锰、铬)而发挥抗癌作用[11,12]。
蟾蜍的多种制剂也被用于临床抗癌治疗中,如江苏省启东肝癌研究所应用复方蟾龙片(蟾蜍、守宫)治疗肝癌,在资料较完整的120例中,有效率大50%以上。其中生存期超过半年的有30例,超过1年以上的12例,超过2年以上的3例。启东肝癌研究所对存活1年以上的85例原发性肝癌进行了分析,有2例应用了大剂量蟾蜍的各类制剂。这2例临床症状消失,AFG检查转阴,肝脏缩小,存活3年以上,其中1例还能参加轻微劳动[10]。
本研究提示,华蟾素注射液组和单纯化疗组均可以明显抑制肿瘤生长,化疗+华蟾素注射液组使抑瘤作用增强。华蟾素注射液组可以使小鼠胸腺重量及胸腺指数增加,考虑与其提高机体免疫力相关。TNF-α具有抗病毒,抗肿瘤及免疫调节等生物学效应,在实体瘤患者体内TNF-α会异常升高,严重破坏细胞因子间正向的协调作用,使细胞因子网络功能紊乱,造成血管渗漏,脂肪降解等病理损伤。华蟾素注射液可以显著降低肝癌小鼠TNF-α水平,略高于单纯化疗组,考虑华蟾素注射液可以抑制肝癌小鼠TNF-α水平异常升高,并使其维持在一定水平来发挥其抗肿瘤,免疫调节等作用。
在细胞增殖周期中,在G期和S期之间以及G2期和M期之间,存在着影响细胞周期进行的控制点,药物可能通过调控这些控制点来影响细胞增殖。研究中通过对细胞周期各时相分布的观察发现,同模型组相比,单纯化疗组的肿瘤细胞G2/M期细胞比例增加,华蟾素组的肿瘤细胞S期细胞比例增高,化疗+华蟾素组的肿瘤细胞G2/M期、S期细胞比例均高于模型组,也就是抑瘤作用加强。因此,5-Fu联合华蟾素可以增加对小鼠原位移植H22肝癌的抑瘤作用,并能减轻用5-Fu进行化疗时产生的毒性反应。
1 陈俊华,冯国菊,轧春妹.护理干预对肝癌患者介入治疗生活质量的影响分析.河北医药,2009,31:749.
2 谷先之,殷蔚伯,刘泰福主编.肿瘤放射治疗学.北京:第1版.北京:北京医科大学中国协和医科大学联合出版社,1993.584-592.
3 Meng ZQ,Guo WJ,Yu EX,et al.Inhibition of telomerase activity and induced apoptosis of liver cancer cell SMMC-7721 by drug serum of Jianpi Liqiherbs.Shijie Huaren Xiaohua Zazhi,2000,8:879-882.
4 黄连玉,郭兆平.谈中药在治疗恶性肿瘤中的作用.中国中医药杂志,2005,3:763.
5 方山.华蟾素治疗晚期癌症40例近期疗效分析.安徽医学,1987,8:18.
6 宋庆祥.华蟾素治疗乳腺癌23例疗效观察.中西医结合杂志,1987,7:299.
7 姜晗昉,任军,崔勇,等.小鼠原位移植性肝癌模型的建立及其磁共振表现.现代肿瘤医学,2007,15:174-176.
8 Rubio SC.Synergistic activity of tumor necrosis factor and interferon in a nudemose model of human ovarian cancer.Gynecol Oncol,1989,34:353.
9 左连富主编.流式细胞术样品制备技术.第1版.北京:华夏出版社,1991.14-19.
10 王瑞敏,王美春,杜丽辉,等.原发性肝癌患者介入治疗中应用临床路径的效果评价.河北医药,2009,31:3161-3162.
11 陈雨凤,张少华.活血化瘀药抗肿瘤及肿瘤转移的作用机理探讨.陕西中医学院学报,2006,29:2.
12 于春艳,李薇,刘玉和,等.白花蛇舌草体外对人肝癌多药耐药细胞Bel-7402抗肿瘤活性的研究.北华大学学报(自然科学版),2004,5:221.

