外源性硫化氢在脂多糖致老年大鼠急性肺损伤中的作用*
曹 华,周晓红,黄新莉,赵润生,凌亦凌,张雪静
河北医科大学基础课教学部病理学教研室石家庄 050091
#通讯作者,女,1970年5月生,博士,副教授,研究方向:肺的病理生理研究,E-mail:zzxxhh2007@sina.com
老年人易患肺部感染,进而引发急性肺损伤(acute lung injury,ALI)。ALI的主要病变特点表现为急性弥漫性肺泡和肺血管损伤,最终可发展至急性呼吸窘迫综合征,病死率极高,具体发病机制不明。内源性气体信号分子如CO和NO在ALI中的作用已得到多方证实[1-3]。硫化氢(H2S)可能是继 NO和 CO之后发现的另一种气体信号分子[4],参与神经和血管的功能调节等多种生理和病理过程[5-7]。有学者[8]发现在离体器官水平H2S和NO共同参与了脂多糖(lipopolysaccharide,LPS)所致的大鼠肺动脉反应性异常,进而推测老年大鼠ALI时,H2S和NO、CO之间可能存在某种联系。因此,作者制备LPS致老年大鼠ALI模型,观察ALI时肺组织损伤指标、H2S及其生成关键酶胱硫醚-γ-裂解酶(cystathionine-γ-lyase,CSE)、诱导型NO合酶(inducible nitric oxide synthase,iNOS)/NO和血红素加氧酶-1 (hemeoxygenase-1,HO-1)/CO体系的变化,探讨H2S在LPS致ALI中的作用及机制。
1 材料与方法
1.1 材料 大肠杆菌LPS(LPSE.coli O111:B4)、 NaHS、5'-磷酸吡哆醛、L-半胱氨酸、N,N-二甲基-对苯二胺硫酸盐、辅酶Ⅱ、6-磷酸葡萄糖和 6-磷酸葡萄糖脱氢酶、血红蛋白及血红素均购自Sigma公司;抗HO-1多克隆抗体和抗iNOS多克隆抗体购自武汉博士德公司;SP免疫组织化学检测试剂盒购自北京中杉金桥生物技术有限公司;NO与CO含量、iNOS与HO活性及丙二醛(malondialdehyde,MDA)含量检测试剂盒购自南京建成生物技术有限公司。
1.2 实验分组 清洁级健康雄性SD大鼠48只,20月龄,体质量 350~400 g,购自河北医科大学实验动物中心。自由摄食、饮水,室温 18~24℃,相对湿度40%~70%,每日 12 h光照维持,昼夜循环。大鼠适应性喂养 1周后,随机分为 3组,每组 16只。①对照组:气管内滴注生理盐水(200μL/只)。②LPS组:气管内滴注LPS(溶于生理盐水)200μg/只。③NaHS+LPS组:LPS滴注前10 min腹腔注射NaHS(溶于生理盐水)28μmol/kg。每组分别于LPS给药4及 8 h后,各取 8只进行取样观察。
1.3 标本制备 分别于滴注药物后 4、8 h从颈总动脉放血处死动物,取血浆检测NO、H2S和CO含量;称量全肺以测定肺系数;留取左侧肺叶下部,以体积分数 10%中性甲醛溶液固定,常规石蜡包埋、切片,用以观察肺组织形态学变化及检测HO-1、iNOS蛋白表达的变化;取左侧肺叶中上部制备肺组织匀浆,用于检测CSE、iNOS及HO活性和MDA含量。
1.4 测定指标
1.4.1 肺系数测定 自气管分叉以上 5、6软骨环间剪断气管,用滤纸吸干肺表面血污后称质量。肺系数=全肺湿质量(g)/体质量(kg)。
1.4.2 肺组织形态学观察 光镜下观察肺组织形态结构变化。每组选取 6张切片,每张切片连续观察10个视野(×100),肺泡内含有2个以上红细胞和(或)中性粒细胞为损伤肺泡。计算损伤肺泡数占计数肺泡总数的百分比,即肺泡损伤数比值(IQA),作为肺损伤的组织学定量评价指标。
1.4.3 肺组织中MDA含量及CSE、iNOS活性的测定 采用硫代巴比妥酸法测定MDA含量。采用分光光度法测定肺组织iNOS活性,严格按试剂盒说明进行操作。参照文献[6]方法测定CSE活性。
1.4.4 肺组织中HO活性检测 取肺组织,加4倍体积PBS(0.1 mol/L,pH 7.4)制成匀浆,4℃、15 000 g离心15min,取上清液-70℃保存。反应体系含肺组织匀浆上清液20μL、血红素20μmol/L、NADP 0.8 mmol/L、肝组织匀浆上清液20μL(作为胆绿素还原酶的来源)、6-磷酸葡萄糖4 mmol/L和6-磷酸葡萄糖脱氢酶1 U。37℃暗处反应1 h,于冰上终止反应。以不含辅酶Ⅱ的样品作空白对照。用分光光度计于464和530 nm处测定吸光度。胆红素消光系数为40 mmol/(L·cm)。计算1mg HO蛋白1 h催化血红素降解生成胆红素的量,以此表示 HO活性。肺组织匀浆上清液蛋白测定采用考马斯亮蓝法。
1.4.5 血浆中H2S、NO及CO含量测定 采用去蛋白的分光光度法[5]测定 H2S,根据H2S标准曲线计算上清液中 H2S的含量。采用硝酸还原酶法间接测定 NO,严格按试剂盒说明进行操作。参照Chalmers等[9]的双波长分光光度法测定CO,以血浆中HbCO的百分比含量(%)代表CO含量。
1.4.6 肺组织中iNOS和HO-1蛋白检测 采用SP法检测大鼠肺组织iNOS、HO-1蛋白表达。切片常规脱蜡、脱水,一抗滴度为1:100,DAB显色,苏木素复染,脱水、透明并封片。以 PBS代替一抗作为阴性对照。细胞质染成棕黄色的即为阳性细胞。每鼠取 5张切片,每张切片取 3~5个高倍视野,用全自动图像分析系统检测阳性细胞的光密度值,计算 5张切片的平均值,作为iNOS、HO-1蛋白的相对表达量。
1.5 统计学处理 应用SPSS 11.5进行统计分析。数据以¯x±s表示,3组间各指标的比较采用单因素方差分析,两两比较用SNK-q检验,检验水准α=0.05。
2 结果
2.1 3组大鼠肺组织形态学的改变 光镜下(图1),对照组肺组织结构正常。LPS组肺泡间隔增厚、断裂,中性粒细胞浸润,肺泡内可见浆液、红细胞,且大鼠的肺损伤随时间的延长而加重。NaHS+LPS组肺组织病变较LPS组减轻,大部分肺组织接近正常,局部肺组织有少量炎性细胞浸润,肺泡隔略有增宽。3组IQA的比较见表1。

图1 3组大鼠肺组织形态学的变化(HE,×100)A:对照组;B:LPS组;C:NaHS+LPS组。
2.2 3组大鼠肺系数及肺组织MDA含量的比较见表1。可看出,LPS组肺系数及肺组织MDA含量均高于对照组和NaHS+LPS组,NaHS+LPS组又高于对照组。
2.3 3组大鼠肺组织中CSE、iNOS及HO活性的比较 见表2。
2.4 3组大鼠血浆H2S、NO及CO含量的比较 见表3。
2.5 3组大鼠肺组织中iNOS及HO-1蛋白的表达见图2和表4。对照组肺组织中偶见iNOS和HO-1阳性细胞。LPS组肺组织中 2者的表达较对照组增强,iNOS主要表达于肺泡间质的单核-巨噬细胞、中性粒细胞、血管内皮细胞、血管平滑肌细胞及支气管上皮细胞,HO-1主要分布于气道上皮、肺泡壁、血管壁细胞和炎症细胞的胞质中。与LPS组比较,NaHS+ LPS组iNOS的表达减弱,HO-1的表达增加。

表1 3组大鼠肺组织IQA、肺系数及MDA含量测定结果(n=8)

表2 3组大鼠肺组织中CSE、iNOS及HO活性的比较(n=8)

表3 3组大鼠血浆H 2S、NO及CO含量的比较(n=8)
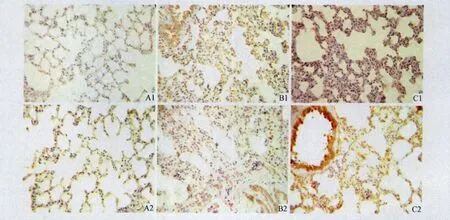
图2 3组大鼠肺组织中iNOS及HO-1蛋白的表达(SP,×400)A 1,A 2:对照组iNOS及HO-1的表达;B1,B2:LPS组iNOS及HO-1的表达;C1,C2:NaHS+LPS组iNOS及HO-1的表达。

表4 3组大鼠肺组织中iNOS及HO-1蛋白相对表达量的比较(n=8)
3 讨论
H2S具有多种生物学作用,如参与低氧性肺动脉高压和感染性休克[5-6]以及缓解自发性高血压血管重构等[7]。作者的实验结果显示,LPS引起老年大鼠肺组织损伤的同时,血浆 H2S含量和肺组织CSE活性下降;预先给予H2S供体NaHS可使H2S含量和 CSE活性升高,肺损伤也明显减轻。提示CSE/H2S体系的下调在LPS致ALI中有一定作用,而给予一定量的外源性 H2S对肺组织有保护作用。作者检测了老年大鼠肺组织中 MDA含量,证明外源性H2S可一定程度上减少ALI时肺内MDA的生成,提示H2S具有一定的抗氧化作用,H2S具有清除活性氧的作用[10]。
NO是最早发现的气体信号分子,可参与多种肺疾病的发生[11]。NOS是合成NO的关键酶,iNOS诱导产生的过量NO具有细胞毒性作用[12]。CO具有抗炎、抗氧化等作用。机体内源性CO主要由HO催化血红素降解产生,诱导型HO(即HO-1)可作为保护性蛋白被细菌内毒素、炎性细胞因子及NO等多种因素诱导表达[13]。作者发现,LPS致老年大鼠ALI的同时,使肺组织中H2S减少,上调iNOS/NO体系和HO-1/CO体系,前者是LPS致损伤的机制之一,后者则可能是机体对抗损伤的一种保护性反应。给予NaHS可下调iNOS/NO、上调HO-1/CO。由此推测,ALI时 3种气体信号分子间可能存在相互调节,具体机制尚待进一步研究。
总之,实验结果表明,CSE/H2S体系的下调参与了LPS所致老年大鼠ALI的发病,而外源性H2S可通过本身的抗氧化作用以及下调iNOS/NO体系、上调HO-1/CO体系发挥一定的抗损伤作用。
[1]厉晓,蔡英年,宿双宁.脂多糖诱导地鼠肺泡巨噬细胞中一氧化氮对TNF-α的调节作用[J].基础医学与临床,2000,20(2):41
[2]任光明,赵鸣武,方秋红,等.香烟烟雾提取物对大鼠肺组织的损伤作用及对一氧化氮生成的影响[J].基础医学与临床,2000,20(2):44
[3]黄新莉,周晓红,凌亦凌,等.内源性CO在CCK-8减轻脂多糖所致的急性肺损伤中的作用[J].中国病理生理杂志,2005,21(11):2 205
[4]Wang R.Two's company,three's a crowd:can the H2Sbe the endogenous gaseous transm itter[J].FASEB J,2002, 16(13):1 792
[5]Chunyu Z,Junbao D,Dingfang B,et al.The regu latory effectof hydrogen sulfide on hypoxic pulmonary hypertension in rats[J].Biochem Biophys Res Commun,2003, 302(4):810
[6]陈晓波,杜军保,耿彬,等.感染性和内毒素性休克大鼠动脉组织中硫化氢的变化[J].基础医学与临床,2003, 23(4):384
[7]闫辉,杜军保,唐朝枢.硫化氢对自发性高血压大鼠主动脉平滑肌细胞增殖的抑制作用[J].实用儿科临床杂志,2004,19(3):188
[8]戴鸿雁,凌亦凌,黄新莉,等.硫化氢在内毒素血症大鼠动脉舒张反应性改变中的作用及其与一氧化氮的关系[J].河北医科大学学报,2004,25(6):355
[9]Chalmers AH.Simple,sensitive measurement of carbon monoxide in plasma[J].Clin Chem,1991,37(8):1 442
[10]Whiteman M,Armstrong JS,Chu SH,et al.The novel neuromodulator hydrogen sulfide:an endogenous peroxynitrite'scavenger'[J].Neurochem,2004,90(3):765
[11]Gaston B,Drazen JM,Loscalzo J,et al.The biology of nitrogen oxides in the airways[J].Am JRespil Crit Care Med,1994,149(2 Pt 1):538
[12]Altavilla D,Squad rito F,Campo GM,etal.The lazaroid, U-74389G,inhibts inducible nitric oxide synthaseactivity, reverse vascular failure and protests against endotoxin shock[J].Eur JPharmacol,1999,369(1):49
[13]Morse D,Choi AM.Heme oxygenase-1:the“emergingmolecule”has arrived[J].Am JRespir Cell Mol Biol,2002, 27(1):8

