氯沙坦对兔腹主动脉内皮损伤后过氧化物酶体增殖物激活受体-γ与纤溶酶原激活物抑制因子-1表达的影响
刘 慧,高传玉,李海剑,李玉东,杨守忠,毛绍芬,陶雅非
1)河南省人民医院心内科郑州 450003 2)南阳市中心医院心内科南阳 473009 3)南阳市中心医院肾内科南阳 473009 #通讯作者,男,1962年生,博士,主任医师,研究方向:冠心病的诊断与治疗,E-mail:gaocy2000@yahoo.com.cn
过氧化物酶体增殖物激活受体-γ(peroxisome proliferators-activated receptor-γ,PPARγ)是甾体激素受体超家族的新成员,能被脂肪酸以及外源性过氧化物增殖物激活,在转录水平上调节脂质代谢、脂肪细胞分化和细胞因子的产生。研究[1-3]表明,PPARγ具有整体的抗炎症和抗动脉粥样硬化(atherosclerosis,AS)功能。作为临床上广泛应用的血管紧张素Ⅱ的Ⅰ型受体(AT1R)拮抗剂氯沙坦,其抗AS作用是否与PPARγ有关,目前未见报道。作者建立了兔腹主动脉 AS模型,观察氯沙坦对血管成形术后PPARγ和纤溶酶原激活物抑制因子-1(p lasm inogen activator inhibitor-1,PAI-1)表达的影响,以进一步探讨氯沙坦对AS和斑块稳定作用的可能机制。
1 材料与方法
1.1 动物及分组 新西兰大白兔24只,雄性,体质量(2.5±0.3)kg,河南省实验动物中心提供。随机分为普通饲料喂养组(G1组)、高脂饮食喂饲+动脉内皮损伤组(G2组)及高脂饮食喂饲+动脉内皮损伤+氯沙坦治疗组(G3组),每组8只。
1.2 试剂及仪器 PPARγ、PAI-1一抗购自武汉博士德生物工程有限公司。球囊由Cordis公司提供。日本HMIS-2000高清晰度彩色医学图文分析系统。1.3 动物模型的建立 G1组家兔喂以普通饲料。G2、G3组家兔以含质量分数1.5%胆固醇的饲料饲养2周后行腹主动脉内膜剥脱术。参考 Block等[4]的方法并加以改进,制作腹主动脉球囊损伤模型。术后G2、G3组继续以高脂饮食喂养 6周,G3组每天加用氯沙坦(商品名科素亚,美国默沙东公司提供)10 mg/kg。
1.4 组织标本留取 术后6周处死各组家兔,取出腹主动脉,截取成形部位血管标本,4 g/L多聚甲醛固定 4 h。逐级脱水,石蜡包埋,4μm厚连续切片,采用电脑图像分析仪分别测定新生内膜厚度(intimal thickness,IT)、中膜厚度(media thickness,MT)、内膜面积(intimal area,IA)及中膜面积(media area, MA),计算新生内膜厚度与中膜厚度比(IT/MT)及内膜面积与中膜面积比(IA/MA)。
1.5 腹主动脉PPARγ和PAI-1蛋白检测 PPARγ
及PAI-1免疫组织化学染色采用常规亲和素-生物素-过氧化物酶技术,具体步骤参照试剂盒说明书。PPARγ、PAI-1阳性着色均表现为胞质染成浅黄色、棕黄色或棕褐色。每张切片高倍镜下取 10个视野,计算每个视野下阳性表达的血管平滑肌细胞占总血管平滑肌细胞的百分比,结果取平均值。
1.6 腹主动脉PPARγ和PAI-1mRNA检测 组织总RNA提取按Trizol说明书进行。RT-PCR采用两步法。10μg总RNA配制逆转录反应体系,25℃10min,42℃60 min,70℃10min,逆转录合成cDNA,以此为模板用PPARγ、PAI-1引物经PCR方法进行扩增,反应总体积为 25μL。引物由北京奥科公司合成。PPARγ引物序列:上游5'-CACAA GAACAAATGCCAGTA-3',下游5'-GGTCCTCAGTG GAAGAATCG-3';PAI-1引物序列:上游5'-TGG ACTTGACCACGGAGGAGC-3',下游5'-CTCGGTG CCCTTCAGTGAGCT-3';内参照β-actin引物序列:上游5'-GATGGTGGGTATGGGTCAGAAGGA-3',下游5'-GCTCATTGCCGATAGTGATGACCT-3'。PPARγ扩增条件为:95℃5 min;94℃30 s,63℃50 s,72℃30 s,共35个循环;最后72℃延伸6min,终产物为521 bp。PAI-1扩增条件为:95℃5m in;94℃30 s,59℃40 s,72℃40 s,共 35个循环;最后72℃延伸6 min,终产物为480 bp。β-actin终产物为332 bp。20 g/L琼脂糖凝胶电泳,应用图文分析系统,以目的基因片段/β-actin片段的条带灰度值比值来表示其相对表达量。
1.7 统计学处理 采用SPSS 10.0对3组腹主动脉IT、IT/MT比值、IA、IA/MA比值、PPARγ和PAI-1蛋白阳性表达率及mRNA相对表达量行单因素方差分析及SNK-q检验,检验水准α=0.05。
2 结果
2.1 3组腹主动脉IT、IT/M T、IA及IA/MA比值的比较 结果见表1。

表1 3组腹主动脉IT、IT/MT比值、IA及IA/M A的比较
2.2 3组腹主动脉PPARγ和PAI-1蛋白的表达 结果见图1、图2及表2。


表2 3组腹主动脉PPARγ及PAI-1蛋白阳性表达率和m RNA相对表达量的比较
2.3 3组腹主动脉PPARγ及PAI-1 mRNA的表达 结果见表2、图3和图4。

图3 3组腹主动脉PPARγm RNA的RT-PCR结果
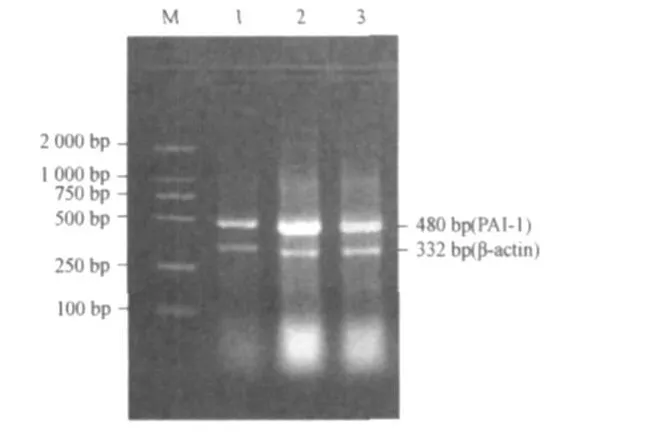
图4 3组腹主动脉PAI-1m RNA的RT-PCR结果
3 讨论
AS是多种病因造成的始发于动脉壁内膜的一系列分子和细胞改变的结果。PPAR属Ⅱ型核受体超家族成员,可在AS斑块处表达,在AS有关的脂质代谢和血管炎症中起关键作用[3]。该研究中,兔腹主动脉内皮损伤后,局部PPARγ表达增加,提示内皮损伤可以刺激 PPARγ过度表达。在相应配体的作用下, PPAR可以下调某些致病基因的表达。研究[5]表明, PPARγ激动剂能够通过抗炎、抗氧化、保护内皮细胞、抑制平滑肌细胞增殖和迁移、调节脂质代谢及稳定斑块等多种途径,从整体上发挥抗AS作用。
近年发现血管紧张素Ⅱ1型受体拮抗剂(ARB)除了降压以外,还具有抗纤维化、抗卒中、降尿酸、抗房颤(AF)、治疗舒张期心力衰竭及抗AS等[6]多种作用。其中仅有替米沙坦被证实是PPARγ的一种部分激动剂,通过激活PPARγ发挥抗AS作用[7]。而目前广泛应用的氯沙坦的抗 AS作用是否与PPARγ有关,尚未见报道。
PAI-1是体内最重要的纤溶活性调节剂,调节纤溶平衡[8]。PAI-1致AS的主要机制是阻止纤溶酶形成及细胞外基质的降解,调节平滑肌细胞增殖和迁移,有助于形成阻塞性斑块而导致临床事件发生。该研究中,球囊拉伤动脉导致PAI-1在血管内皮细胞和平滑肌细胞过度表达。PAI-1异常表达所致的细胞表面纤溶活性降低可引起或加重血栓形成。
总之,该研究建立了兔腹主动脉 AS模型,观察氯沙坦对血管成形术后PPARγ和PAI-1表达的影响。结果表明,兔腹主动脉内皮损伤,发生 AS后,局部 PAI-1表达异常升高,与国外相关研究[9]一致,给予氯沙坦干预后明显下降,同时 PPARγ表达增加。有研究[10]表明,PPARγ激活后可以抑制PAI-1表达。该研究结果表明,氯沙坦抑制PAI-1表达,抗AI,可能与激活PPARγ有关,但其具体机制及信号途径有待进一步研究。
[1]Duan SZ,UsherMG,Mortensen RM.Peroxisome proliferator-activated receptor-gamma-mediated effects in the vasculature[J].Circ Res,2008,102(3):283
[2]Jiang Q,Heneka M,Land reth GE.The role of peroxisome proliferator-activated recep tor-gamma(PPARgamma)in Alzheimer's disease:therapeutic imp lications[J].CNS Drugs,2008,22(1):1
[3]Kuusisto J,Andrulionyte L,Laakso M.Atherosclerosis and cardiovascular risk reduction with PPAR agonists[J]. Curr Atheroscler Rep,2007,9(4):274
[4]Block PC,Baughman KL,Pasternak RC,et al.Transluminal angioplasty:correlation ofmorphologic and angiographic findings in an experimentalmodel[J].Circulation,1980,61(4):778
[5]Staels B.PPAR agonists and themetabolic syndrome[J]. Therapie,2007,62(4):319
[6]Yu Y,Fukuda N,Yao EH,etal.Effects ofan ARB on endothelial progenitor cell function and cardiovascu lar oxidation in hypertension[J].Am JHypertens,2008,21(1):72
[7]Imayama I,Ichiki T,Inanaga K,et al.Telmisartan downregulates angiotensinⅡtype 1 receptor through activation of peroxisome proliferator-activated receptor gamma[J]. Cardiovasc Res,2006,72(1):184
[8]Aleksic N,Wang YW,Ahn C,etal.Assessmentof coronary heartdisease risk by combined analysis of coagulation factors[J].Atherosclerosis,2008,198(2):294
[9]Brown NJ,Brad ford J,Wang Z,et al.Modu lation of angiotensinⅡand norepinephrine-induced plasminogen activator inhibitor-1 exp ression by AT1a receptor deficiency [J].Kidney Int,2007,72(1):72
[10]Boyle PJ.Diabetes mellitus and macrovascular disease: mechanisms and mediators[J].Am J Med,2007,120(9 Suppl 2):S12

