广东汉族人群 TLR2基因的多态性研究*
伍模鑫, 肖文娟, 刘泽寰
(暨南大学生命与健康工程研究院分子生物研究中心,广东广州 510632)
Toll样受体 (Toll-like receptors,TLRs)是近年来发现的一类能够识别许多不同病原体和内源分子的天然免疫受体家族,主要表达于单核细胞、巨噬细胞、树突细胞等细胞膜上,在天然免疫应答中起着非常关键的作用。作为模式识别分子,它首先在果蝇中被发现,对胚胎侧线发育起重要作用[1]。TLRs属于Ⅰ型跨膜蛋白受体,主要以单独或是与其它成员形成异源二聚体的形式来激活信号转导,促进各种炎症因子的释放,从而在早期启动固有免疫应答,在宿主的天然免疫防御中发挥重要作用[2,3]。人类Toll样受体 2(Toll-like receptor 2,TLR2)的编码基因位于第 4号染色体 (4q32),在天然免疫应答中起着非常重要的作用。TLR2主要以和 TLR1或者TLR6结合成异源二聚体的形式来识别它们的配体, TLR1/TLR2异二聚体能够识别多种细菌的脂肽,而TLR6/TLR2异二聚体能够识别支原体脂蛋白和肽聚糖。研究证实,TLR2基因的多态性能够影响宿主的固有免疫应答和天然免疫防御[4],但目前还没有关于中国汉族正常人群 TLR2基因座位的多态性研究报导,鉴于 TLR2基因在天然免疫中的重要作用,本研究首次以较大样本的广东汉族人群为研究对象,获得 TLR2基因功能性多态性图谱及其分布频率,为揭示汉族人 TLR2基因多态性特征以及进一步的疾病相关性和遗传进化研究提供重要的基础数据。
材 料 和 方 法
1 样本收集和基因组DNA提取
共采集广东地区 200例汉族无亲缘关系个体的健康外周血样本,采血对象年龄在 19-48岁间,男女性别比例为 1∶1.2。用 e.Z.N.A.TM血液 DNA抽提试剂盒(Omega)提取基因组DNA。研究获得暨南大学附属第二医院医学伦理委员会批准,所有采血对象均签署知情同意书。
2 目的片段的扩增和测序
根据 GenBank公布的人类 TLR2基因信息 (Accession:NG_016299;Region:154823891..154847642; Version:NC_016299.1;GI:281332105),用 Oligo 6.0软件 (MolecularBiology Insight Inc.)设计引物,对随机抽取的 24例广东汉族人 TLR2基因的启动子区、外显子区和部分内含子区进行 PCR扩增,扩增引物见表 1。PCR扩增程序:最初 94℃5 min,35个循环:94℃30 s,退火 30 s(各片段退火温度见表 1), 72℃90 s;最后 72℃10 min。PCR产物用 3S Spin PCR产物纯化试剂盒 (上海申能博彩公司)纯化后,用 AB I PR IS M 377自动测序仪测序 (英伟创津公司),测序引物与扩增引物相同,每个扩增片段均进行正反向 2次测序。对照参考序列,用 Clustal-X 1.81软件比对测序结果获得 TLR2基因多态性位点信息。
3 多态性位点基因分型
针对上述 24例测序样本中发现的单核苷酸多态性 (single nucleotides polymorphis ms,SNPs)位点,采用 PCR-sequence specific primer(PCR-SSP)方法在剩余的 176例样本中进行进一步的检验,PCR引物和退火温度见表 1。针对上述 24例测序样本中发现的插入 /缺失 (insertion/deletion, INDEL)多态位点(-196到 -174),则采用常规 PCR方法对剩余 176例样本进行检验,PCR引物为正义链:5'-cacggaggcagcgagaaa-3',反义链:5'-ctgggccgtgcaaagaag-3'。PCR程序为:首先 95℃5 min;其次35个循环:95℃30 s、60℃40 s、72℃40 s;最后 72℃7 min。PCR产物用3.5%琼脂糖凝胶电泳分析,出现 284 bp单条带的是野生型,出现 264 bp单条带的是缺失纯合型,出现 286 bp和 264 bp 2条带的是插入/缺失杂合型。
4 统计学处理
对照参考序列,用 ClustalX 1.81软件[5]比对测序结果获得多态性位点信息;用 SPSS 13.0软件进行卡方检验;用DnaSP 5.10软件[6]计算 Tajima's D、Fu &Li'sD值和频谱分析;用软件 Haploview 4.1[7]进行连锁不平衡分析;用Mega 4.1软件[8]进行同义和非同义核苷酸替代分析(采用Li-Wu-Luo计算方法)。
结 果
通过对 24例广东汉族人 TLR2基因启动子区、外显子及其周围内含子区进行测序,共发现 5个SNPs位点,分别是:-18945C/T、-18883C/G、rs3804099(+597A/G)、rs3804100(+1350A/G)和rs5743705(+2121A/G)。对比美国国立生物信息中心 (National Center for Biotechnology Information,NCB I)dbSNP数据库已有数据发现,位于启动子区的 2个 SNPs-18945C/T和 -18883C/G是首次发现,见图 1;位于编码区的 3个 SNPs rs3804099、rs3804100、rs5743705均属于同义突变,不引起氨基酸的改变。在 24例广东汉族人样本中,没有发现在欧洲人群中分布频率较高的 2个非同义 SNPs位点 rs5743704 (+1893 A/T,His631Pro)和 rs5743708(+2259 A/ G,Gln753Arg)。此外,本研究还在第 1外显子区 (-196到 -174)发现 1个长度为 22 bp的 INDEL多态性位点,见图 1。6个多态性位点都符合 Hardy-Weinberg平衡 (P>0.05)。除 SNPs-18945C/T和-18883C/G外,其余 4个多态性位点的次要等位基因频率 (minor allele frequency,MAF)均大于 0.05,见表2。

表1 PCR扩增、测序及基因分型引物Table 1 .Primers used in this study

Figure 1.Two novel SNPs and one INDEL polymorphis m found inTLR2gene.A:promoter(-18945,CT genotype);B:promoter (-18883,CG genotype);C:promoter(DEL/DEL genotype);D:promoter( IN/ IN genotype).The arrows represent mutation sites.图 1 TLR2基因中新发现的 2个 SNPs和 1个 INDEL多态位点

表2 广东汉族人群 TLR2基因功能多态性位点的相关信息Table 2 .Characterization of functional genetic polymorphis ms in TLR2locus in Chinese Cantonese population
在剩余 176例样本中对 SNPs-18945C/T、-18883C/G、rs3804099、rs3804100、rs5743705以及 INDEL多态性进行基因分型,并与高加索人群、非洲裔美洲人群、日本人群、印度人群和中国台湾人群进行了比较,见表 3。比较发现,广东汉族人和高加索人在 SNPs rs3804100、rs3804099和 INDEL多态性频率分布上差异显著 (P<0.05);与非洲裔美洲人相比,在 SNPs rs3804099和 rs3804100频率分布上差异显著,而在 INDEL多态性频率分布上无明显差异;广东汉族人和印度人在 SNP rs3804100和 INDEL 2个位点的频率分布上则有显著差异 (P<0.05);SNPs-18945C/T、-18883C/G、rs5743705在其它人群中的频率至今尚未有报道。

表3 广东汉族人群 TLR2基因功能多态性位点的等位基因频率及与其他人群的比较Table 3 . Functional genetic polymorphisms and theirminor allele frequencies ofTLR2in different populations
本研究计算了 TLR2基因全部功能区片段和单独编码区片段的核苷酸多样性 (nucleotide diversity, π),分别为 0.27×10-3和 0.34×10-3,低于人类基因组的平均水平 (0.8×10-3和 0.5×10-3)[9,10]。TLR2基因调控区的 Tajima'D值和 Fu&Li's D值分别为 -1.46879和 -2.51415,编码区的 Tajima'D值和 Fu&Li'sD值分别为0.52381和0.89595,但都不显著(P>0.05),没有背离中性进化。进一步的频谱分析也发现,TLR2基因 SNP频谱分布规律符合中性进化,见图 2。此外,我们还根据Li-Wu-Luo的方法计算得到 TLR2编码区的非同义 (dN)和同义 (dS)核苷酸替代比值 (dN/dS)为 0∶0.0010。用 Haploview 4.1对 TLR2基因 6个多态性位点进行连锁不平衡分析发现,SNPs-18945C/T和 -18883C/G完全连锁(D'=1,r2=1),SNPs rs3804099和 rs3804100之间紧密连锁(D'=1,r2=0.89),见图 3。

Figure 2.The frequency spectrum analysis chart in the function region ofTLR2gene.The curve represents expected values.Histogram represents the actual observed values.图 2 TLR2基因功能区的频谱分析
讨 论
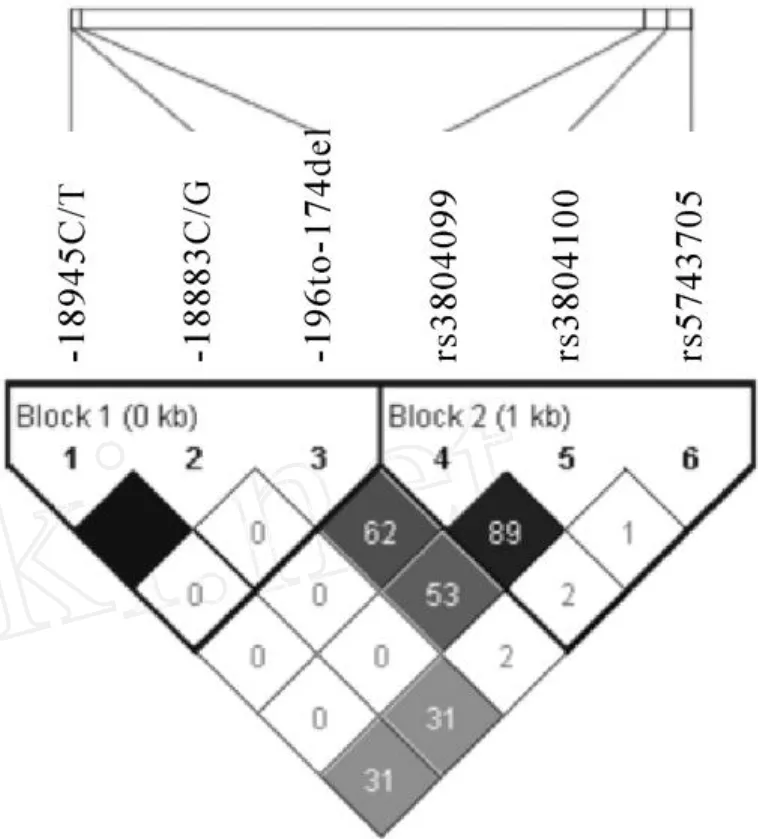
Figure 3.Linkage disequilibrium(LD)plots of the six functional polymorphis ms inTLR2. r2(×100)values were depicted in the diamonds.Stand Color Scheme:r2= 0,white;0<r2<1,shades of grey;r2=1,black.图 3 广东汉族人群 TLR2基因功能多态性位点的连锁不平衡分析
本研究新发现的 SNP-18945C/T靠近转录起始位点,-18883C/G则位于靠近转录因子 Ets-1的结合区的 CpG区域[11],二者均有可能引起 TLR2基因的转录水平发生变化。已有报道指出,启动子区域的CpG甲基化会影响上皮细胞TLR2基因的转录水平[12]。同样,本研究观察到的 TLR2基因第 1外显子区的 1个 22bp的 INDEL突变 (-196到 -174),也曾被人利用体外构建荧光素酶报告基因实验证实,其缺失纯和型 (DEL/DEL)与野生型 ( IN/ IN)相比具有更低的荧光素酶活性,说明该缺失会降低 TLR2基因的转录表达水平[13]。此外还有报道认为该突变会增加印度北部妇女患子宫颈癌的风险[14],也会增加日本人患溃疡性结肠炎胃癌和十二指肠癌的风险[15,16]。
人类先天免疫相关基因的多态性水平通常较低[17]。本研究中也发现,广东汉族人群 TLR2基因功能区的核苷酸多样性低于人类基因组平均水平。另外,dN/dS为 0∶0.001,也远远小于理论值 3∶1。这些结果均表明,广东汉族人群 TLR2基因在进化过程中可能受到一定的定向选择压力。然而,这与 Tajima、Fu and Li's检验以及频谱分析结果有一定的出入,这些检验则显示 TLR2基因多态性没有背离中性进化理论。因此,广东汉族人群 TLR2基因功能区多态性水平较低以及编码区 dN/dS比值偏低也有可能是遗传漂变(genetic drift)的结果。
人类基因多态性在不同种群、地区间的分布具有明显的差异。在本研究中,广东汉族人与高加索人、非洲裔美洲人在 TLR2基因多态性频率分布上差异明显。在欧洲人群中频率较高的 2个非同义 SNPs位点rs5743704(His631Pro)和 rs5743708(Gln753Arg)在广东汉族人群中则没有被发现,据报道它们与急性反应性关节炎的易感性相关[18]。亚洲人群中,广东汉族人与日本人在 TLR2基因多态性频率分布上无明显差异,但却与印度人差异明显。产生这种差异的原因可能与不同种群长期受到不同的自然选择压力以及与遗传漂变、迁徙(migration)等因素有关。
在本研究发现的 6个多态性位点中,根据连锁不平衡分析结果,-18945C/T和 -18883C/G之间以及 rs3804099和 rs3804100之间的 r2均≥0.8,并且后两者和 rs5743705均为同义突变,没有太大的研究价值,因此建议在今后的疾病相关性研究中,选择更靠近转录调控位点的 -18883C/G作为标签 SNP (tSNP),结合位于基因的 5'非翻译区的 INDEL作为研究靶点。
由于 TLR2基因在天然免疫中的重要作用,其基因多态性与疾病的易感关系已成为众多疾病致病机制研究的一大热点。但是,直接选择其他国家、民族人群中已发现的高风险位点在中华民族人群中进行研究,极有可能导致一些偏差,因此建立一个大样本的中华民族正常人群 TLR2基因多态性图谱是极有必要的,这一策略同样也适用于中华民族其它基因的多态性研究。本研究首次系统、全面地建立了广东汉族人群 TLR2基因座位功能区的多态性图谱,为在汉族人群中开展病例对照研究提供了一些有据可依的 tSNPs位点作为检测靶点,它将为今后的 TLR2蛋白功能、疾病易感性、致病机制乃至人群进化研究提供重要的资料。
[1] Hashimoto C,Hudson KL,Anderson KV.The Toll gene of Drosophila,required for dorsal-ventral embryonic polarity,appears to encode a trans-membrane protein[J]. Cell,1988,52(2):269-279.
[2] Alan A,Richard JU.Toll-like receptors in the induction of the innate immune response[J].Nature,2000,406 (6797):782-787.
[3] Kiyoshi T,Shizuo A.Toll-like receptors in innate immunity[J].Int Immunol,2005,17(1):1-14
[4] Schuster JM,Nelson PS.Toll receptors:an expanding role in our understanding of human disease[J].J Leukoc Biol,2000,67(6):767-773.
[5] Thompson JD,Gibson TJ,Plewniak F,et al.The ClustalX windows interface:flexible strategies for multiple sequence alignment aided by quality analysis tools[J].Nucleic Acids Res,1997,25(24):4876-4882.
[6] Librado P,RozasJ.DnaSP v5:A software for comprehensive analysisofDNA polymorphis m data[J].Bioinformatics,2009,25(11):1451-1452.
[7] Barrett JC,Fry B,Maller J,et al.Haploview:analysis and visualization ofLD and haplotype maps[J].Bioinformatics,2005,21(2):263-265.
[8] Tamura K,Dudley J,NeiM,et al.MEGA4:Molecular evolutionary genetics analysis(MEGA)software version 4.0[J].MolBiol Evol,2007,24(8):1596-1599.
[9] Reich DE,Schaffner SF,DalyMJ,et al.Human genome sequence variation and the influence of gene history,mutation and recombination[J].Nat Genet,2002,32(1): 135-142.
[10]CargillM,Altshuler D,Ireland J,et al.Characterization of single nucleotide polymorphis ms in coding regions of human genes[J].Nat Genet,1999,22(3):231-238.
[11]Haehnel V,Schwarzfischer L,Fenton MJ,et al.Transcriptional regulation of the human toll-like receptor 2 gene in monocytes and macrophages[J].J Immunol, 2002,168(11):5629-5637.
[12]Hirofumi K,Takashi F,Tsuyoshi S.DNA demethylation -dependent enhancement of toll-like receptor-2 gene expression in cystic fibrosis epithelial cells involves SP1-activated transcription[J].BMC Mol Biol,2008,9 (1):39-53.
[13]Noguchi E,Nish imura F,Fukai H,et al.An association study of asthma and total serum immunoglobin E levels for Toll-like receptor polymorphisms in a Japanese population[J].Clin Exp Allergy,2004,34(2):177-183.
[14]Pandey S,Mittal RD,SrivastavaM,et al. Impact of Toll -like receptors[TLR]2(-196 to-174 del)and TLR4 (Asp299Gly,Thr399 Ile)in cervical cancer susceptibility in North Indian women[J].Gynecol Oncol,2009,114 (3):501-505.
[15]Tahara T,Arisawa T,Wang F,et al.Toll-like receptor 2-196 to-174 delpolymorphis m influences the susceptibility of Japanese people to gastric cancer[J].Cancer Sci,2007,98(11):1790-1794.
[16]Tahara T,Arisawa T,Wang F,et al.Toll-like receptor 2(TLR)-196 to-174 del polymorphis m in gastro-duodenal diseases in Japanese population[J].DigDis Sci, 2008,53(4):919-924.
[17]FerrerA,Bosch E,SikoraM,et al.The evolution of parasite recognition genes in the innate immune system:purifying selection on drosophila melanogaster peptidoglycan recognition proteins[J].J Mol Evol,2003,57(5):598-605.
[18]Tsui FW,XiN,Rohekar S,et al.Toll-like receptor 2 variants are associated with acute reactive arthritis[J]. Arthritis Rheum,2008,58(11):3436-3438.
- 中国病理生理杂志的其它文章
- 人巨细胞病毒皮层蛋白 pUL23与宿主蛋白IGFBP4相互作用的鉴定*

