产氢细菌Ethanoligenens harbinense YUAN-3基因文库构建及分析
赵 鑫,邢德峰,王静怡,张 璐,任南琪
(哈尔滨工业大学城市水资源与水环境国家重点实验室,哈尔滨150090,dxing@hit.edu.cn)
生物制氢技术具有清洁能源生产和环境友好等特点引起广泛关注[1-2].近年来,国内外关于生物制氢的研究主要集中在反应器开发、运行工艺优化调控、产氢群落及其高效菌种和产氢代谢机制等方面.其中在产氢细菌分离和培养方面已有大量的研究成果报道[3-10].如任南琪[11]等人早在上个世纪90年代就已经率先开展活性污泥法生物制氢研究,完成了生物制氢示范工程,发现了一个不同于传统丁酸型发酵的全新产氢发酵类型——乙醇型发酵[12].2005年邢德峰等分离并获得了乙醇型发酵的主要产氢功能细菌,并确立新的种属——哈尔滨产乙醇杆菌(Ethanoligenens harbinense)[13-14].
菌株YUAN-3[14]是本实验室从生物制氢反应器中分离得到的一株高效产氢菌株.经过16S rRNA (GenBank注册号AY295777)比对与最相近的柔嫩梭菌(Clostridium leptum)相似性仅为92%,为一个全新的菌属,命名为产乙醇杆菌属,YUAN-3为模式菌株,它是已报导中唯一一株具有自凝集能力的产氢细菌,代谢末端产物为乙醇、乙酸、H2、CO2,已报道最大比产氢率可达1.9 mol/mol-glucose[15].
哈尔滨产乙醇杆菌产氢过程进行乙醇型代谢,在发酵末端产物、pH值和产氢能力等诸多方面都不同于传统的丁酸型发酵体系,因而其产氢过程中很多机理亟需探讨.在前期研究中,林海龙[16]等克隆得到了该菌属另一菌株B49的乙醇脱氢酶、乳酸脱氢酶等关键代谢酶,但是仍没能够更确切地诠释这一新的代谢类型.因此,构建哈尔滨产乙醇杆菌属模式菌株YUAN-3的基因组文库,寻找更多的关键酶和功能基因,可以更好地了解乙醇型产氢发酵代谢和生理生化特征.
1 试验
1.1 材料
菌株和质粒:Ethanoligenens harbinense YUAN -3由本实验室保存;大肠杆菌Escherichia coli DH5α和质粒pUC 19购自大连TaKaRa生物公司.
酶和主要试剂:Sau 3A I、BamH I限制性内切酶、T4连接酶、碱性磷酸酶 (CIAP)、DNA Marker、Taq酶等购自大连宝生物公司;Tris、Amp抗生素、IPTG、X-gal购自Sigma公司;氯仿、饱和酚等购自上海生工公司.DNA抽提试剂盒和胶回收试剂盒购自上海华舜生物公司.
培养基:产氢液体培养基为LM-1培养基[17];大肠杆菌使用LB培养基培养[18].
1.2 方法
1)基因组DNA的提取
在有10 mL LM-1培养基的厌氧管中,按照1∶100的比例接入菌株YUAN-3,37°C下140 r/min培养52 h,待菌体形成大的絮凝颗粒产生较多氢气时,用离心管收集菌体,12 000 r/min离心1 min去上清,用PBS重悬洗两次,取沉淀按照上海华舜公司的DNA抽提试剂盒说明抽提总DNA.
2)基因组酶切制备DNA片段
基因组DNA 40 μL,Sau3A I 1 μL,10×H Buffer 5 μL,用ddH2O补足50 μL体系,酶切30 min.用0.9%的琼脂糖电泳,切胶取1 000~7 500 bp的片段,按照胶回收试剂盒说明书进行胶回收,用0.9%的琼脂糖电泳检测回收效果.
3)载体pUC 19的酶切和去磷酸化
按照pUC 19质粒10 μL,BamH I酶2 μL,10 ×H Buffer 3 μL,ddH2O 15 μL配成30 μL体系,37℃酶切2 h,用0.9%的琼脂糖检测酶切结果,用未经酶切的质粒做比照.使用CIAP 2 μL,10× Buffer 5 μL,酶切的 pUC 19质粒26 μL,ddH2O 17 μL配成50 μL体系.37℃反应30 min,0.9%的琼脂糖电泳胶回收.
4)载体与回收片段的连接
将回收的片段 10 μL,酶切 pUC 19载体1 μL,T4连接酶2 μL(15 U/μL),10×T4 DNA Ligase Buffer 2 μL,50%PEG 1 μL,ddH2O补足20 μL,16℃连接过夜.
5)连接产物的转化和重组子筛选
热击转化参考文献[19],热击90 s.在其中加入900 μL的LB培养基,37℃ 140 r/min培养2 h,取100 μL菌液涂布在固体LB培养基表面,其中包括100 μg/mL的Amp,24 μg/mL的IPTG和40 μg/mL的X-Gal.用封口膜封好后,倒置放入37℃恒温箱中过夜培养20 h.
6)重组质粒的鉴定
经蓝白斑筛选后,随机选取200个白色单菌落,每个单菌落先挑出一部分到事先分装好的1 mL的LB培养基中(含有100 μg/mL的Amp),另一部分挑入配好的PCR体系中,PCR反应体系为25 μL,使用M13通用引物;反应条件为:94℃预变性5 min;接下来进行30个循环反应:94℃变性1 min,55℃退火40 s,72℃延伸3 min;72℃最终延伸10 min.然后使用0.9%的琼脂糖电泳检测结果.在离心管中的培养液送入37℃摇床,140 r/min培养3 h.对琼脂糖电泳结果中出现目标条带的菌液送至上海生工公司测序.
7)序列结果分析
由生物公司测序结果在NCBI的核酸和蛋白序列数据库进行比对分析.
2 结果与分析
2.1 基因组DNA的提取和不完全酶切
构建基因组文库的关键和前提是得到大量的高质量基因组DNA.为得到适于构建文库的部分消化产物,DNA初始长度至少应是用于克隆片段的4倍,否则酶切连接后产生的有效片段较少.本实验在部分酶切时选择较高浓度的DNA酶切结果,分别切取在1 000~7 500 bp左右的片段进行回收.(基因组电泳见图1,部分酶切和胶回收结果见图2)
图1 基因组DNA组抽提结果

图2 Sau 3A I酶切DNA及胶回收结果
2.2 质粒pUC 19的酶切和去磷酸化
由于限制性内切酶BamH I和Sau 3A I具有同样的黏性末端,酶切后所产生的黏性末端能够很好地连接,因而选用BamH I切割质粒pUC 19 (酶切结果如图3所示).在质粒的提取过程中,由于机械力、酸碱度或试剂的原因,可能会使质粒DNA链发生不同程度的断裂.所以,多数质粒抽提物种含有3种构型的质粒:共价闭合环状DNA (cccDNA),质粒的两条链没有断裂,超螺旋状态;开环DNA(ocDNA),质粒的一条链断裂,松弛的环状分子;线性DNA(lDNA),质粒的两条链均断裂,线性分子.由于不同构象的质粒电泳迁移率不同,会呈现出3条荧光带,其中超螺旋状态的质粒迁移速率较快,因此会在最前端,如图3中泳道3所示,超螺旋状态的质粒数量最多,也证明提取的质粒的完整性较高;经过酶切后质粒被切成相同的直线型构象,所以只在2.7 kb处有唯一条带.为了降低酶切后质粒的自连,提高连接效率,实验采用碱性磷酸酶(CIAP)对酶切后的质粒进行去磷酸化.在蓝白斑筛选重组子时计算白斑所占比例将近95%,说明载体酶切后的去磷酸化取得了很好效果.如图3所示.
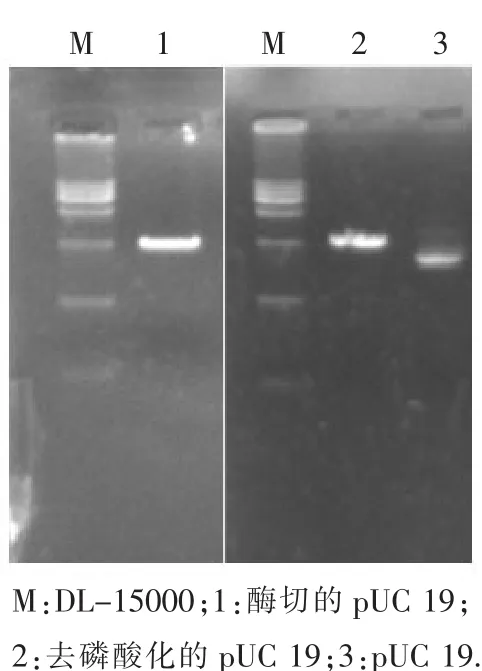
图3 Bam H I酶切pUC 19及去磷酸化结果
2.3 基因文库容量计算
根据公式N=ln(1-P)/ln[1-(I/G)](N为转化子数,P为获得目的基因的可能性,一般为99%,I为克隆片段的平均大小,G为基因组大小,虽然产乙醇杆菌属基因组大小没有完全确定,但是有报道的最相近的梭菌属菌株平均的基因组为4.6 Mb[20]),获得目的基因的可能性为99%时,所需的最小基因文库的转化子数量为6.9× 103个,本实验转化得到9×103多个转化子,大于目标要求,说明具有较高的库容量.
2.4 重组子鉴定
随机挑取的白色菌落培养,提取的重组质粒,电泳迁移率均小于载体pUC 19,证明均有外源基因插入.如图4所示.

图4 抽提重组质粒结果
2.5 新基因的发现
随机挑取200个白色菌落,经过菌落PCR检查有重组子样品送出测序.菌落PCR结果如图5所示.
图5 重组质粒菌落PCR电泳图
测序结果使用 NCBI的 nucleotide blast和blastx比对分析,200个测序结果中,大多数片段与一些经过全基因组测序之后的细菌的假想蛋白(hypothetical protein)相似性很高,很多相似性在90%以上.在比对结果中,有49个包含功能蛋白基因的片段,其中涵盖较大的如表1所示.这些片段特别是与数据库中一些梭菌属的对应基因有很高的相似性和亲缘性.
这些片段中,有5个包含了完整基因的开放阅读框(Open Reading Frame,ORF):polysaccharide transporter、IstB helper protein、acetylornithine aminotransferase、hemerythrin-like metal-binding protein、phi13 family major tail protein.使用 Cassette PCR技术又获得了hydroxylamine reductase和TerL两个功能基因的ORF,并将序列提交到NCBI数据库中,结果如表2所示.

表1 相似性较高的功能片段名称
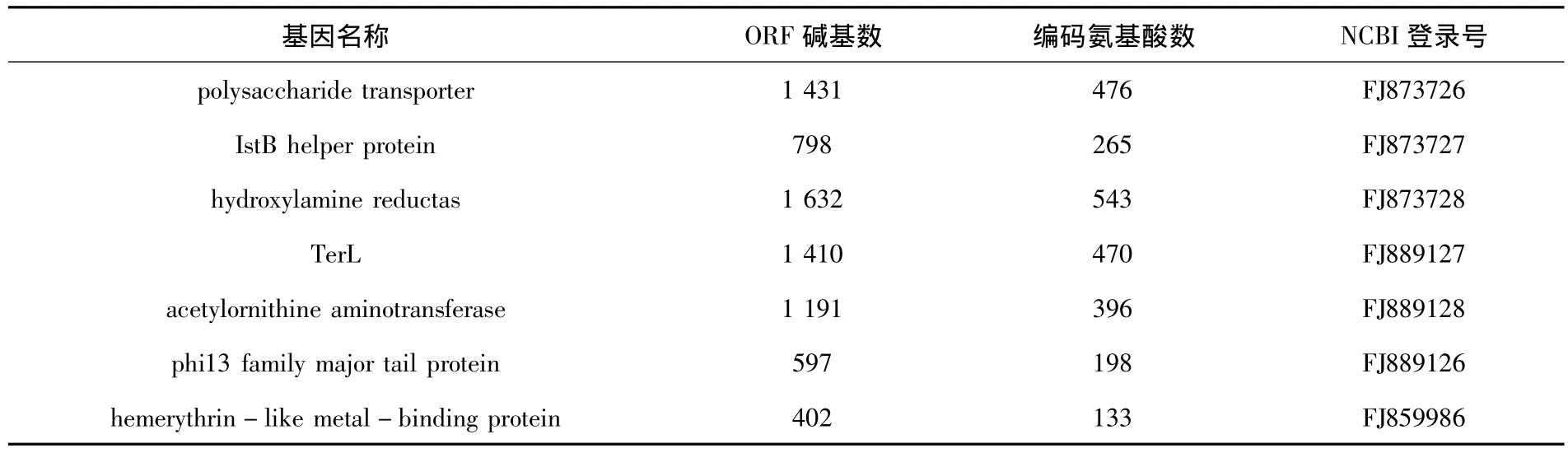
表2 获得完整开放阅读框的基因
3 讨论
哈尔滨产乙醇杆菌经前期研究发现是不同于传统丁酸发酵产氢细菌的新型产氢菌属,它进行特有的乙醇型发酵,在低pH条件下具有较高产氢率,且产氢能力与丁酸发酵类型相当.因此推断该菌属可能会存在不同于已知丁酸发酵产氢细菌的代谢途径.
本研究构建了哈尔滨产乙醇杆菌属模式菌株YUAN-3的基因组文库,文库容量达到理论要求.对其中200个序列进行测序比对分析,并结合Cassette PCR技术共获得7个基因的开放阅读框.从200个序列比对的结果可以分析出,这些功能基因大多与梭菌属有很高的相似性和同源性.两个菌属的细菌在发酵产氢时代谢类型不同,但从很多测序结果的高度相似性可以推断,一定存在着某些特殊的功能基因或酶在关键的节点改变了细菌的代谢流,进而影响了两个菌属细菌的发酵类型和末端产物,从而产生了不同的发酵类型.对这一特殊菌属的细菌进行全基因组测序分析将有助于了解其不同于传统的发酵类型,并可能推断出新的代谢途径,为此全基因组序列分析工作将逐步在后续研究中开展.
[1] DAS D,VEZIROLU T N.Hydrogen production by biological processes:A survey of literature[J].International Journal of Hydrogen Energy,2001,26:13-28.
[2] KOTAY S M,DAS D.Biohydrogen as a renewable energy resource-prospects and potentials[J].International Journal of Hydrogen Energy,2008,33:258-263.
[3] OH Y K,SEOL E H,KIM J R,et al.Fermentative bio -hydrogen production by a new chemoheterotrophic bacterium Citrobacter sp.Y19[J].International Journal of Hydrogen Energy,2003,28:1353-1359.
[4] OH Y K,SEOL E H,LEE E Y,et al.Fermentative hydrogen production by a new chemoheterotrophic bacterium Rhodopseudomonas palustris P4[J].International Journal Hydrogen Energy,2002,27:1373-1379.
[5] KUMAR N,DAS D.Enhancement of hydrogen production by Enterobacter cloacae IIT-BT08[J].Process Biochemistry,2000,35:589-593.
[6] YOKOI H,TOKUSHIGE T,HIROSE J,et al.Hydrogen production by immobilized cells of Enterobacter aerogenes strain HO-39[J].Journal of Fermentation and Bioengineering,1997,83(5):481-484.
[7] TAGUCHI F,CHANG J D,MIZUKAMI N,et al.Isolation of a hydrogen-producing bacterium Clostridium beijerinckii strain AM21B,from termites[J].Canadian Journal of Microbiology,1993,39:726-730.
[8] 李宇亮,李小明,郭亮,等.高效产氢菌株Enterococcus sp.LG1的分离及产氢特性[J].微生物学通报,2008,35(9):1373-1378.
[9] TANISHO S,SUZUKIY,WAKAO N.Fermentative hydrogen evolution by enterobacter aerogenes strain E82005[J].International Journal of Hydrogen Energy,1987,12(9):623-627.
[10] 林明.高效产氢发酵新菌种的产氢机理及生态学研究[D].哈尔滨:哈尔滨工业大学,2002.
[11] REN N,WANG B,MA F.Hydrogen bio-production of carbohydrate fermentation by anaerobic activated sludge process[C]//Proceedings of the 68th Annual Water Environment Federation Conference and Exposition.Water Environment Federation. Alexandria,VA:[s.n.],1995:145-153.
[12] REN N,WANG B,HUANG J.Ethanol-type fermentation from carbohydrate in high rate acidogenic reactor[J]. Biotechnology and Bioengineering,1997,54:428-433.
[13] REN N,XING D,RITTMAM B E,et al.Microbial community structure of ethanol type fermentation in bio-hydrogen production[J].Environmental Microbiology,2007,9(5):1112-1125.
[14] XING D,REN N,LI Q,et al.Ethanoligenens harbinense gen.nov.,sp.nov.,isolated from molasses wastewater[J].International Journal of Systematic and Evolutionary Microbiology,2006,56:755-760.
[15] XING D,REN N,WANG A,et al.Continuous hydrogen production of auto-aggregative Ethanoligenens harbinense YUAN-3 under non-sterile Condition[J]. International Journal of Hydrogen Energy,2008,33:1489-1495.
[16] 林海龙,任南琪,郑国香,等.高效产氢菌B49菌株adh和L-ldh基因克隆及序列分析[J].微生物学通报,2008,35(5):788-797.
[17] 林明,任南琪,马汐平,等.产氢发酵细菌培养基的选择和改进[J].哈尔滨工业大学学报,2003,35 (4):398-402.
[18] 孙继华,申佩弘,武波.一株新的耐辐射菌WGR702的分离鉴定及耐辐射特性[J].微生物学通报,2008,35(8):1214-1218.
[19] 萨姆布鲁克J,弗里奇E F,曼尼阿蒂斯T.分子克隆实验指南[M].2版.金冬雁,黎孟枫,等,译.北京:科学出版社,1999.
[20] WILKINSON S R,YOUNG M.Wide diversity of genome size among different strains of Clostridium acetobutylicum[J].Journal of General Microbiology,1993,139(5):1069-1076.

