布拉酵母菌生物量及高海藻糖含量积累条件的优化
王子辉 楚 杰 王君高 刘可春
布拉酵母菌(Saccharomyces boulardii)是在印尼荔枝中分离得到的一种适温的、非毒性酵母菌,是酿酒酵母的亚种,曾被广泛应用于人类抗击腹泻的药物中,它能很有效的治疗肠道的各种炎症,在治疗肠炎和细菌引起的腹泻方面疗效十分显著。其制剂应用于畜牧业,可有效降低病原菌和其毒素的浓度,并能加强微生态平衡,刺激免疫系统,作为饲料添加剂的应用已得到包括中国、欧盟在内的世界上许多国家的认可。最新研究结果表明,布拉酵母菌还能抑制大肠杆菌内毒素的毒性作用,降低肠道内大肠杆菌数量,有望用于防治鸡大肠杆菌病;布拉酵母菌作为一种新型微生态制剂,在畜牧业中必将有广阔的应用前景。但在布拉酵母菌的研究中,我们发现其抗逆性能力差,在后期制备活菌制剂过程中,死亡率较高,经研究发现,海藻糖对其有神奇的保护作用。
海藻糖是一种非还原性的二糖,广泛的存在于酵母菌、真菌、动植物体内,可以非常有效地保护生物膜和生物大分子,从而避免细胞受到干燥、冷冻和渗透压巨变造成的伤害,具有“生命之糖”的称号。酵母细胞内海藻糖的含量是由合成和分解的平衡调节决定,这种平衡调节随着生长周期、营养和环境条件而发生变化。本试验通过培养基成分对布拉酵母菌生物量及海藻糖积累的影响,确定其最佳用量以提高布拉酵母菌生物量及海藻糖的含量,从而提高布拉酵母菌的成活率。
1 材料与方法
1.1 材料与仪器
1.1.1 主要材料
布拉酵母菌(本实验室保藏)、三氯乙酸、36%盐酸、乳糖、蔗糖、麦芽糖、葡萄糖、尿素、酵母膏、蛋白胨、柠檬酸三铵、磷酸氢二铵、蛋白胨、琼脂粉、玉米浆等。
1.1.2 主要仪器
SBA-40C型葡萄糖生物传感器(山东省科学院生物研究所研制)、超声波细胞破碎仪(宁波新芝生物科技股份有限公司)、水浴锅、摇床、烘箱。
1.1.3 种子培养
以7%的葡萄糖为碳源,0.7%的磷酸氢二铵为氮源,1.0%的玉米浆为生长因子,0.2%的磷酸二氢钾为无机盐配制种子培养基,500 ml三角瓶装量100 ml,灭菌后无菌条件下挑取三环布拉酵母菌种接入种子培养基中,30℃、200 r/min摇床振荡培养16 h备用。
1.1.4 摇瓶发酵培养
发酵培养基同1.1.3节,将种子培养液按10%的接种量接种于发酵摇瓶培养基中,30℃、200 r/min摇床振荡培养18 h。
1.1.5 生物量的测定
将1.1.4节中发酵液5000 r/min离心10 min,收集菌体,用生理盐水洗涤两遍,称重。
1.1.6 布拉酵母菌海藻糖提取及含量测定方法
以5%的三氯乙酸做提取剂,超声破碎10 min后100℃水浴30 min得上清液。然后将提取液用5%盐酸在100℃下水解5 h,用生物传感器测定葡萄糖含量,得海藻糖含量。
1.2 试验方法
1.2.1 培养基成分对布拉酵母菌生物量及海藻糖含量积累的影响
1.2.1.1 碳源对布拉酵母菌生物量及海藻糖含量积累的影响
取4个500 ml的三角瓶,分别以7%的乳糖、蔗糖、麦芽糖、葡萄糖为碳源,其余同1.1.3配制液体培养基150 ml,灭菌后将1.1.3节中培养好的种子液按10%的接种量接入4个三角瓶中,30℃、200 r/min摇床振荡培养18 h,按1.1.5节及1.1.6节方法测定生物量及海藻糖含量。
1.2.1.2 碳源浓度对布拉酵母菌生物量及海藻糖含量积累的影响
取4个500 ml的三角瓶,分别以7%、10%、12%、15%的葡萄糖为碳源,其余同1.1.3节配制液体培养基150 ml,灭菌后将1.1.3节中培养好的种子液按10%的接种量接入4个三角瓶中,30℃、200 r/min摇床振荡培养18 h,按1.1.5节及1.1.6节方法测定生物量及海藻糖含量。
1.2.1.3 氮源对布拉酵母菌生物量及海藻糖含量积累的影响
取4个500 ml的三角瓶,分别以0.7%的柠檬酸三铵、尿素、酵母膏、磷酸氢二铵为氮源,其余同1.1.3节,配制液体培养基150 ml,灭菌后将1.1.3节中培养好的种子液按10%的接种量接入4个三角瓶中,培养18 h,按1.1.5节及1.1.6节方法测定生物量及海藻糖含量。
1.2.1.4 氮源浓度对布拉酵母菌生物量及海藻糖含量积累的影响
取4个500 ml的三角瓶,分别以0.5%、0.7%、1.0%、1.2%的柠檬酸三铵为氮源,其余同1.1.3节配制液体培养基150 ml,灭菌后将1.1.3节中培养好的种子液按10%的接种量接入4个三角瓶中,30℃、200 r/min摇床振荡培养18 h,按1.1.5节及1.1.4节方法测定生物量及海藻糖含量。
1.2.1.5 玉米浆含量对布拉酵母菌生物量及海藻糖含量积累的影响
取4个500 ml的三角瓶,分别以0.7%的柠檬酸三铵为氮源,1.0%、1.5%、2.0%、2.5%的玉米浆为生长因子,其余同1.1.3节配制液体培养基150 ml,灭菌后将1.1.3节中培养好的种子液按10%的接种量接入4个三角瓶中,30℃、200 r/min摇床振荡培养18 h,按1.1.5节及1.1.6节方法测定生物量及海藻糖含量。
1.2.1.6 磷酸氢二钾浓度对布拉酵母菌生物量及海藻糖含量积累的影响
取4个500 ml的三角瓶,分别以 0.1%、0.2%、0.3%、0.5%的磷酸二氢钾为无机盐,其余同1.1.3配制液体培养基150 ml,灭菌后将1.1.3节中培养好的种子液按10%的接种量接入4个三角瓶中,30℃、200 r/min摇床振荡培养18 h,按1.1.5节及1.1.6节方法测定生物量及海藻糖含量。
1.2.2 正交试验
分别以葡萄糖、柠檬酸三铵、玉米浆、磷酸二氢钾为因素,每个因素设置3个水平,以海藻糖和菌体生物量为考察指标,进行L9(34)正交试验(见表1),根据试验结果优化布拉酵母菌细胞内海藻糖富集和菌体生长的培养基。
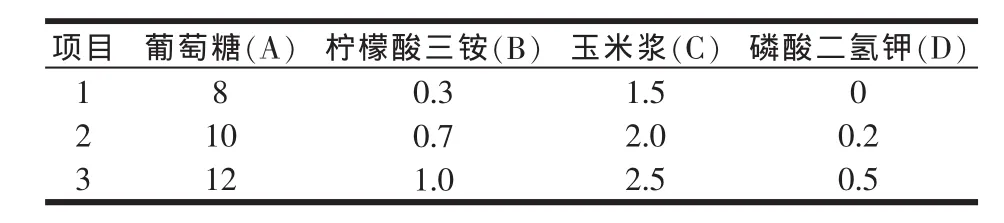
表1 培养基优化正交试验因素与水平(%)
1.2.3 优化前后布拉酵母菌生物量及海藻糖含量的比较试验
取12个500 ml的三角瓶,其中6个按葡萄糖7%、磷酸氢二铵0.7%、玉米浆1.0%、磷酸二氢钾0.2%配制液体培养基,每瓶150 ml;另外6个按葡萄糖10%、柠檬酸三铵0.7%、玉米浆1.5%、磷酸二氢钾0.2%配制液体培养基,每瓶150 ml;灭菌后将1.1.3节中培养好的种子液按10%的接种量接入各三角瓶中,30 ℃、200 r/min摇床振荡培养,分别在 14、16、18、20、22、24 h取样,按1.1.5节及1.1.6节方法测定生物量及海藻糖含量。
2 结果与讨论
2.1 培养基成分对布拉酵母菌生物量及海藻糖含量积累的影响
2.1.1 碳源对布拉酵母菌生物量及海藻糖含量积累的影响(见图1)
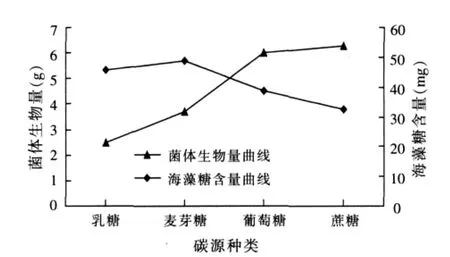
图1 碳源对布拉酵母菌生物量及海藻糖含量积累的影响
由图1可以看出,乳糖和麦芽糖为碳源时,布拉酵母菌的生物量不高,虽然测定所得的海藻糖含量比较高,但因发酵过程中乳糖和麦芽糖先通过渗透作用进入布拉酵母细胞内,有部分还没有被菌体利用,而乳糖和麦芽糖都含有一分子的葡萄糖,测定过程中不能排除是酵母细胞中未洗净的残留糖类干拢;而蔗糖和葡萄糖为碳源时比较利于布拉酵母菌生物量的增长,但蔗糖所培养的酵母中海藻糖含量较低,且成本较高,研究表明,海藻糖是由UDP-葡萄糖和6-P-葡萄糖两步反应形成,因此,葡萄糖是海藻糖合成的最初底物,且葡萄糖价格低廉,故后续试验中选择葡萄糖做碳源。
2.1.2 碳源浓度对布拉酵母菌生物量及海藻糖含量积累的影响(见图2)
由图2可以看出,布拉酵母菌体内的海藻糖含量随着葡萄糖浓度的增加而升高,生物量及海藻糖含量在葡萄糖浓度为10%时达到最大,并随浓度的增加而趋平缓,仔细观察图的走向可以看出葡萄糖浓度由10%增加为15%时,生物量及海藻糖含量基本维持在相对平衡的水平,故培养基中葡萄糖浓度选定在10%。
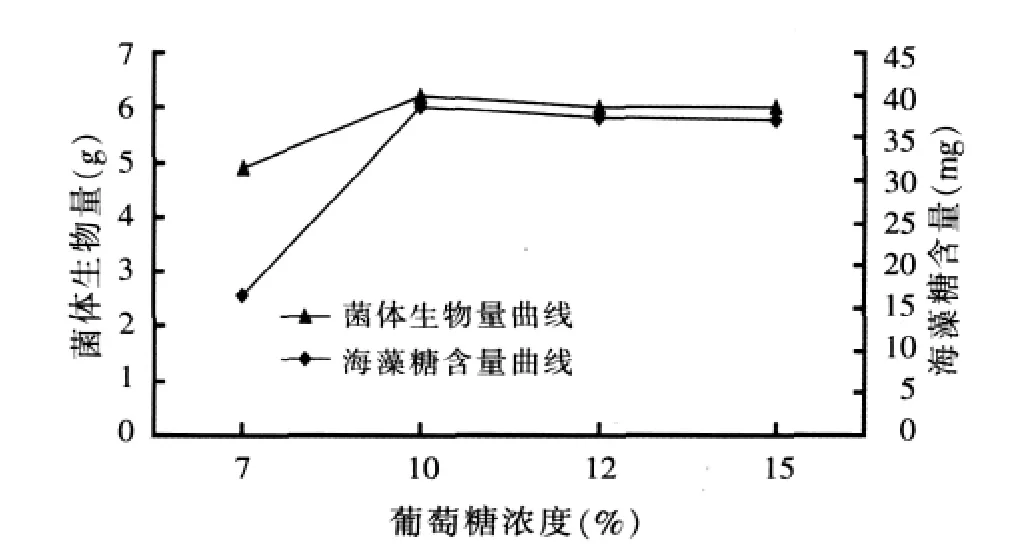
图2 碳源浓度对布拉酵母菌生物量及海藻糖含量积累的影响
2.1.3 氮源对布拉酵母菌生物量及海藻糖含量积累的影响(见图3)
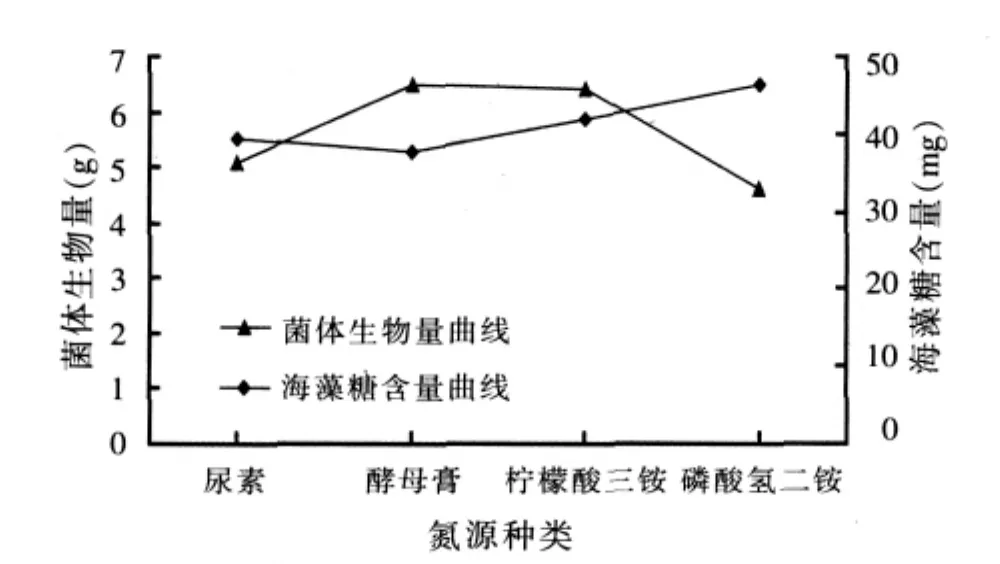
图3 氮源对布拉酵母菌生物量及海藻糖含量积累的影响
由图3可以看出,柠檬酸三铵和酵母膏为氮源时,比较适合布拉酵母菌生物量的增长,二者生物量相差无几,但柠檬酸三铵为氮源时所得酵母中海藻糖含量明显高于酵母膏为氮源时的含量,并且柠檬酸三铵价格便宜,比较有益于工业生产,故后续试验中选柠檬酸三铵作为氮源。
2.1.4 氮源浓度对布拉酵母菌生物量及海藻糖含量积累的影响(见图4)
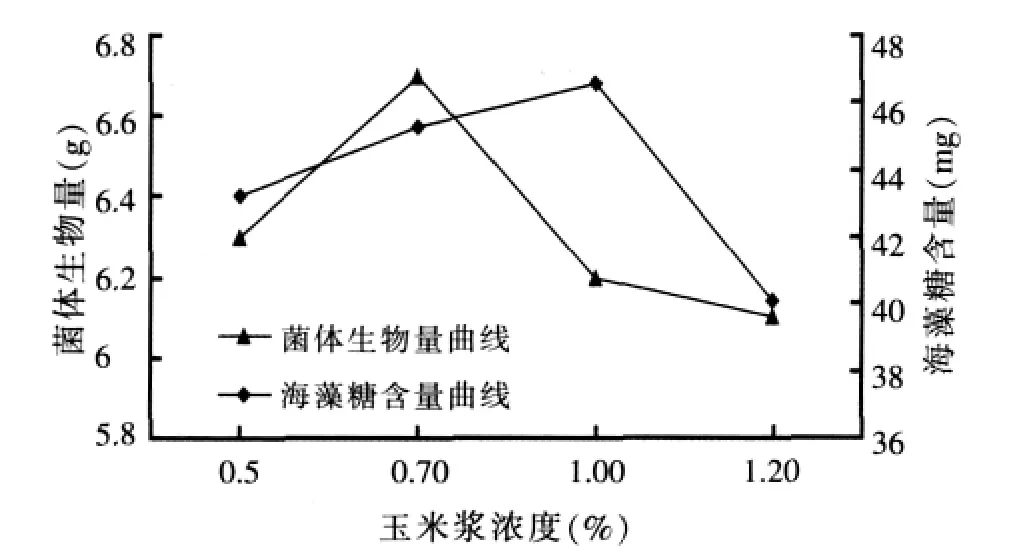
图4 氮源浓度对布拉酵母菌生物量及海藻糖含量积累的影响
由图4可以看出,柠檬酸三铵浓度为0.70%时所得布拉酵母菌的生物量最大,且海藻糖含量较高,故后续试验中,培养基中氮源浓度选择在0.70%。
2.1.5 玉米浆浓度对布拉酵母菌生物量及海藻糖含量积累的影响(见图5)
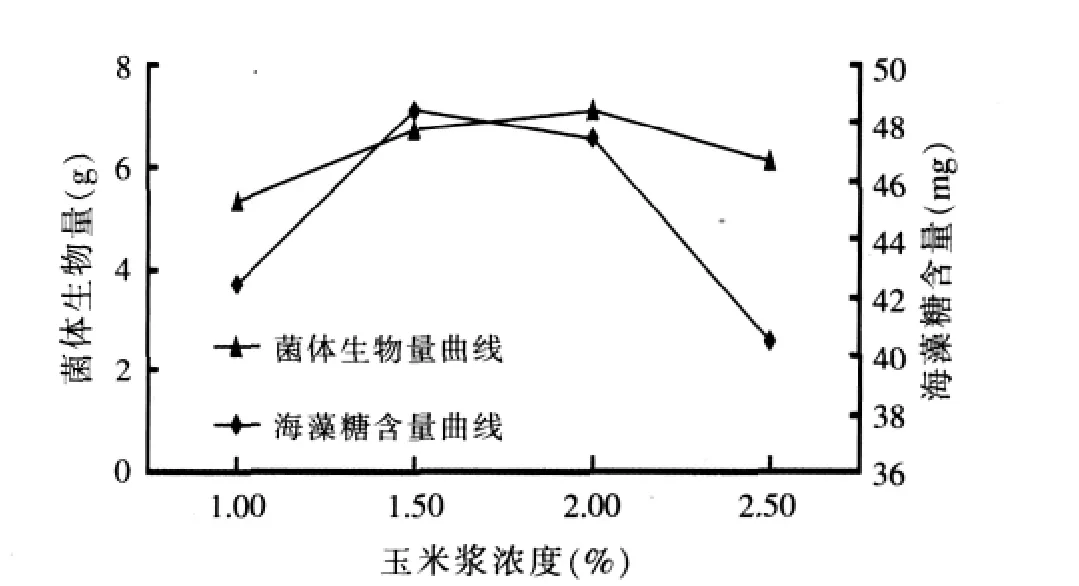
图5 玉米浆浓度对布拉酵母菌生物量及海藻糖含量积累的影响
由图5可以看出,在玉米浆浓度为1.5%时比较适合布拉酵母菌海藻糖的积累,生物量虽不是最高,但也和最大值相差甚微,故在后续试验中玉米浆的浓度选择在1.5%~2.0%。
2.1.6 磷酸氢二钾浓度对布拉酵母菌生物量及海藻糖含量积累的影响(见图6)
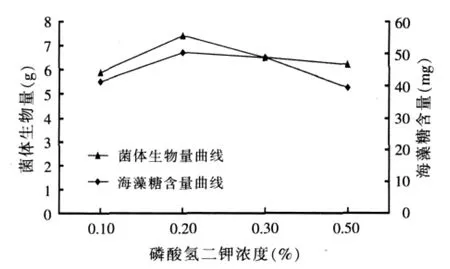
图6 磷酸氢二钾浓度对布拉酵母菌生物量及海藻糖含量积累的影响
由图6可以看出,在磷酸二氢钾浓度为0.20%时,既比较适合布拉酵母菌生物量的增长,同时酵母中海藻糖含量相比其它几个浓度也达到最高,故本试验无机盐磷酸二氢钾的浓度选择在0.20%。
2.2 正交试验
由表2可以看出,葡萄糖、柠檬酸三铵、玉米浆、磷酸二氢钾对菌体生物量积累的影响主次为:葡萄糖>柠檬酸三铵>磷酸二氢钾>玉米浆;对海藻糖积累的影响主次为:葡萄糖>玉米浆>磷酸二氢钾>柠檬酸三铵,综合两个指标可得出最佳的条件组合为A2B2C1D2,即10%的葡萄糖、0.7%的柠檬酸三铵、1.5%的玉米浆、0.2%的磷酸氢二钾。
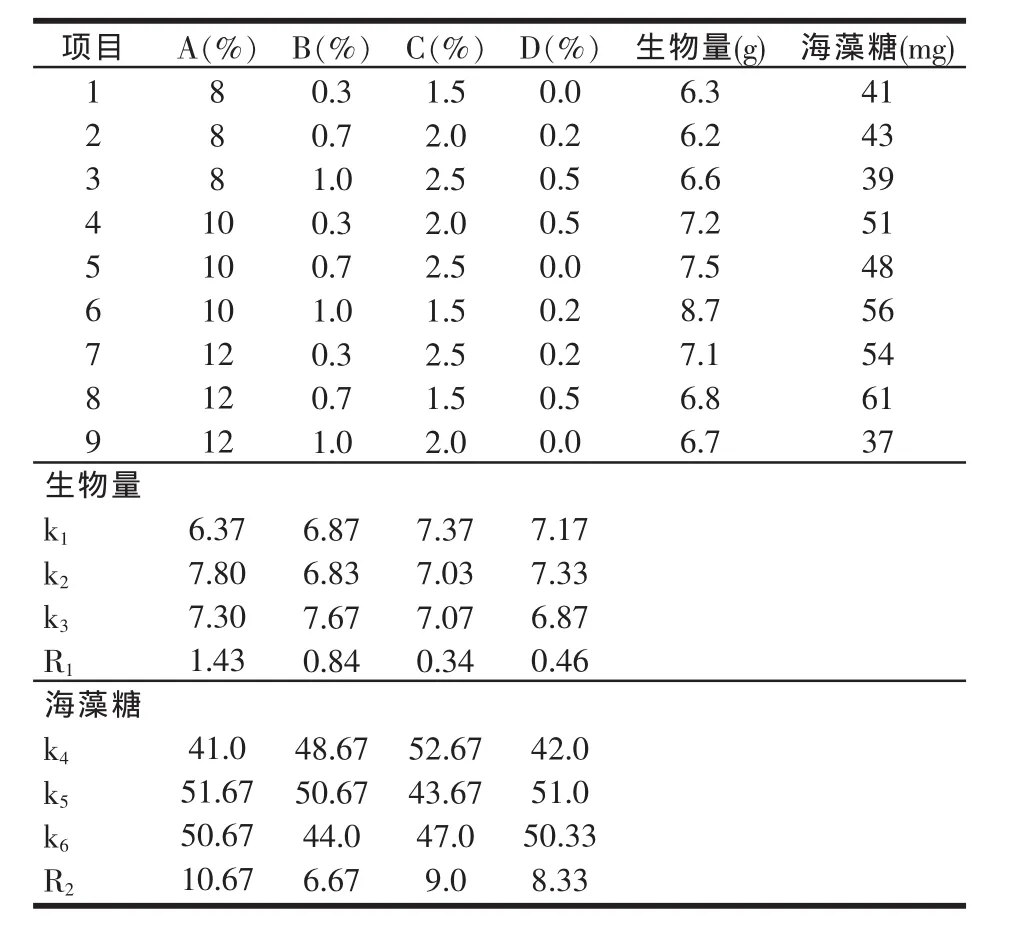
表2 培养基优化正交试验结果
2.3 优化前后布拉酵母菌生物量及海藻糖含量的比较试验(见图 7、图 8)

图7 培养基优化前后菌体质量对比
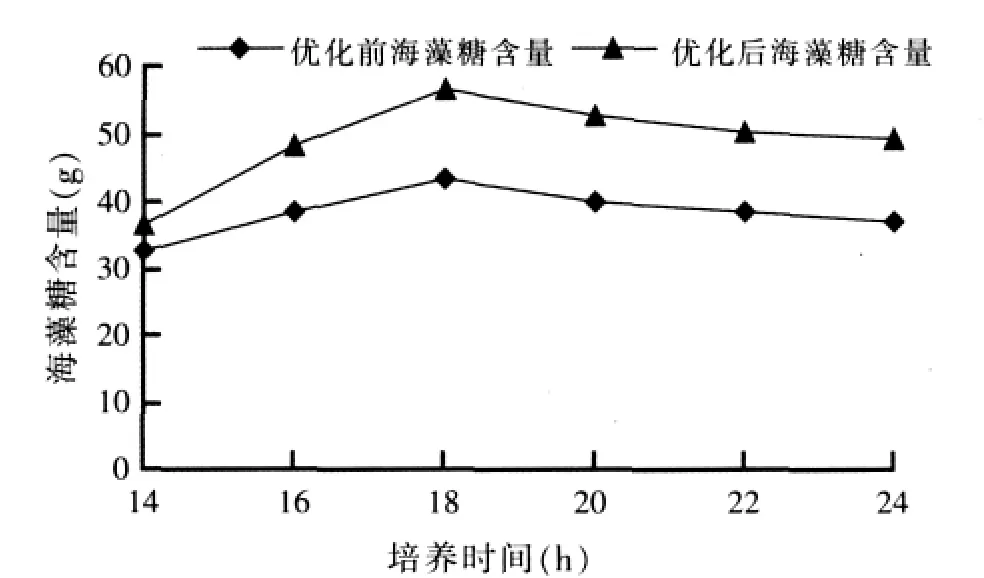
图8 培养基优化前后海藻糖含量对比
由图7、8可以看出,优化后的培养基无论在生物量增长,还是海藻糖含量的积累都明显优于优化之前培养基,分别提高 34%(优化前:6.2 g;优化后:8.3 g)和 30%(优化前:43.5 mg/dl;优化后:56.6 mg/dl)。并且18 h是布拉酵母菌生物量及海藻糖含量的最佳积累点。
3 结论
3.1 本试验通过培养基成分对布拉酵母菌菌体中海藻糖积累和布拉酵母菌生物量的影响,摸索出既利于菌体生长,又利于菌体中海藻糖积累的培养基配方:10%的葡萄糖、0.70%的柠檬酸三铵、1.5%的玉米浆、0.20%的磷酸氢二钾。优化后的培养基布拉酵母菌的生物量比优化前提高了约34%,菌体中海藻糖含量比优化前提高了约30%。
3.2 由于布拉酵母菌制剂应用于畜牧业,可有效降低病原菌含量和其毒素的浓度,并能加强微生态平衡,刺激免疫系统,故其菌体作为饲料添加剂,必将有广阔的应用前景,且优化后培养基配方中的碳源、氮源等价格都比较低廉,故此培养基用于工业生产布拉酵母菌活菌制剂,不仅能节约成本,而且能提高产品产量。优化后的培养基在布拉酵母菌海藻糖积累方面有一定增加,对布拉酵母菌后期制备过程中有一定的保护作用。
[1]Dorota C,Patrick R.Experimental effects of S.boulardii on diarrheal pathogens[J].Microbes Infect,2002,4(8):733.
[2]胡祥英.布拉酵母菌治疗小儿轮状病毒肠炎53例临床研究[J].中国微生态学杂志,2002,14(6):352.
[3]Kirchhelle A,Fruhwein N,Toburen D.Treatment of persistent diarrhea with S.boulardii in returning travelers.Results of a prospective study[J].Fortschr Med.,1996,11(114):136.
[4]Amir Q,Samer A,Michel W S.boulardii.Stimulates Intestinal Immunoglobulin A Immune Response to Clostridium difficile ToxinA in Mice[J].Infect.Immun.,2001,69(4):2762.
[5]刘传斌,谢健.海藻糖的性质及其广阔应用前景[J].中国微生态学杂志,1998,10(6):377-379.
[6]张树珍.海藻糖的研究进展及其应用前景 [J].华南热带农业大学学报,2000(3):22-29.

