噻唑蓝比色法检测变异链球菌、血链球菌、伴放线菌嗜血菌的研究
王忠朝 范丽苑 蒋俊强 蔡炜 丁一
(1.泸州医学院附属口腔医院 口腔内科;2.修复科,四川 泸州 646000;3.四川大学华西口腔医院 牙周病科,四川 成都 610041)
噻唑蓝比色法检测变异链球菌、血链球菌、伴放线菌嗜血菌的研究
王忠朝1范丽苑2蒋俊强1蔡炜1丁一3
(1.泸州医学院附属口腔医院 口腔内科;2.修复科,四川 泸州 646000;3.四川大学华西口腔医院 牙周病科,四川 成都 610041)
目的 探讨噻唑蓝(MTT)法用于口腔常见细菌(变异链球菌、血链球菌、伴放线菌嗜血菌)活菌计数的可行性及具体应用过程中的实验条件。方法 本实验以菌落形成单位(CFU)法为标准对照。实验通过改变比色的波长、反应时间、试剂剂量、细菌菌龄等实验条件,获得MTT法测量常见口腔细菌的一系列参数,对变异链球菌、血链球菌、伴放线菌嗜血菌进行活菌计数,并与CFU法所测的细菌数量相比较。结果 MTT法在测量变异链球菌时,最佳的检测波长为510 nm,最佳的测定细菌范围是1.5×105~1.0×107CFU·mL-1。MTT法在测量血链球菌时,最佳的检测波长为545 nm,最佳的测定细菌范围是1.5×105~2.0×107CFU·mL-1。MTT法在测量伴放线菌嗜血菌时,最佳的检测波长为557 nm,最佳的测定细菌范围是1.0×106~5.0×107CFU·mL-1。MTT法与菌落形成单位法的测量结果是一致的,并且对于不同菌龄的变异链球菌、血链球菌、伴放线菌嗜血菌均适用。结论 MTT法可以用于检测变异链球菌、血链球菌、伴放线菌嗜血菌等口腔常见细菌的活菌数量,并且具有快速、方便等优点。
噻唑蓝比色法; 变异链球菌; 血链球菌; 伴放线菌嗜血菌; 活菌计数
目前常用的活菌计数方法有菌落形成单位(colony formingunits,CFU)法、比浊法、显微计数法等[1]。但上述方法都存在一些不足之处,因此,希望找到一种快速、准确的活菌计数方法。四唑盐是一种能接受氢原子的染料,商品名为噻唑蓝(methyl thiazolyl tetrazolium,MTT)。外源性MTT可以被活细胞线粒体中的琥珀酸脱氢酶还原为难溶的蓝紫色结晶物甲臜,而死细胞无此作用。二甲基亚砜(dimethylsulfoxide,DMSO)可以溶解甲臜,该溶解液在一定波长下的光密度值(A值)可以间接反映活细胞数。在一定的细胞浓度范围内,A值与活细胞数成正比。MTT法目前主要用于细胞的计数、生物因子的活性检测、细胞毒性实验、抗肿瘤药物的大规模筛选等。具有工作量小、操作简便、快速、重复性好等优点[2-11]。本研究将以变异链球菌(Streptococcusmutans,S.mutans)、血链球菌(Streptococcus sanguis,S.sanguis)、伴放线菌嗜血菌(Haemophilus actinomycetemcomitans,H.actinomycetemcomitans)为例,采用MTT法测量口腔常见细菌的数量,探讨MTT法用于口腔细菌计数的可行性和影响因素,以及其具体应用过程中的实验条件。
1 材料和方法
1.1 菌种
变异链球菌标准株ATCC25175、血链球菌标准株ATCC10556、伴放线菌嗜血菌标准株NCTC9710(四川大学口腔疾病研究国家重点实验室)。
1.2 主要试剂和仪器
0.22μm微孔过滤MTT[6]除菌,4℃避光保存,2周内使用有效。DMSO(天津市博迪化工有限公司),离心机(上海安亭科学仪器厂),恒温箱(常州国华电器有限公司),全波长酶标仪Multiskan Spectrum(Thermo electron corporation公司,美国)。
1.3 细菌的培养
1.3.1 变异链球菌和血链球菌的培养 变异链球菌和血链球菌在兼性条件下(37℃、湿度75%~80%、90%N2、10%CO2)进行培养,培养后通过观察培养皿菌落形态及在显微镜下鉴定细菌。由于本研究采用的是2种不同的计数方法,故在细菌培养基的选择上采用不同的条件。当变异链球菌和血链球菌采用螺旋接种时,培养基为TPY固体培养基,培养时间为24 h,24 h后人工计数;当变异链球菌和血链球菌采用MTT法测量时,培养基为TPY液体培养基,培养时间分别为12、18、24 h。
1.3.2 伴放线菌嗜血菌的培养 伴放线菌嗜血菌在厌氧条件下(37℃、湿度75%~80%、80%N2、10% CO2、10%H2)进行培养,培养后通过观察培养皿菌落形态及在显微镜下鉴定细菌。与变异链球菌和血链球菌的培养一样,伴放线菌嗜血菌在培养时采用2种不同的培养基。当伴放线菌嗜血菌采用螺旋接种时,培养基为BHI固体培养基,培养时间为48 h,48 h后采用自动微生物分析仪计数。当伴放线菌嗜血菌采用MTT法测量时,培养基为BHI液体培养基,培养时间分别为12、24、36、48 h。
1.4 MTT法测量细菌数
1.4.1 最适检测波长的确定 MTT法中,MTT与琥珀酸脱氢酶反应生成甲臜,甲臜溶于DMSO后,形成酒红色的溶液。在400~600 nm范围内每间隔10 nm测定A值,以A值最大时的波长为本实验的最适检测波长,在此条件下所测的数据误差最小。
1.4.2 检测干扰物对测量结果的影响 在实验的操作中,由于细菌的状态、培养基、菌液处理需要加入的试剂等均可能对实验结果产生影响,故需要检测干扰物对测量结果的影响程度。以DMSO为参比,无菌生理盐水、无菌培养基、上清液(10 000 r·min-1离心10 min后,吸取上清液)和死菌体(沸水浴30min)作为待测样,用MTT法测得A值。
1.4.3 MTT与细菌反应时间的确定 MTT溶液加入菌液后,在37℃恒温的环境中发生生化反应,产生蓝紫色的悬浮颗粒,随着时间的推移,所产生的甲臜浓度增大,蓝紫色变浓。为了确定反应所需要的时间,分别对反应了0.5、1.0、1.5、2.0 h的生成物即刻离心,加入DMSO充分溶解,测量其A值。
1.4.4 反应所需MTT量的确定 为了保证细菌内琥珀酸脱氢酶能充分反应,加入MTT的量必须是过量的。因此,对相同量的细菌菌液分别加入0.05、0.1、0.15、0.2mL的MTT液,充分反应后离心,加入DMSO溶解,测量其A值。
1.4.5 不同菌龄细菌的数量与A值的关系 在实验中加入的MTT是过量的,因此,MTT与琥珀酸脱氢酶的氧化还原反应所生成的甲臜量取决于琥珀酸脱氢酶的量与活性。对于不同生长阶段的细菌来说,其琥珀酸脱氢酶的量与活性可能不同。因此,需要考察细菌处于不同生长阶段时对MTT法的测量结果是否有影响。由于变异链球菌、血链球菌、伴放线菌嗜血菌3种细菌的生长周期不一致,因此所测量的时间点有所不同。变异链球菌、血链球菌培养12、18、24 h后采用MTT法测量其A值。伴放线菌嗜血菌培养12、24、36、48 h后采用MTT法测量其A值。
1.4.6 最佳测量范围的确定 在某一细菌浓度范围内,A值与细菌数呈正相关关系,通过对不同菌龄细菌的数量与A值关系的统计分析,确定细菌的最佳测量范围。
1.4.7 菌液的处理 在确定最适检测波长、干扰物影响、反应时间、试剂剂量等后,先用比浊仪初步测定菌液的浓度,稀释至1×107CFU·mL-1备用。在确定检测范围时,将菌液倍比稀释。将MTT溶液0.2mL加入到1mL稀释菌液中,混匀后37℃分别恒温(0.5、1.0、1.5、2.0 h)10 000 r·min-1离心10min,去上清,加0.833mL DMSO溶解,加0.1mL至96孔板中,在各个细菌的最适波长下测量A值,求平均值。
1.5 CFU计数法
采用螺旋接种仪接种后计数。打开设备电源后,抽真空,然后采用戊二醛消毒,PBS液及双蒸水依次清洗。稀释菌液至可测范围内,取5mL左右至5mL一次性烧杯中,即接种至准备好的培养板上,培养一定时间后,可采用自动微生物分析仪计数或人工计数。
1.6 MTT法与CFU法的比较
将培养的细菌液稀释,通过MTT法测量A值,所测得的A值按照回归后的方程计算出MTT法所测得的细菌数,再与通过CFU法所测得的细菌数相比较,通过作图,分析二者测量结果的区别。
1.7 统计学分析
采用SPSS 13.0软件包对数据进行分析,对最适波长、MTT量、反应时间进行统计描述;对细菌数量与A值的关系采用回归方程的方法进行分析;对不同菌龄的细菌数量与A值关系之间的区别采用协方差分析方法进行分析;对于MTT法与CFU的比较,采用回归方程进行再预测的方法进行检测。
2 结果
2.1 最适检测波长的测定
变异链球菌在510 nm时的A值最大;血链球菌最大的吸收峰值在540~550 nm处,因此将545 nm定为检测波长;伴放线菌嗜血菌最大的吸收峰值在555~560 nm处,因此将557 nm定为检测波长。
2.2 干扰物对测量结果的影响
以DMSO为参比,无菌生理盐水、无菌培养基、上清液和死菌体作为待测样,采用MTT法测得A值的结果见表1。由表1可见,这些物质对于检测结果的干扰很小。
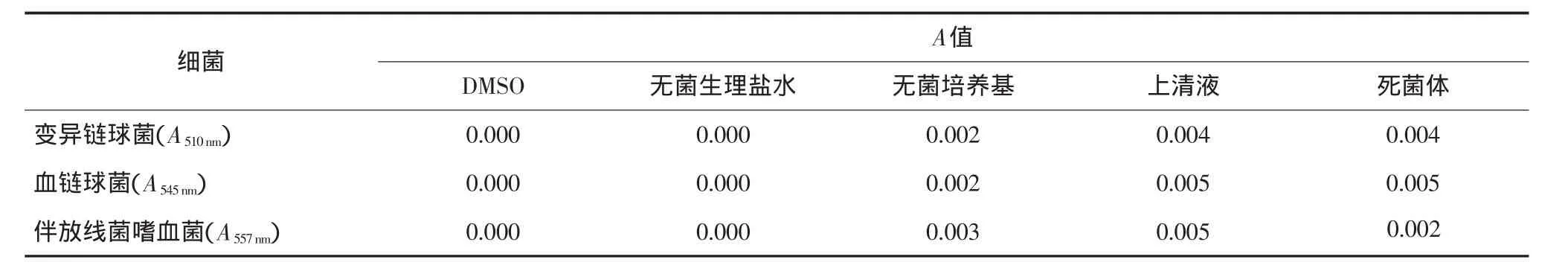
表1 不同物质以DMSO为对照时的A值Tab 1 A value of the different substances compared DMSO
2.3 反应时间对测量结果的影响
在各个反应时间点A值的测定结果见表2。由表2可见,反应在1.5 h后基本完成。

表2 不同反应时间点A值的测定结果Tab 2 A value of the different reaction time
2.4 MTT的量对结果的影响
随着加入MTT量的增加,可以观察到其颜色变深。对相同量的细菌菌液分别加入0.05、0.1、0.15、0.2mL的MTT液,其A值的测量结果见表3。由表3可见,加入MTT量在0.15mL时反应基本完成。
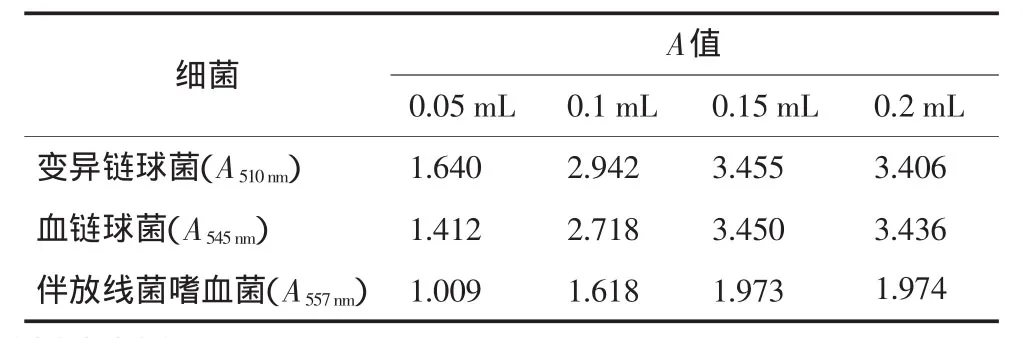
表3 加入不同MTT量后A值的测定结果Tab 3 A value of the different quantity of MTT
2.5 不同菌龄细菌的检测分析及其测量范围
2.5.1 不同菌龄变异链球菌细菌数与A值的关系不同培养时间变异链球菌细菌数与A值的关系间差异无统计学意义(P>0.05)。结果显示,MTT法适用于不同生长阶段的变异链球菌,当菌浓度在1.5× 105~1.0×107CFU·mL-1时与A值成正相关(r=0.803,P<0.05)。
2.5.2 不同菌龄血链球菌细菌数与A值的关系 不同培养时间血链球菌细菌数与A值的关系间差异无统计学意义(P>0.05)。结果显示,MTT法适用于不同生长阶段的血链球菌,并且当菌浓度在1.5×105~2.0×107CFU·mL-1时与A值成正相关(r=0.826,P<0.05)。
2.5.3 不同菌龄伴放线菌嗜血菌细菌数与A值的关系 不同培养时间伴放线菌嗜血菌细菌数与A值的关系间差异无统计学意义(P>0.05)。结果显示,MTT法适用于不同生长阶段的伴放线菌嗜血菌,当菌浓度在1.0×106~5.0×107CFU·mL-1时与A值成正相关(r=0.928,P<0.05)。
2.6 CFU法测量细菌数量的结果
变异链球菌在培养12、18、24 h的细菌数为6.5×108、6.0×108、6.0×108CFU·mL-1。血链球菌在培养12、18、24 h的细菌数为6.0×108、6.0×108、7.0×108CFU·mL-1。伴放线菌嗜血菌在培养12、24、36、48 h的细菌数为2.0×108、2.2×108、2.5×108、3.0×108CFU·mL-1。
2.7 MTT法与CFU法的比较结果
用MTT法与CFU法对细菌生长过程活菌浓度进行检测(图1~3),其中横坐标表示的是MTT法所测得的细菌数,纵坐标表示的是CFU法所测得的细菌数,直线表示的是过原点的,斜率为1的直线。由图1~3可见,MTT法与CFU法所测得的细菌数是一致的。
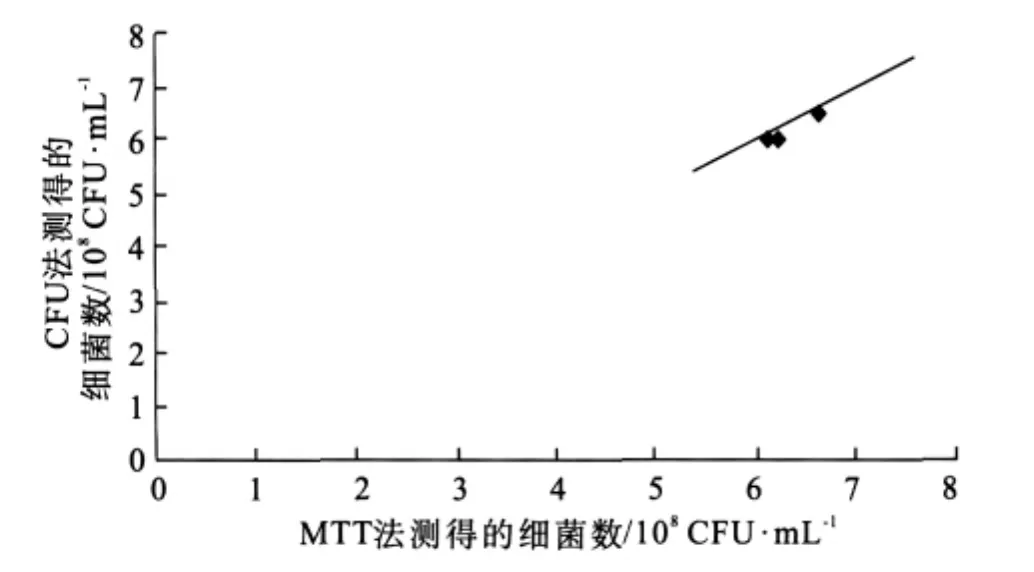
图1 MTT法与CFU法测量变异链球菌的比较Fig 1 Comparison of counting of S.mutans by MTT colorimetric and CFU method
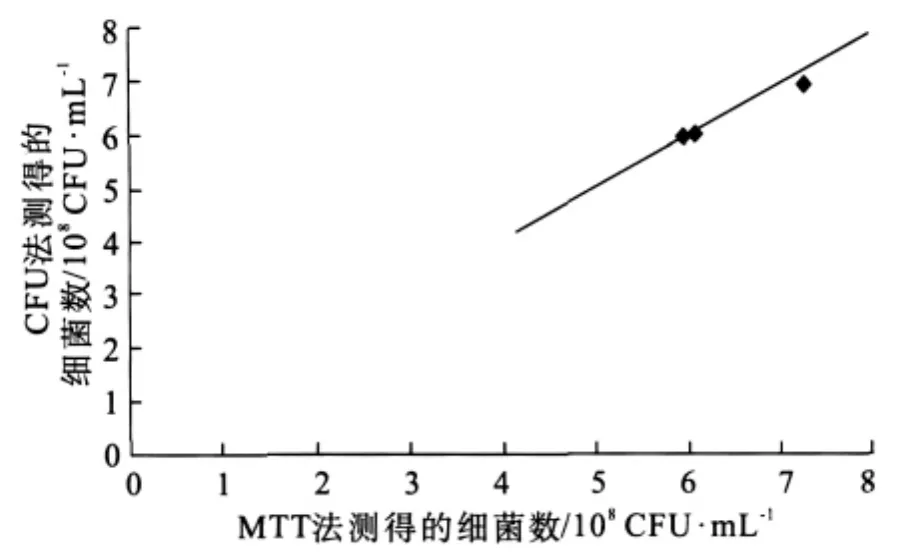
图2 MTT法与CFU法测量血链球菌的比较Fig 2 Comparison of counting of S.sanguis by MTT colorimetric and CFU method
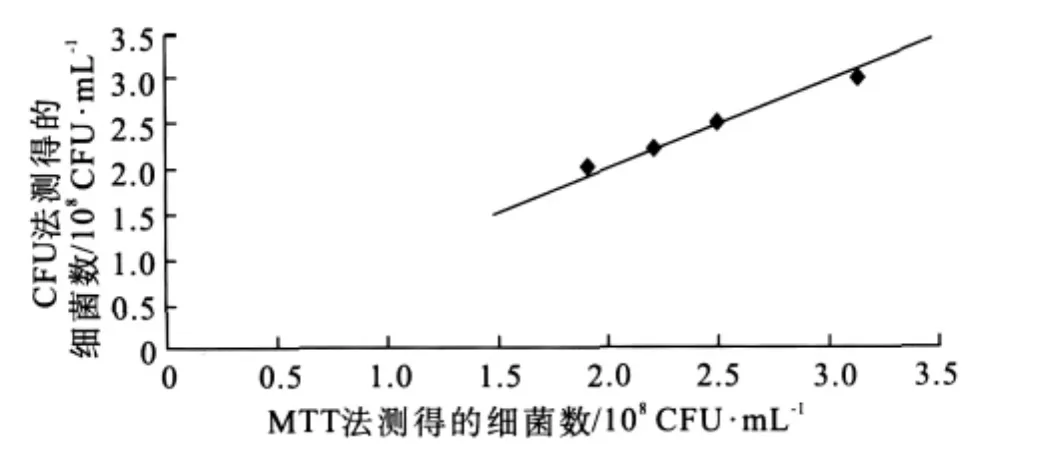
图3 MTT法与CFU法测量伴放线菌嗜血菌的比较Fig 3 Comparison of counting of H.actinomycetemcomitans by MTT colorimetric and CFU method
3 讨论
本研究采用MTT法测量口腔常见细菌的活菌数,并与CFU法相比较,探讨MTT法用于口腔细菌活菌计数的可行性。在本实验中发现:1)不同的细菌有其特有的测量波长;2)实验中各种有可能对测量结果有影响的试剂、成分等对测量结果无影响或影响很小;3)在充足的反应试剂和反应时间的条件下,可以准确测量细菌的活菌数量;4)在一定的细菌浓度范围内,A值与活菌数呈正相关关系,可以通过测量A值推算活菌数;5)对于处于不同生长阶段的细菌,MTT法均适用;6)采用MTT法测量细菌活菌数量的结果与CFU法一致。因此,可以认为,MTT法是一种可行的测量口腔细菌活菌数量的方法。
本实验应用螺旋接种仪进行细菌计数。螺旋接种仪具有自动化、可重复性、灵活性好、准确的优点,可广泛应用于食品医药、水、临床等领域对微生物含量较高的样品的定量分析,可以对菌含量从4~30×105CFU·mL-1的样品进行定量分析。
本实验对使用酶标仪测定口腔细菌活菌数量的MTT法进行了探讨,与文献中已有的用于动物细胞活细胞数以及少数测定其他细菌活菌计数测定方法[6,8-13]相比,用于口腔细菌测量的MTT法的改进之处以及测量口腔细菌时的适用条件有以下几点:1)琥珀酸脱氢酶与MTT反应温度为37℃,这是变异链球菌、血链球菌、伴放线菌嗜血菌生长的最适温度,对于口腔内的细菌来说,温度基本上都为37℃,在此温度下,酶的活性最大,有利于反应的进行。2)MTT法用于口腔细菌变异链球菌、血链球菌、伴放线菌嗜血菌测定时的最佳比色波长分别为为510、545、557 nm,不同于动物细胞活细胞检测所采用的波长(490、570、630 nm),以及植物青枯病高效生防菌株PBW1采用的波长(525 nm)。这可能与MTT反应后生成的甲臜颗粒沉积于细菌内或细菌周围、细菌的大小或其他因素影响有关。本研究采用在最适波长时测量A值,在同等条件下,其误差最小,结果更准确。3)口腔细菌活菌数测定中的反应时间为1.5 h,比动物细胞测定的4 h、PBW1测定的2 h均较少,而比大肠杆菌的反应时间20min多。这可能与各种细胞/细菌中所包含的琥珀酸脱氢酶的量、活性不同有关。4)MTT法测量口腔细菌活菌菌数,当变异链球菌活菌浓度在1.5×105~1.0×107CFU·mL-1,血链球菌活菌浓度在1.5×105~2.0×107CFU·mL-1;伴放线菌嗜血菌活菌浓度在1.0×106~5.0×107CFU·mL-1时,A值与活菌数呈良好的正相关,在此测定范围内完全可以满足一般的检测需要。5)在实验中,MTT的量必须足够,在菌液为1mL时,MTT量应该不小于0.15mL。这区别于动物细胞所需量即MTT使用说明上要求MTT量为0.1mL。6)MTT与琥珀酸脱氢酶反应后生成蓝紫色的难溶物,实验期间观察,随着时间的推移,甲臜逐渐沉淀,上清液变得透明,整个反应体系不均匀,与王栩等[13]的观察不一致,可能与他们是直接采用96孔板有关。此外,为了排除上清液的干扰,使结果更准确,本研究离心去除上清液,加入DMSO溶解后再测量其A值。
[1] 马绪荣,苏德模.药品微生物学检测手册[M].北京:科学出版社,2000:70-74.
MA Xu-rong,SU De-mo.Microbiological testing drugs handbook[M].Beijing:Science Press,2000:70-74.
[2] Mosmann T.Rapid colorimetric assay for cellular growth and survival:Application to proliferation and cytotoxicity assays[J]. J Immunol Methods,1983,65(1/2):55-63.
[3] Carmichael J,DeGraff WG,Gazdar AF,et al.Evaluation of a tetrazolium-based semiautomated colorimetric assay:Assessment of chemosensitivity testing[J].Cancer Res,1987,47(4):936-942.
[4] 李影林.中华医学检验全书(下卷)[M].2版.北京:人民卫生出版社,1997:2212.
LI Ying-lin.Medical examination(II)[M].2nd ed.Beijing:People′s Medical Publishing House,1997:2212.
[5] Freimoser FM,Jakob CA,Aebi M,et al.The MTT[3-(4,5-dimethylthiazol-2-yl)-2,5-diphenyltetrazolium bromide]assay is a fast and reliable method for colorimetric determination of fungal cell densities[J].Appl Environ Microbiol,1999,65(8):3727-3729.
[6] 司徒镇强.细胞培养[M].北京:世界图书出版社,1996:186-187.
SITU Zhen-qiang.Cell culture[M].Beijing:World Publishing Corporation,1996:186-187.
[7] 薛彬,Edeman A,Thorbecke GJ.介绍一种用颜色显示法测细胞的生长与增殖[J].北京医科大学学报,1987,19(2):125-127.
XUE Bin,Edeman A,Thorbecke GJ.Introducing a method by color to detect the living and the proliferation of cell[J].J Peking University,1987,19(2):125-127.
[8] Arseculeratne SN,Atapattu DN.The assessment of the viability of the endospores of Rhinosporidium seeberi with MTT(3-[4,5-dimethyl-2-thiazolyl]-2,5-diphenyl-2H-tetrazolium bromide)[J]. Mycol Res,2004,108(Pt12):1423-1430.
[9] Cetin Y,Bullerman LB.Cytotoxicity of Fusarium mycotoxins to mammalian cell cultures as determined by the MTT bioassay[J]. Food Chem Toxicol,2005,43(5):755-764.
[10]林忠宁,董胜璋,董书芸,等.MTT法检测T淋巴细胞增殖功能的方法学探讨与应用[J].中国卫生检验杂志,2002,10(1):8-10.
LIN Zhong-ning,DONG Sheng-zhang,DONG Shu-yun,et al. Approaching of the methodology and application of the T lymphocyte proliferation by MTT[J].Chin J Health Laboratory Technology,2002,10(1):8-10.
[11]钱江潮,魏东芝,陈笑岚,等.MTT法测定人表皮癌细胞的抗药性[J].华东理工大学学报,2000,26(1):103-106.
QIAN Jiang-chao,WEI Dong-zhi,CHEN Xiao-lan,et al.Determination of multidrug resistance of human KB carcinoma cells by MTT colorimetric assay[J].J East China University Science Technology,2000,26(1):103-106.
[12] 魏鸿刚,李元广,刘建,等.一种快速的活菌计数新方法研究[J].微生物学通报,2002,29(2):89-93.
WEI Hong-gang,LI Yuan-guang,LIU Jian,et al.Studies on a new method for counting living bacterial cell number[J].Microbiology,2002,29(2):89-93.
[13]王栩,邬于川,夏世平,等.MTT法进行活菌计数的方法学探讨[J].泸州医学院学报,2002,25(4):291-292.
WANG Xu,WU Yu-chuan,XIA Shi-ping,et al.Inquiring into the method of counting live germ with MTT[J].J Luzhou Medical College,2002,25(4):291-292.
(本文编辑 王晴)
Study on the counting of Streptococcus mutans,Streptococcus sanguis,Haemophilus actinomycetemcomitans by methyl thiazolyl tetrazolium colorimetric method
WANG Zhong-chao1,FAN Li-yuan2,JIANG Jun-qiang1,CAIWei1,DING Yi3.(1.Dept.of Endodontics,Stomatological Hospital of Luzhou Medical College,Luzhou646000,China;2.Dept.of Prosthodontics,Stomatological Hospital of Luzhou Medical College,Luzhou646000,China;3.Dept.of Periodontology,West China College of Stomatology,Sichuan University,Chengdu610041,China)
ObjectiveTo explore the feasibility of methyl thiazolyl tetrazolium(MTT)colorimetric method and the applied condition for the normal bacteria in the mouth,asStreptococcus mutans(S.mutans),Streptococcus sanguis(S. sanguis),Haemophilus actinomycetemcomitans(H.actinomycetemcomitans).MethodsColony forming units(CFU)which was the standard antitheses was used to count bacteria.This study would gain some parameters by changing wavelength,reactive time,dosage and so on.MTT colorimetric method was applied in the counting ofS.mutans,S. sanguisandH.actinomycetemcomitans.Results When countingS.mutans,the best wavelength was 510 nm,the best range was 1.5×105~1.0×107CFU·mL-1.When countingS.sanguis,the best wavelength was 545 nm,the best range was 1.5×105~2.0×107CFU·mL-1.When countingH.actinomycetemcomitans,the best wavelength was 557 nm,the best range was 1.0×106~5.0×107CFU·mL-1.MTT colorimetric method can be used for different agedS.mutans,S.sanguisandH.actinomycetemcomitans.ConclusionOral bacteria could be counted by MTT colorimetric method,which is fast and convenient.
methyl thiazolyl tetrazolium colorimetric method;Streptococcus mutans;Streptococcus sanguis;Haemophilus actinomycetemcomitans; bacterial cell counting
R 780.2
A
10.3969/j.issn.1000-1182.2010.03.020
1000-1182(2010)03-0306-05
2009-12-11;
2010-04-06
王忠朝(1980—),男,四川人,住院医师,硕士
丁一,Tel:028-61153007

