仙台病毒Tianjin株及其HN/F基因真核表达质粒对人副流感病毒Ⅰ型的血清中和实验研究
谌志筠,王 芳,李晓眠
(天津医科大学微生物学教研室,天津 300070)
人副流感病毒(human parainfluenza virus,hPIV)根据遗传学和血清学可分为4型,是儿童急性呼吸道感染(acute respiratory infection,ARI)的重要病原之一。全球每年都有不同亚型的hPIV交替流行[1-2],其中Ⅰ型是引起婴幼儿严重哮吼的主要病原,Ⅲ型引起的下呼吸道感染的发病率仅次于呼吸道合胞病毒(RSV)[3-5]。近年来国内也有相当数量的报道显示hPIV是我国各个地区婴幼儿严重呼吸道感染的重要病因[6-7]。因此尽快找到防治hPIV的方法显得十分重要。仙台病毒Tianjin株(Sendai virus,strain Tianjin,SeV)是1999年从天津医科大学动物实验中心爆发急性上呼吸道感染的普通棉耳狨猴肺脏中分离出来的毒株,经鉴定属于副粘病毒科、副粘病毒亚科、呼吸道病毒属,与仙台病毒亲缘关系最近,不属于仙台病毒现有的3个进化分支而自成独立的一支[8-9]。仙台病毒与人副流感病毒I型同属副流感病毒I型,二者间有十分密切的抗原关系[10]。研究发现仙台病毒减毒活疫苗能保护非洲绿猴免受hPIV-1的攻击,而hPIV-1亦能保护幼鼠免受仙台病毒的攻击,这种亲异特性模拟了仙台病毒抗原成分保护婴幼儿免受hPIV-1感染的可能性[11-12]。因此,本文通过仙台病毒Tianjin株多克隆抗体及其HN基因、F基因真核表达质粒免疫血清抗体与hPIV-1的血清中和实验,对开发新的hPIV-1异源性疫苗的可行性进行了初步探讨。
1 材料与方法
1.1 材料 Vero细胞、仙台病毒Tianjin株(本教研室保存);人副流感病毒I型(中国CDC病毒病预防控制所);真核表达质粒pVAX1(Invitrogen);感受态大肠杆菌DH5α(宝生物),病毒RNA提取试剂盒(QIAGEN),逆转录酶(Invitrogen),限制性内切酶HindⅢ/EcoRI(Promega),DNA连接酶、DNA凝胶回收试剂盒(宝生物),寡核苷酸引物(北京奥科公司);RPMI-1640(GIBCO);胎牛血清(GIBCO);0.25%胰酶(Hyclone);1%鸡血红细胞悬液(本实验室自制);鸡胚(天津市羽丰种鸡场);3周龄昆明鼠(中国医学科学院核医学研究所);辣根过氧化物酶标记的羊抗鼠-Ig(Sigma),牛血清白蛋白(GIBCO)。
1.2 方法
1.2.1 病毒接种与培养 选取9日龄健康鸡胚尿囊腔接种SeV,0.3ml/胚,37℃培养48h后收集尿囊液,置于-70℃保存备用。待Vero细胞长成致密单层后用PBS润洗3次,接种hPIV-1,病毒液接种量0.5ml/瓶,37℃吸附1h后,弃去多余病毒液,换维持液(RPMI-1640+2%FBS),置于37℃培养72h收获病毒。
1.2.2 仙台病毒Tianjin株多克隆抗体的制备 实验前分别测定SeV和hPIV-1的半数组织培养感染量(median tissue culture infective dose,TCID50)。将SeV稀释成100TCID50/0.1ml免疫小鼠5只,50μl/只,尾部、腹股沟、腋下、背部皮下等多点注射,每间隔
1周免疫1次,共免疫3次。3d后取血分离血清,置于-70℃保存备用。
1.2.3 免疫血清抗体效价测定 SeV抗原(抗原最适工作浓度由棋盘滴定法滴定)包被酶标板,2%BSA封闭后加待检血清,37℃温育1h,洗板5次,加入酶标抗体再次37℃温育1h,洗板后加底物显色,SDS终止反应后测定OD值。
1.2.4 中和实验 将 hPIV-1稀释至100TCID50/ 0.1ml,分别与倍比稀释的免疫血清等量混合,37℃水浴作用1h后,按血清稀释度依次接种至已长成致密单层Vero细胞的96孔板中,每稀释度接种4个复孔,37℃吸附1h后换维持液,继续37℃培养,逐日观察CPE,根据结果计算50%血清中和终点。
1.2.5 仙台病毒Tianjin株HN基因、F基因真核表达质粒的构建[13](1)按试剂盒说明书提取病毒RNA。(2)RT-PCR反应合成HN基因和F基因片段及回收:引物设计:HN基因上游引物:5′-CCCAAGCTTATGGATGGCGATAAACGT-3′(HindⅢ),下游引物5′-CGGAATTCTTATGACTCGACCTTGCA-3′(EcoRI),F基因上游引物:5′-CCCAAGCTTATGGCGACCTATACTTTAAG-3′(HindⅢ),下游引物5′-CGGAATTCTCATCTTTTCTCAGTCAT-3′(EcoRI)。PCR反应条件:94℃预变性4min;94℃1min,56℃30s,72℃2min,30个循环;72℃延伸10min。经1%琼脂糖凝胶电泳鉴定结果,回收目的片段。(3)质粒构建:将目的片段及真核表达载体pVAX1经HindⅢ和EcoRI内切酶作用后回收连接,将连接产物转化入大肠杆菌DH5α感受态细胞,小量提取质粒后经双酶切鉴定并测序,目的片段与预期相符,证明真核表达质粒构建成功。(4)大量提取质粒,紫外可见分光光度计测定质粒OD值,调整质粒浓度为1mg/ml。1.2.6真核表达质粒pVAX1-F、pVAX1-HN抗体的制备及中和作用 将浓度为1mg/ml的真核表达质粒免疫小鼠,分pVAX1-F组、pVAX1-HN组、pVAX1-F+pVAX1-HN组、空质粒组和空白对照组,每组5只,50μg/只,右后肢肌肉注射,共免疫4次,每次间隔1周;取免疫血清倍比稀释后与100TCID50/0.1ml的hPIV-1进行中和实验,计算50%血清中和终点。
2 结果
2.1 SeV多克隆抗体中和实验结果 5份SeV免疫血清的血清抗体效价在1:3200~1:5000之间;50%中和终点分别为39.8、12.6、16.0、44.7、25.1,表1为 SeV多抗和hPIV-1的中和实验结果。

表1 SeV多克隆抗体对hPIV-1的中和实验结果
按R-M公式计算,1∶12.6的血清稀释度能保护50%的细胞不产生病变,病变效果见图1。

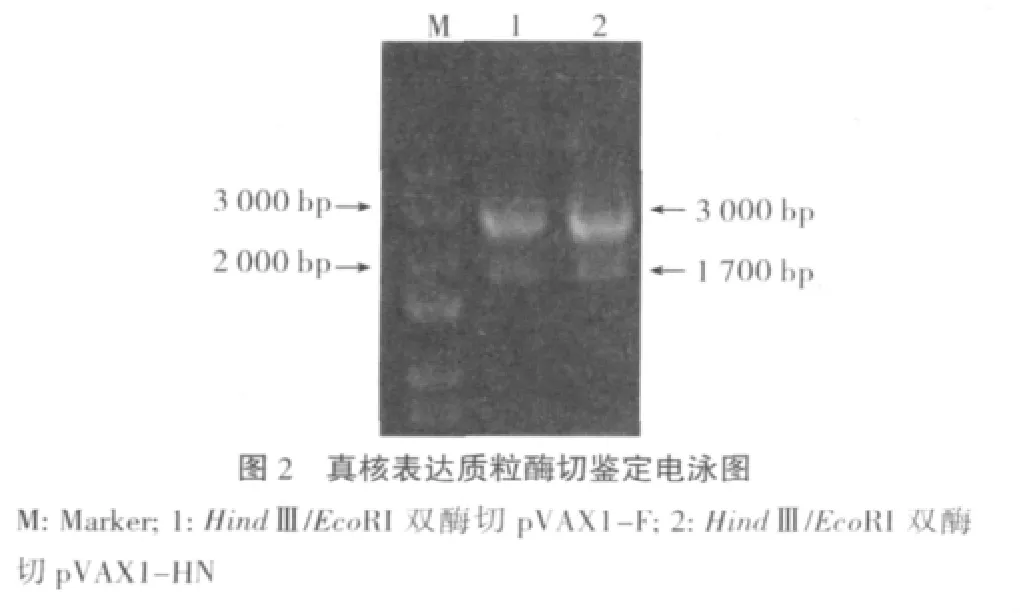
2.2 真核表达质粒鉴定结果 经HindⅢ/EcoRI双酶切鉴定,目的片段大小与预期一致(约1700bp)(图2)。测序结果表明构建的质粒与参考序列一致,证明质粒构建成功。
2.3 各分组质粒抗体中和实验结果 数据结果显示pVAX1-HN质粒和pVAX1-F质粒单独或联合免疫血清抗体的中和作用和空白对照组相比差异有统计学意义(P<0.01),说明 pVAX1-HN质粒和pVAX1-F质粒对 hPIV-1有中和作用,并按pVAX1-HN+pVAX1-F组>pVAX1-HN组>pVAX1-F组依次递减。空质粒组对hPIV-1没有产生中和作用(表2)。
表2 质粒免疫血清抗体中和实验结果(±s)

表2 质粒免疫血清抗体中和实验结果(±s)
n=5,*P<0.01
组别pVAX1-HN pVAX1-F pVAX1-HN+pVAX1-F pVAX1Control 50%血清中和终点12.35±4.09* 3.19±1.83* 21.17±3.06* 00
3 讨论
因为机体对hPIV产生免疫保护的持续时间短,再感染常见,而婴幼儿抗体应答能力相对较弱,因此容易反复发生感染。目前hPIV灭活疫苗、减毒活疫苗、基因工程疫苗和亚单位疫苗均已研究成功,牛PIV3疫苗已证实对婴儿安全有效。上述疫苗由于接种后免疫力不完全,所以在人体尚未广泛应用[4]。
hPIV对成人所致感染较少,这也可能跟成人免疫力较完全及有过感染SeV的经历而在体内形成一定抗体有关[9]。本实验结果证实,仙台病毒Tianjin株免疫机体制备的血清抗体对hPIV-1有一定的中和作用,显示它们的抗原性相关,为仙台病毒Tianjin株也有可能成为制备hPIV-1疫苗的有效毒株提供了理论基础。
仙台病毒感染宿主细胞的第一步由两种包膜糖蛋白HN蛋白和F蛋白介导,其中HN蛋白具有受体识别活性、神经氨酸酶活性及促细胞融合作用3种主要的生物学功能,F蛋白具有细胞融合和溶血活性,两种糖蛋白在病毒吸附细胞表面和侵入靶细胞的过程中起决定作用[14-15]。质粒分组实验结果显示,HN蛋白在阻止病毒入侵宿主细胞的首要环节中起主要作用,F蛋白对其具有辅助作用,因此两种质粒联合免疫血清抗体对hPIV-1的中和效果最好。核酸疫苗由于具有免疫保护力增强、制备简单、同种异株交叉保护、应用较安全、产生持久免疫应答、稳定性好等多种优点[16],是疫苗研究的一个热点和重点。本实验结果同时也为仙台病毒制备hPIV-1核酸疫苗的可行性提供了理论依据。
美国St.Jude儿童研究医院用仙台病毒减毒活疫苗在成人的Ⅰ期临床试验结果证实SeV可诱导成人产生抗hPIV-1抗体[17]。由于受到天然宿主范围的限制,仙台病毒可作为hPIV-1较为安全的候选异源性疫苗[18]。而由于狨猴与人类的亲缘性很近,所以在人体免疫应答方面仙台病毒Tianjin株相较其他仙台病毒株可能更具优势。这对hPIV-1异源性疫苗的开发研制拓宽了思路和方向。
[1] Laurichesse H,Dedman D,Watson JM,et al.Epidemiological features of parainfluenza virus infections:laboratory surveillance in EnglandandWales,1975-1997[J].EurJEpidemiol,1999,15(5):475
[2] Counihan ME,Shay DK,Holman RC,et al.Human parainfluenza virus-associated hospitalizations among children less than five years of age in the united states[J].Pediatr Infect Dis,2001,20(7):646
[3] Henrickson KJ.Parainfluenza viruses[J].Clin Microbiol Rev,2003, 16(2):242
[4] 黄志英,董琳.人副流感病毒的病原学、流行病学及所致疾病的特点[J].国际呼吸杂志,2006,6(9):687
[5] 李莉,米荣,徐放生,等.新生儿和小婴儿Ⅲ型副流感病毒肺炎55例[J].实用儿科临床杂志,2008,23(4):287
[6] 赵林清,钱渊,王芳,等.北京地区急性呼吸道感染婴幼儿中人副流感病毒感染状况的研究[J].中华儿科杂志,2007,45(2):91
[7] 张学兰,季正华,丁云芳,等.苏州地区急性呼吸道感染儿童中副流感病毒的研究[J].江苏医药,2008,34(4):345
[8] 石建党,李晓眠,刘凤勇,等.一株引起普通棉耳狨猴死亡病毒的分离与鉴定[J].中国病毒学,2003,18(4):357
[9] 李梅,石建党,石立莹,等.一株致普通棉耳狨猴严重下呼吸道感染的副粘病毒种系进化分析 [J].中华微生物学和免疫学杂志,2007,27(7):603
[10]杜淑娟,程树军,袁美凤.副流感病毒小鼠动物模型的建立及病理学研究[J].中国比较医学杂志,2006,16(7):387
[11]Hurwitz JL,Soike KF,Sangster MY,et al.Intranasal Sendai virus vaccine protects African green monkeys from infection with human parainfluenza virus-type one[J].Vaccine,1997,15(5):533
[12]Sangster M,Smith FS,Coleclough C,et al.Human parainfluenza virus type 1immunization of infant mice protects from subsequent Sendai virus infection[J].Virology,1995,212(1):13
[13]张园,李晓眠,王华.仙台病毒HN基因核酸疫苗的构建及表达[J].山东医药,2008,48(37):72
[14]Bousse T,Takimoto T.Mutation at residue 523creates a second receptor binding site on human parainfluenza virus type 1hemagglutinin-neuraminidase protein[J].J Virol,2006,80(18):9009
[15]Rawling J,García-Barreno B,Melero JA.Insertion of the two cleavage sites of the respiratory syncytial virus fusion protein in Sendai virus fusion protein leads to enhanced cell-cell fusion and a decreased dependency on the HN attachment protein for activity[J].J Virol,2008,82(12):5986
[16]郑鸣.DNA疫苗的研究进展 [J].郑州牧业工程高等专科学校学报,2009,29(2):15
[17]Slobod KS,Shenep JL,Lujan-Zilbermann J,et al.Safety and immunogenicity of intranasal murine parainfluenza virus type 1(Sendai virus)in healthy human adults[J].Vaccine,2004,22(23/ 24):3182
[18]Bousse T,Chambers RL,Scroggs RA,et al.Human parainfluenza virus type 1but not Sendai virus replicates in human respiratory cells despite IFN treatment[J].Virus Res,2006,121(1):23

