川芎嗪大鼠肝脏/肾脏缺血再灌注损伤中P-选择素表达的影响
孙 磊,朱永康
(1.南京中医药大学,江苏南京,210009;2.江苏省中医院普外科,江苏南京,210009)
临床工作中肝脏、肾脏缺血再灌注损伤常见,是1个多因素的病理过程,目前尚无有效方法防治。其再灌注后引起活性氧的大量产生,巨噬细胞、淋巴细胞和中性粒细胞的活化释放大量炎症介质,如 NF-κB、TNF-α、白介素-1(IL-1)、细胞间黏附分子-1(ICAM-1)、P和L选择素,继而导致炎症和细胞死亡[1]。抗P-选择素单克隆抗体可以减轻肝、肾缺血再灌注损伤程度。川芎嗪,是中国1种传统的中草药成份,常用于治疗脑和心脏缺血再灌注损伤性疾病。在实验研究中发现它可以抑制中性粒细胞的呼吸爆发,减少自由基生成。本研究观察川芎嗪对大鼠肝脏缺血再灌注损伤中P-选择素表达的影响。
1 材料和方法
1.1 模型制备和分组
建立大鼠肝脏和肾脏缺血再灌注模型,参照Ohmori等[2]建立70%的大鼠肝脏和肾脏缺血再灌注模型,90只雄性W ister大鼠,体重(200±10)g,实验前动物禁食12 h,自由饮水,清洁手术,直视下进行,并控制室内温度18~25℃。
90只雄性W ister大鼠,随机分为 2组。以2.5%戊巴比妥钠腹腔注射麻醉。肝脏组:①假手术组5只:不阻断肝动脉、门静脉左叶支;②缺血再灌注组20只:游离阻断肝动脉、门静脉左叶支并以血管夹阻断60min后松开再灌注,再灌注前5min经静脉给生理盐水。按再灌注后 1、3、6、24 h取材分为4个亚组;③川芎嗪处理组:再灌注前5min经静脉给川芎嗪,余同缺血再灌注组。肾脏缺血再灌注组:①假手术组5只,不阻断肾动脉;②肾脏组:游离阻断左肾动脉60 min后松开再灌注同时切除右肾,再灌注前5 min经静脉给生理盐水,按再灌注后 1、3、6、24 h取材分为4个亚组;③川芎嗪处理组:再灌注前5m in经静脉给川芎嗪,余同缺血再灌注组。迅速取出相同部位肝组织标本,一部分置液氮中保存,送-70℃冰箱保存备用;另一部分组织置于10%中性福尔马林溶液固定16~18 h后,石蜡包埋。
1.2 取材和检测
各组再灌注末取血和肝或肾组织保存以备检测。血清ALT、AST、BUN和CR值以全自动生化分析仪测定。肝或肾组织以10%甲醛固定后常规石蜡包埋,切片做H-E染色行组织病理观察,以免疫组织化学染色观察肝、肾组织P-选择素表达。M PO活性测定,采用Zingarelli等[7]的方法,以比活性(吸光度变化率/蛋白量)表示。NF-κB p65活性测定采用Western blot检测NF-κB亚单位p65蛋白含量。
2 结 果
2.1 组织病理学变化
肝脏组:肝脏缺血再灌注损伤组再灌注1 h后,大体观察可见肝左叶明显肿胀,颜色暗黑。光镜下间质充血明显并有大量炎细胞浸润。而川芎嗪治疗组中肝脏大体和光镜下变化小,与正常肝组织相似(如图1~3)。

图1 正常肝脏组织 ×20

图2 再灌注损伤组肝脏组织 ×20
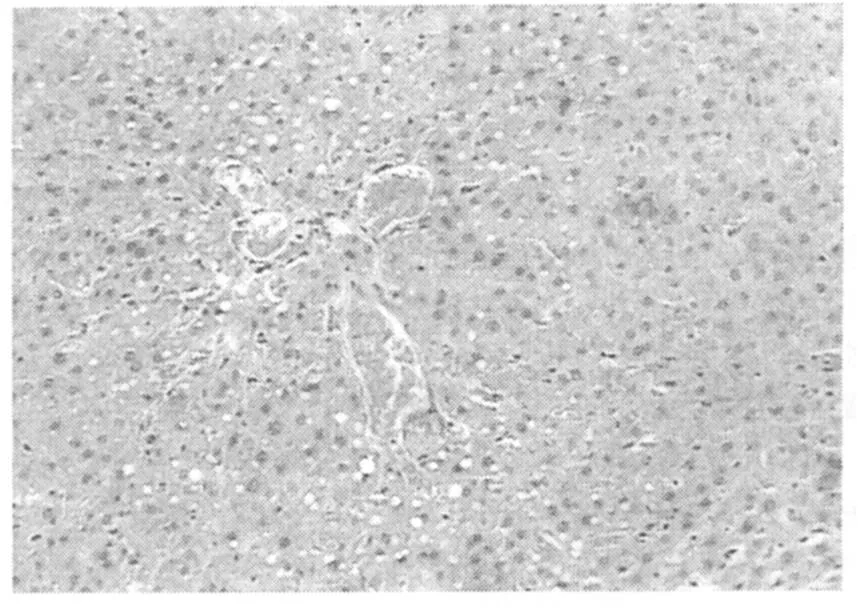
图3 川芎嗪治疗组肝脏组织 ×20
肾脏组:肾脏缺血再灌注损伤组再灌注1 h后,大体观察肾皮质苍白,肾髓质淤血明显。光镜下可见大小不等范围的肾小管上皮细胞变性坏死,间质充血并有大量炎症细胞浸润。而在川芎嗪治疗组,缺血再灌注后肾脏大体和光镜下变化小,与正常肾组织相似。
2.2 肝脏、肾脏功能检测
肝脏组:再灌注2 h后,缺血再灌注组血清ALT值为(628±91)μ/L,AST值为(1 608±199)μ/L,与假手术组[ALT:(52±11)μ/L,AST:(80±17)μ/L]相比明显升高(P<0.01);在川芎嗪治疗组ALT值为(190±21)μ/L、AST值为(386±62)μ/L与缺血再灌注组相比明显降低(P<0.01)。
肾脏组:再灌注24 h后,川芎嗪治疗组组血清BUN值为(14.54±0.67)mmol/L,Cr值为(102.2±4.67)mmol/L与假手术组[(7.88±0.57)mmol/L,(39.00±4.47)mmol/L]相比明显升高(P<0.01),而与缺血再灌注组[(11.21±0.56)mmol/L,(70.61±4.95)mmol/L]相比明显降低(P<0.01)。
2.3 肝、肾组织中P-选择素表达情况检测
缺血再灌注组中,再灌注后1 h,肝脏和肾脏组织中有P-选择素广泛表达分布于肝左叶和左肾小血管内皮细胞。在肝细胞膜,肾毛细血管绊以及间质中也可发现有P-选择素的表达。而在川芎嗪治疗组中,肝、肾组织中P-选择素表达不明显。
2.4 肝血清酶学及缺血肝组织中MPO含量变化
肝脏组:再灌注24 h后,缺血再灌注组血清MPO水平为(7.09±0.67)U/g,与假手术组(2.95±0.3)U/g相比明显升高(P<0.01);川芎嗪治疗组MPO水平为(4.56±0.49)U/g与缺血再灌注组相比明显降低(P<0.01)。
2.5 各组缺血肝组织中NF-κB P65蛋白表达比较
各组缺血肝组织中NF-κB p65蛋白表达见图4。肝组织内NF-κB p65蛋白表达缺血再灌注组和川芎嗪治疗组较假手术组均明显升高(P<0.01);川芎嗪治疗组NF-κB p65比缺血再灌注组明显降低(P<0.01)。
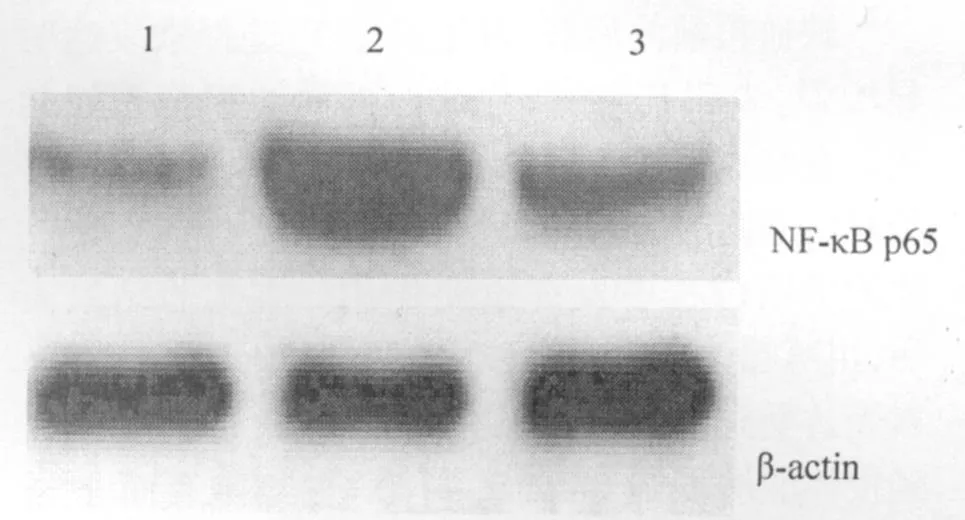
图4 肝组织中NF-κB p65蛋白表达1:假手术组;2:缺血再灌注组;3:川芎嗪治疗组
3 讨 论
目前认为缺血再灌注过程中粘附分子和白细胞发挥重要作用。缺血组织中大量白细胞,尤其中性粒细胞浸润聚积与之关系密切。中性粒细胞与血管内皮细胞之间的滚动主要有选择素家族介导,而它们之间的紧密粘附由免疫球蛋白家族如:ICAM-1、CD11/CD18等粘附分子介导。P-选择素是选择素家族中成员之一,正常情况下贮存于血管内皮细胞内的Weibel-Palade小体和血小板的α颗粒中,在肝脏缺血再灌注过程中,当细胞受刺激活化后P-选择素迅速分泌到血管内皮细胞、血小板表面,在再灌注早期对中性粒细胞的滚动、粘附起重要作用。另一方面P-选择素基因激活后,从转录水平使细胞表面表达P-选择素,而此过程发生较晚。因此,P-选择素在缺血再灌注过程中通过介导白细胞向组织内的滚动、粘附和浸润而发挥重要作用。运用抗P-选择素单克隆抗体可以减轻组织缺血再灌注损伤程度。川芎嗪是具有生物活性中草药成份,在动物实验和临床工作中发现它对心脏、肺和脑等组织的缺血性疾病有治疗作用。在对狗的实验中发现川芎嗪能够关闭钙通道,减少血小板的聚集等生活效应,抑制自由基的释放和动脉中血栓的形成。然而,它对消化系统缺血性疾病的作用还未见有报告。本实验通过建立大鼠肝脏、肾脏缺血再灌注损伤模型研究其对肝脏、肾脏缺血再灌注损伤的作用。
本实验结果显示,缺血再灌注组,血清中ALT 、AST 、BUN 和Cr值明显升高,肝 、肾组织损伤明显,而再灌注前5m in给予川芎嗪治疗后,血清中ALT、AST、BUN和Cr值与I/R组相比明显减低,病理学变化亦明显减轻,表明川芎嗪能够通过抑制白细胞和内皮细胞的相互作用而减轻肝脏、肾脏缺血再灌注损伤程度。
缺血再灌注后肝、肾组织中P-选择素表达明显增强,表明其与肝、肾缺血再灌注损伤密切相关。在缺血再灌注后的大鼠肝、肾组织中发现,感染时白细胞的滚动浸润延迟,表明P-选择素在炎症的早期过程中发挥重要作用。本实验结果表明,川芎嗪治疗后,再灌注未肝、肾组织中 P-选择素表达受到抑制。此结果也与抗P-选择素单克隆抗体能够下调sialyl Lew is X(白细胞表面P-选择素的受体)的结果相一致[2]。这些表明P-选择素在肝、肾缺血再灌注的早期阶段发挥重要作用,降低P-选择素的表达可以减轻肝、肾缺血再灌注损伤的程度。在对狗的实验中发现,川芎嗪能够减少血小板表面a-颗粒的数量并能够抑制血小板的活性和血栓的形成[3]。
肝脏再灌注后出现的另一个明显的改变是Kupffer细胞的激活,Kupffer细胞激活后释放多种炎症介质及细胞因子如 TNF-α、氧自由基、白介素-1和白介素-6等,其中最重要的是TNF-α。TNF-α能诱导和上调ICAM-1,由此促进血管内皮细胞对于白细胞的黏附;促进血管内皮细胞分泌血小板激活因子(PAF)等炎症介质激活白细胞,从而增强中性粒细胞对内皮细胞的黏附,加重肝窦内皮细胞的损伤并导致肝内微循环紊乱,以上这些因素的共同作用加重肝脏缺血再灌注的损伤[1,3-5]。
NF-κB是一种普遍存在于真核细胞中的转录因子,正常情况下,NF-κB与其抑制物 IκB结合,存在于静止期细胞的胞浆中;当诱导因子刺激后,IκB磷酸化降解,NF-κB激活进入细胞核与基因启动子结合,诱导靶基因转录,其调控的靶基因有细胞因子(如 TNF-α)、黏附分子(如ICAM-1)等炎症介质[6-7]。有研究发现,在肝脏缺血再灌注损伤中,NF-κB被激活,从而上调TNF-α、ICAM-1等炎症介质的表达[8]。另有研究显示,在心、肺、脑、肾、胃及小肠缺血再灌注损伤模型中,PPARγ激动剂可通过抑制 NF-κB活性 下调TNF-α和 ICAM-1等炎症介质减轻再灌注损伤[9-11]。
本实验结果显示,NF-κB再灌注后主要位于细胞核中,经川芎嗪处理后细胞核中的NF-κB的数量明显减少,同时受其调控的TNF-α和ICAM-1蛋白表达量亦相应降低。由此推测,川芎嗪是通过抑制NF-κB活性,减少TNF-α、ICAM-1等炎症介质的释放,从而减轻了再灌注引起的炎症反应。
本实验显示,川芎嗪治疗组血清ALT、AST水平较缺血再灌注组明显降低,这说明经过川芎嗪处理后,肝细胞损伤减轻,肝脏功能得到了有效改善。由于组织中中性粒细胞数目与组织中MPO的含量成正比,本实验中测定了肝脏组织MPO的含量代表肝脏组织中中性粒细胞的浸润程度。本实验表明,在缺血再灌注组中MPO的含量最高,而应用川芎嗪后组织中MPO的含量明显减少,说明川芎嗪有效的保护了肝窦内皮细胞,抑制了Kupffer的激活,使白细胞浸润减少,从而减轻了白细胞介导的肝细胞损伤。上述结果说明川芎嗪可减轻再灌注后肝细胞损伤。
[1] Len tsch A B,Kato A,Yoshidome H,et al.Inflammatory mechanisms and therapeutic strategies for warm hepatic ischem ia/reperfusion inju ry[J].Hepatology,2000,32:169.
[2] Ohmori M,M iyashita F,Uchida H,et al.Effect of erythromycin on ischem ia-reperfusion inju ry of liver in rats[J].T ransplant Proc,2000,32(4):811.
[3] Banga N R,Homer-Vanniasinkam S,Graham A,et al.Ischaem ic p recondi-tioning in transplantation and major resection of the liver[J].Br JSurg,2005May,92(5):528.
[4] Jaeschke H.Mechanism sof Liver Injury.II.M echanismsof neutrophil-induced liver cell injury during hepatic ischem iareperfusion and other acute inflammatory conditions[J].Am JPhysiol Gastrointest Liver Physiol,2006 Jun,290(6):G1083.
[5] Perkins N D.Integrating cell-signalling pathw ays with NF-kappaB and IKK function[J].Nat Rev M olCell Biol,2007,8(1):49.
[6] Grivennikov S I,Kuprash D V,Liu ZG,et al.Intracellular signals and eventsactivated by cytokinesof the tumor necrosis factor superfam ily:From sim ple paradigms to complex mechanisms[J].In t Rev Cytol,2006,252:129.
[7] MatsuiN,Kasajima K,HadaM,etal.Inhibiton of NF-kappaB activationduring ischem ia reduceshepatic ischem ia/reperfusion injury in rats[J].JToxicolSci,2005,30(2):103.
[8] Sato N,Kozar R A,Zou L,et al.Peroxisome proliferatoractivated receptorgamma mediates protection against cyclooxygenase-2-induced gut dysfunction in a rodent model of mesenteric ischemia reperfusion[J].Shock,2005 Nov,24(5):462.
[9] Kersten S,Desvergne B,Wah liW.Rolesof PPARs in health and disease[J].Nature,2000,405:421.
[10] Abdelrahman M,Sivarajah A,Thiemermann C.Beneficial effectsof PPAR-gamma ligands in ischemia-reperfusion injury,inflammation and shock[J].Cardiovasc Res,2005,65(4):772.
[11] Luedde T,Trautwein C.Intracellular survival pathways in the liver[J].Liver Int,2006,26(10):1163.

