单纯疱疹病毒I型糖蛋白D胞外区的真核表达及生物学活性分析
王正茂,李琳,管文燕,李越希,2
1 南京医科大学基础医学院生物化学与分子生物学系,南京 210029
2 南京军区军事医学研究所,南京 210002
单纯疱疹病毒 (Herpes simplex virus,HSV) 是一种双链DNA病毒,属疱疹病毒科α亚科,根据抗原性差别可分为I型和II型。I型主要引起口面部感染、眼部感染和疱疹性脑炎等;II型主要引起生殖器感染,并且和女性宫颈癌的发生密切相关[1]。HSV可在感染组织或附近部位繁殖形成原发灶,并在感觉神经节建立终身潜伏期,同时消除宿主的免疫应答,当受到外界刺激时又可重新繁殖并通过轴突运输返回原发感染灶附近形成复发感染[2]。这些因素导致人体一旦感染HSV,很难被有效清除。美国每年新发病人数达70万,复发的病人约有1 000万。在发展中国家,HSV II血清流行率高达41%~83%。近年来我国的HSV感染发病率迅速上升,其中HSV I的感染显著增多,约占该病的 10%~40%。尽管目前的抗病毒药物治疗能缩短原发感染的病程,但并不能有效预防原发感染、已经建立的潜伏感染及复发性疾病[3-4]。因此,研制和接种安全有效的 HSV疫苗是预防该病毒感染的理想方法[5]。目前较为普遍并且已经进入III期临床的亚单位疫苗是由Glaxo Smith Kline公司生产的gD2-硫酸铝钾-3dMPL疫苗,所用佐剂3-dMPL能够增强Th1应答,虽然可以明显减轻首次感染 HSV II的症状,但该结果仅限于HSV I和HSV II血清学反应阴性的女性中。Chiron公司研制的一种重组gD2/gB2糖蛋白与MF59佐剂配伍而成的疫苗增强了Th2应答,人类中可引起强烈的中和抗体,但是III期临床试验效果有限。
HSV包膜糖蛋白在病毒的感染过程中起重要作用,介导病毒与宿主细胞的结合及融合,其中gD糖蛋白能诱发中和抗体的产生及细胞免疫[6],具有重要的抗原表位,是宿主细胞免疫和体液免疫的主要靶标之一,是构建HSV疫苗的理想抗原。本研究将HSV1 gD 蛋白的胞外区片段在真核表达系的HEK293细胞中表达、纯化,对纯化的蛋白进行抗原性鉴定,免疫小鼠检测血清中抗gD1抗体效价以评价其免疫原性,为HSV基因重组亚单位疫苗的研发提供依据。
1 材料与方法
1.1 材料
大肠杆菌Escherichia coli DH5α、HEK293细胞及真核表达载体 pCEP4由本实验室保存。
PrimerSTAR HS DNA Polymerase、dNTPs、Hind III、BamH I、T4 DNA连接酶、质粒提取试剂盒、PCR产物纯化试剂盒、琼脂糖凝胶 DNA回收试剂盒为TaKaRa公司产品。Lipofectamine 2000为Invitrogen公司产品。DMEM培养基、胎牛血清为Gibco公司产品。Ni Sepharose 6 Fast Flow凝胶为GE Heathcare公司产品。羊抗HSV1+HSV2多抗为Abcam公司产品。小鼠抗His单抗、羊抗小鼠IgG-HRP为金斯特公司产品。雄性昆明小鼠,6~8周龄,购自中国军事医学科学院实验动物中心。其他试剂为国产或进口分析纯试剂。
1.2 方法
1.2.1 抗原表位筛选及基因片段合成
利用 ANTHEWIN等软件,通过计算机分析GenBank中HSV病毒I型KOS株包膜糖蛋白D的胞外区氨基酸序列,筛选抗原表位富集区,选择真核和原核生物均偏爱的密码子,并且在 5′端添加人IgG轻链可变区信号肽序列、8×His标签及TEV酶切位点,用化学合成的方法合成全新的基因序列gD1。
1.2.2 pCEP4-gD1重组质粒的构建、克隆和鉴定
用质粒提取试剂盒分别提取含重组基因片段gD1的质粒和pCEP4质粒,两种质粒经Hind III和BamH I酶切后,电泳回收gD1基因片段和pCEP4质粒片段,T4 DNA连接酶于16℃连接过夜。连接产物转化感受态E. coli DH5α,以氨苄青霉素为筛选标记,菌落PCR鉴定筛选含重组质粒的克隆,提取重组质粒pCEP4-gD1进行PCR鉴定,酶切鉴定及DNA序列测定。
1.2.3 重组质粒的真核瞬时转染及表达鉴定
转染前1天以2×105/孔的密度接种HEK293细胞至24孔板,37℃、5% CO2温箱培养过夜,使其达到孔底面积 90%~95%时进行转染。用脂质体转染法对 HEK293细胞进行转染,详细方法见Lipofectamine 2000操作手册。37℃、5% CO2、DMEM培养基温箱培养48 h后,收集细胞上清进行SDS-PAGE电泳,NC膜湿转,100 V,1 h,室温封闭1 h (5% milk-PBST)。PBST洗膜3次,每次10 min,小鼠抗His单抗 (1 mg/mL) 1∶5 000稀释于封闭液中,室温孵育2 h,洗膜3次,每次10 min,羊抗小鼠IgG-HRP 1∶5 000稀释于封闭液中,室温孵育1 h,洗膜3次,每次10 min,加发光底物反应3 min,暗室中压片曝光。
1.2.4 重组糖蛋白的纯化、鉴定及浓度检测
上清溶液加已经平衡的Ni Sepharose 6 Fast Flow凝胶3 mL,混匀后4℃结合过夜,上样,收集穿透液。用10倍柱床体积的平衡液 (1× PBS,0.5 mol/L NaCl,20 mmol/L imidazole,pH 7.4) 洗涤柱子,洗脱亲和层析柱上未结合的杂蛋白,接着将1 mL洗脱液 (1× PBS,0.5 mol/L NaCl,500 mmol/L imidazole,pH 7.4)加入胶体中,静置20 min后洗脱,收集洗脱液,用透析液 (1× PBS,0.5 mol/L NaCl,pH 7.4) 透析过夜,即为纯化的目的蛋白,Western blotting检测,方法同前。BCA法检测纯化后总蛋白的浓度。
1.2.5 重组糖蛋白抗原性检测
用1× PBS (pH 7.4) 按1∶25~1∶800倍比稀释纯化的重组gD1糖蛋白,包被酶联板 (阴性对照取正常HEK293细胞上清),每孔100 μL,4℃过夜。次日用封闭液 (1× PBS,1%小牛血清) 封闭,每孔130 μL,室温2 h。将山羊抗HSV1+HSV2多抗,用样本稀释液 (1× PBS,0.1%小牛血清) 1∶500稀释后,分别加至封闭后的酶联板孔内,每孔100 μL,37℃孵育1 h,用PBST (1× PBS,0.5%吐温−20) 洗5遍后,加1∶40 000稀释的兔抗山羊IgG-HRP,每孔100 μL,37℃反应30 min,PBST洗5遍,加底物TMB溶液,每孔100 μL,37℃避光显色10 min,每孔加50 μL 1 mol/L盐酸终止反应,用酶联仪测定A450值。
1.2.6 免疫小鼠及gD1抗血清的制备
将小鼠随机分为3组,每组5只。将纯化的重组gD1糖蛋白与福氏佐剂等体积混合后分别于第1、3、5周 (第1周用完全福氏佐剂,第3、5周用不完全福氏佐剂) 腹腔注射免疫小鼠,高剂量组1.25 μg/只/次,低剂量组 0.5 μg/只/次,阴性对照组注射等体积PBS,并于第 3、5、7周眼眶采血。血液 37℃放置1 h后4℃过夜,2 000 r/min离心20 min,取上清,4℃、12 000 r/min离心20 min,取上清即得重组蛋白gD1抗血清。
1.2.7 重组蛋白gD1的免疫原性检测
用1× PBS按1∶100稀释纯化的重组gD1糖蛋白,包被酶联板,每孔100 μL,4℃过夜。次日用封闭液封闭酶联板,每孔130 μL,室温2 h。将制备的抗血清用样本稀释液按 1∶50、1∶500、1∶5 000稀释后,分别加至封闭后的酶联板孔内,每孔100 μL,37℃反应1 h,用PBST洗5遍后,加1∶10 000稀释的羊抗小鼠 IgG-HRP,每孔 100 μL,37℃反应30 min,PBST洗5遍,加底物TMB溶液每孔100 μL,37℃避光显色10 min,加50 μL 1 mol/L盐酸终止反应,用酶联仪测定A450值。
2 结果
2.1 目的基因片段的获得
通过ANTHEWIN等软件分析gD1糖蛋白胞外区氨基酸序列,发现N端的第1~284个氨基酸为抗原表位富集区,且亲水性较好,采用OptimumGene软件对对应的编码DNA序列进行以下方面优化:消除稀有密码子而采用最佳密码子、调整编码序列GC含量、最小化mRNA二级结构影响、消除CpG岛、避免重复序列和内部核糖体结合位点等影响,化学合成了全新的基因序列 gD1。同时分别在合成基因的两端添加了Hind III和BamH I酶切位点,在5′端酶切位点之后插入转录调控序列,起始密码子,人IgG 轻链可变区信号肽,8×His标签及TEV 蛋白酶酶切位点,在3′端酶切位点之前插入终止密码子,使该基因片段易于克隆至质粒pCEP4的Hind III和BamH I酶切位点之间,并且使重组蛋白更易于表达和纯化 (图1)。
2.2 重组质粒 pCEP4-gD1的构建、克隆及序列测定
将重组基因经酶切后克隆到真核表达载体pCEP4中 (图2),菌落PCR鉴定筛选含重组质粒的克隆,提取阳性克隆质粒进一步PCR鉴定,产物经1%琼脂糖凝胶电泳分析表明扩增的片段与预期大小一致,为981 bp (图3)。酶切产物经1%琼脂糖凝胶电泳分析表明酶切片段大小与预期相符 (图 4)。DNA序列测定进一步证实,重组质粒中含有合成的gD1基因片段,序列完全正确。
2.3 重组糖蛋白gD1的真核表达及纯化
重组质粒pCEP4-gD1转染至HEK293细胞48 h后,SDS-PAGE蛋白电泳检测蛋白浓度很低几乎看不见条带 (图5A)。Western blotting检测显示表达产物以可溶性形式存在于细胞上清中,分子量约46 kDa,与预期大小相符,而空质粒转染组无此条带 (图6A)。构建的重组质粒N端带有8个组氨酸标签,所以利用 Ni-NTA进行亲和层析纯化,吸附于Ni-NTA亲和柱的gD1在咪唑浓度为500 mmol/L时被洗脱,对透析液充分透析后,SDS-PAGE蛋白电泳 (图5B) 和Western blotting检测显示纯化后重组蛋白浓度明显大于纯化前 (图 6B)。BCA法检测总蛋白浓度约95 μg/mL。

图1 gD1重组基因片段构建示意图Fig. 1 Structure sketch of gD1 recombinant gene.
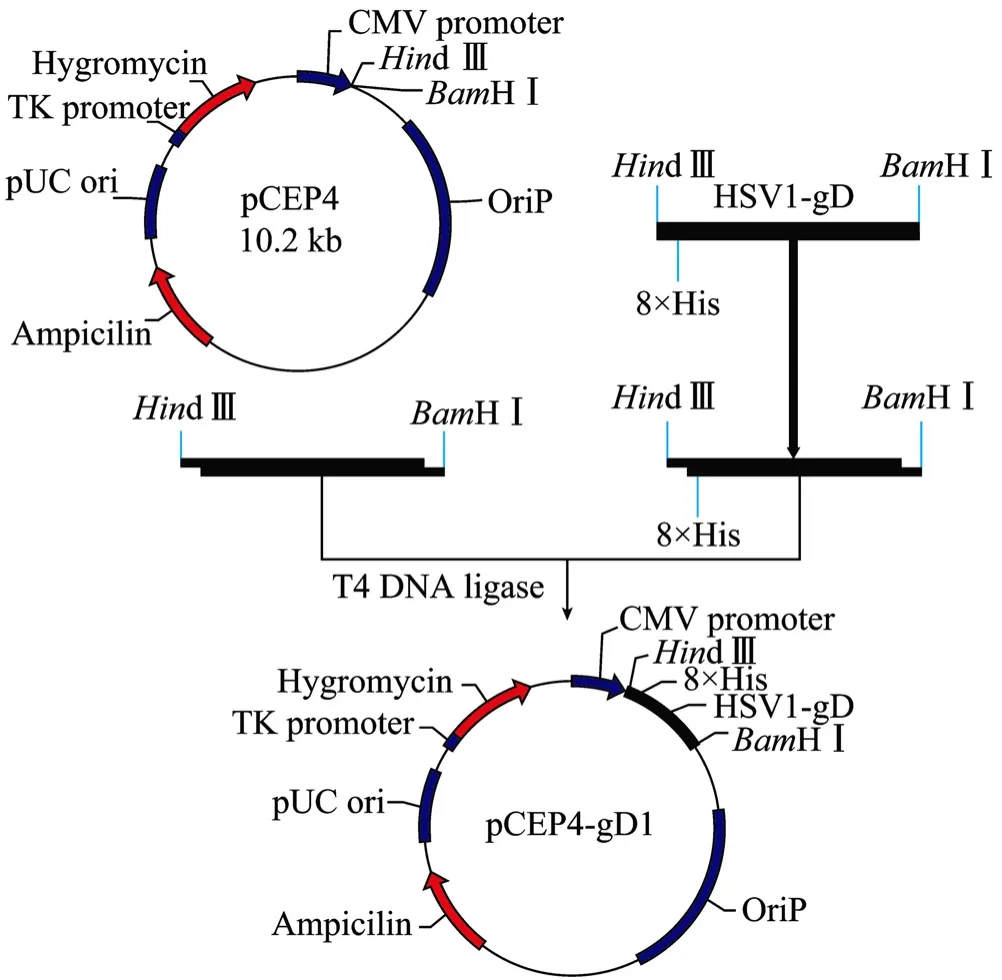
图2 重组质粒pCEP4-gD1构建流程Fig. 2 Construction of the recombinant plasmid pCEP4-gD1.

图3 重组基因片段gD1 PCR检测Fig. 3 Detection of the recombinant gene fragment gD1 by PCR amplification. 1: DL2000 marker; 2: gD1 DNA fragment amplified by PCR.

图4 重组质粒pCEP4-gD1的酶切鉴定Fig. 4 Identification of the recombinant plasmid pCEP4-gD1 by digestion with Hind III and BamH I. 1: pCEP4-gD1 digested with Hind III and BamH I; 2: pCEP4 digested with Hind III and BamH I; 3: 250 bp marker.
2.4 重组蛋白gD1的抗原性分析
为检验纯化得到的重组蛋白是否具有生物学活性,用 ELISA法检测了该重组蛋白与羊抗HSV1+HSV2多抗在体外的结合能力。结果表明gD1重组蛋白与羊抗HSV1+HSV2有较好抗原抗体反应(图7)。说明经真核修饰表达的gD1在纯化后保持其与特异性抗体结合的能力,具有良好的生物学活性。
2.5 重组蛋白gD1的免疫原性分析

图5 SDS-PAGE检测重组gD1蛋白Fig. 5 SDS-PAGE analysis of the purified gD1 protein. (A) Detection of non-purified fraction of gD1 by SDS-PAGE. M: protein marker; 1: supernatant of HEK293/pCEP4, negative control; 2: supernatant of HEK293/pCEP4-gD1. (B) Detection of purified fraction of gD1 by SDS-PAGE. M: protein marker; 1: purified fraction of gD1.
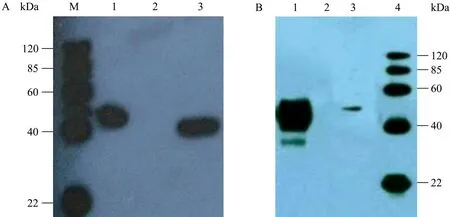
图6 Western blotting检测纯化前 (A) 和纯化后 (B) 的重组gD1蛋白Fig. 6 Western blotting analysis of the purified gD1 protein. (A) Detection of non-purified fraction of gD1 by Western blotting. M: protein marker; 1: supernatant of HEK293/pCEP4-gD1; 2: supernatant of HEK293/pCEP4, negative control; 3: 25 ng Multiple-tag, positive control. (B) Detection of purified fraction of gD1 by Western blotting. 1: purified fraction of gD1; 2: supernatant of HEK293/pCEP4, negative control; 3: 25 ng Multiple-tag, positive control; 4: protein marker.

图7 ELISA检测重组蛋白gD1抗原性Fig. 7 Detection of the antigenicity of the recombinant protein gD1 by ELISA.

图8 ELISA检测小鼠血清抗重组蛋白gD1抗体效价Fig. 8 Determination of the polyclonal antibody titer of the mouse serum by indirect ELISA. 1: serum of pre-immunization; 2: serum of 2nd-immunization; 3: serum of 3rd-immunization.
每次免疫后间隔1周小鼠眼底静脉丛取血,常规方法制备抗血清后,ELISA法检测血清中抗体滴度。结果显示低剂量免疫组免疫效果较差,3次免疫的血清中抗体水平无明显差异,1∶50稀释后A450最高值为0.168 (未在图中显示);高剂量组免疫效果较好,第2次免疫后血清中抗体水平最高,1∶5 000稀释后A450=1.104±0.384,第3次免疫后血清抗体水平稍有下降 (图8),PBS阴性对照组血清中基本无特性抗体产生,1∶50稀释后A450=0.004±0.001。高剂量组抗血清中抗体浓度与 OD值良好的线性关系说明制备的重组蛋白gD1能够刺激免疫系统产生较好的体液免疫效果,具有较好的免疫原性。
3 讨论
外源蛋白质表达系统按照表达载体的不同可分为原核表达系统和真核表达系统。原核表达的优点在于能够在较短时间内获得基因表达产物,产量高,且所需成本相对比较低廉,虽然原核表达技术已经十分成熟,但还存在一些难以克服的缺点,如目的蛋白常以包涵体形式表达,导致产物纯化困难;翻译后的加工修饰系统不完善使得表达的蛋白与天然蛋白的构象差距较大,生物学活性较低[7]。与原核表达系统相比,真核表达系统则在翻译后修饰方面有较大优势。目前基因工程中常用的的真核表达系统有:酵母表达系统、昆虫细胞表达系统、哺乳动物细胞表达系统及植物细胞表达系统。在这些表达系统中,哺乳动物系统在蛋白的起始信号、加工、分泌、糖基化方面具有独特优势,适合完整的大分子蛋白的表达。而外源基因在哺乳动物中的表达又可分为:病毒介导的表达;外源基因在哺乳动物中的瞬时表达;外源基因在哺乳动物中的稳定表达;转基因动物;核酸免疫等。通常在选择稳定序列表达之前先进行瞬时表达研究,以鉴定整个系统是否适合外源蛋白的表达,因此本研究采用在 HEK293细胞中做gD1蛋白的瞬时表达,以检测表达蛋白的生物学活性。该细胞株是目前应用最广泛的哺乳动物基因表达受体细胞之一。它适合多种蛋白质的分泌表达和胞内表达,已有多种外源基因如人组织性纤溶酶原激活剂、干扰素γ、干扰素β、凝血因子Ⅷ等在HEK293细胞中得到表达[8]。
HSV包膜糖蛋白中gD免疫原性及诱导保护性作用最强,能诱发特异性应答,HSV I上的免疫显性表位广泛分布在此蛋白质上,具有重要的抗原表位,是宿主细胞免疫和体液免疫的主要靶标之一[9],并参与病毒穿膜过程,介导了病毒的细胞间扩散,在病毒感染和宿主免疫过程中起着重要作用,因此gD糖蛋白是目前HSV疫苗研究的热点[10-11]。
有研究报道去除 gD蛋白分子部分胞浆区和跨膜结构域有助于蛋白转运到细胞外,更有利于MHC分子的递呈,产生较高水平的免疫应答,在体内外均能阻断HSV对细胞的感染,抑制病毒在细胞间的传播[12-13]。本实验选取去除了胞浆区及跨膜结构域的gD1基因胞外区序列,并将5′端天然信号肽序列替换为人IgG轻链可变区信号肽序列,这样的核酸序列修饰增强了gD1基因的体内免疫原性、稳定性和其他药理特性。在克隆至真核表达载体pCEP4并转染至HEK293细胞后,表达产物经Western blotting分析,所获得的重组gD1蛋白主要分子量条带约为46 kDa,糖基化均一,无其他杂带,经镍柱亲和层析后,取得较好的纯化效果,ELISA检测显示其能与HSV1+HSV2多抗特异性结合,具有较好的抗原性。纯化后的重组gD1蛋白免疫昆明小鼠后可诱发针对gD1的特异性体液免疫应答,具有确切的免疫原性。而高剂量组与低剂量组血清中抗体水平的差异指出了抗原浓度对于免疫效果的影响,为下一步抗原免疫浓度的制定提供了实验数据。本研究结果为HSV亚单位疫苗和HSV诊断抗原的进一步研究开发打下基础。
REFERENCES
[1] Levi M, Ruden U, Wahren B, et al. Peptide sequences of glycoprotein G-2 discriminate between herpes simplex virus type 2 (HSV2) and HSV1 antibodies. Clin Diagn Lab Immunol, 1996, 3(3): 265−269.
[2] Whitley RJ, Kimberlin DW, Roizman B. Herpes simplex viruses. Clin Infect Dis, 1998, 26(3): 541−555.
[3] Straus SE, Croen KD, Sawyer MH, et al. Acyclovir suppression of frequently recurring genital herpes: efficacy and diminishing need during successive years of treatment. JAMA, 1988, 260(15): 2227−2230.
[4] Kaplowitz LG, Baker D, Gelb L, et al. Prolonged continuous acyclovir treatment of normal adults with frequently recurring genital herpes simplex virus infection. The acyclovir study group. JAMA, 1991, 265(6): 747−751.
[5] Stanberry LR, Cunningham AL, Mindel A, et al. Prospects for control of herpes simplex virus disease through immunization. Clin Infect Dis, 2000, 30(3): 549−566.
[6] Whitley RJ, Roizman B. Herpes simplex viruses: is a vaccine tenable? J Clin Invest, 2002, 110(2): 145−151.
[7] Lilie H, Schwarz E, Rudolph R. Advances in refolding of proteins produced in E. coli. Curr Opin Biotechnol, 1998, 9(5): 497−501.
[8] Andersen DC, Krummen L. Recombinant protein expression for therapeutic applications. Curr Opin Biotechnol, 2002, 13(2): 117−123.
[9] Spear PG. Herpes simplex virus: receptors and ligands for cell entry. Cell Microbiol, 2004, 6(5): 401−410.
[10] Stanberry LR, Spruance SL, Cunningham AL, et al. Glycoprotein D adjuvant vaccine to prevent genital herpes. N Engl J Med, 2002, 347(21): 1652−1661.
[11] Bourne N, Bravo FJ, Francotte M, et al. Herpes simplex virus (HSV) type 2 glycoprotein D subunit vaccines and protection against genital HSV-1 or HSV-2 disease in guinea pigs. J Infect Dis, 2003, 187(4): 542−549.
[12] Nicola AV, Willis SH, Naidoo NN, et al. Structurefunction analysis of soluble forms of herpes simplex virus glycoprotein D. J Virol, 1996, 70(6): 3815−3822.
[13] Nicola AV, Peng C, Lou H, et al. Antigenic structure of soluble herpes simplex virus (HSV) glycoprotein D correlates with inhibition of HSV infection. J Virol, 1997, 71(4): 2940−2946.
- 生物工程学报的其它文章
- 科学出版社科学出版中心生命科学分社新书推介

