络必通颗粒对DPN大鼠神经电生理及Na+,K+-ATP酶活性的影响
马 丽, 胡晓灵
(新疆医科大学附属中医医院,新疆乌鲁木齐830000)
糖尿病周围神经病变(diabetic peripheral neuropathy DPN)是因糖尿病慢性高血糖状态及其所致各种病理生理改变而导致的神经系统损伤,可累及全身神经系统任何部分,是糖尿病最常见和最复杂的并发症,累及超过50%的糖尿病患者[1]可以出现DPN。DPN的发病机理主要涉及代谢障碍和血管障碍两方面。在临床上DPN的症状很难处理,目前尚缺乏有效的治疗方法,多数药物的临床效果还有待进一步证实,中医药在治疗慢性疾病中有确切的优势,研究临床疗效可靠的中药治疗DPN,具有非常重要的实际意义。
由于糖尿病的高血糖状态,脂蛋白易发生糖基化,糖化血红蛋白不易被血液清除而沉积于血管壁,促进动脉硬化形成。而且多元醇通路活性增高,使神经细胞高渗肿胀变形,周围神经出现髓鞘分离、脱失,并影响肌醇和牛磺酸代谢,减少 NO 合成,导致神经 Na+,K+-ATP 酶活性的降低[2],致细胞结构和功能损坏。本实验以血糖、糖化血红蛋白、神经电生理、Na+,k+-ATP酶等指标,验证络必通颗粒对DM大鼠周围神经病变的治疗作用。
材料与方法
1 材料
1.1 实验动物
Wistar大鼠,♀♂各半,体重(150±20)g,150只,由新疆医科大学动物实验中心提供,实验动物生产许可证:新医动字SLXK(新)2003-0001。♀♂大鼠分别分笼饲养,每笼饲养5只,室温(23±2)°C,相对湿度50% ~60%,通风良好,自由摄食、饮水。
1.2 实验药物
络必通颗粒,由新疆医科大学附属中医医院研制,批号(0504202224);糖脉康颗粒,中国中医研究院中汇制药公司生产,批号:(050802)。
1.3 主要试剂(略)、主要仪器(略)
2 方法
2.1 动物造模
2.1.1 2型糖尿病模型建立[3]
首先选择合格大鼠,♀♂各半,体重(150±20)g,模型组大鼠喂以高脂饲料(其中含70%碳水化合物、20%蔗糖,10%猪油)连续两个月,诱发出胰岛素抵抗;继以小剂量STZ 35 mg/kg(链脲佐菌素溶于0.1 mol/L,pH4.5的柠檬酸缓冲液,STZ配制为1%的溶液),于大鼠禁食14 h后腹腔注射;然后继续高糖高脂饲料喂养4周,用葡萄糖氧化酶法及放射免疫法测空腹血糖及胰岛素水平,并据公式求出胰岛素敏感指数(insulin sensitivity index ISI)。每周测定大鼠的体重、饮水量和进食量。空白对照组予以正常饮食并给予柠檬酸缓冲液平行进行实验。空白组和模型组动物分笼饲养,自由进食和饮水。
2.1.2 2型糖尿病周围神经病变模型建立
在上述模型基础上持续观察8周,用肌电图仪分别采用在体直接和间接的测定方法[4],测定动物坐骨神经传导速度及尾神经传导速度[5]。判定糖尿病周围神经病变模型的确立。
2.2 分组与给药
将模型鼠按随机数字表法随机分为5组,分别为模型组、阳性对照组(糖脉康组)、络必通治疗组(包括小、中、大剂量)。络必通颗粒为1.17,2.34,4.68 g/kg 3个剂量每日灌胃;阳性对照组予以糖脉康1.56g/kg灌胃;模型组、正常对照组均灌以相应容积的蒸馏水,每日1次,正常饮食,用药共计8周。
2.3 Na+,K+-ATP 酶活性的测定方法
用药8周后,取大鼠右侧坐骨神经,并准确称取坐骨神经的重量,按重量体积比加生理盐水制备成10%的组织匀浆,1 000~3 000 r/min,离心10 min,然后取组织匀浆上清再以生理盐水按1∶9稀释成1%组织匀浆,用于测定组织蛋白。
采用商品试剂盒,按照试剂说明在722分光光度计上进行测定。ATP酶可分解ATP生成ADP及无机磷,通过测定无机磷的量可判断ATP酶活性的大小。将每小时每毫克组织蛋白的ATP酶分解ATP产生1 μmol/L无机磷的量定义为一个ATP酶活性单位。计算公式如下:
组织中 Na+,K+-ATPase活力(U/mgprot)= [(测定管OD值-对照管OD值)/(标准管OD值-空白管OD值)]×标准管浓度(0.02 μmol/mL)×6×7.8÷匀浆蛋白浓度(mgprot/mL)
2.4 统计学处理
用SPSS13.0统计软件处理。各组实验数据以均数±标准差表示,并对变量进行方差齐性检验,方差齐性齐时,两组比较用两样本均数t检验,多组间比较用单因素方差分析。方差不齐时用非参数 t检验(Kolmo-gorov-Smirnov检验或Kruskal-Wallis检验)。检验水准定为α=0.05。
结 果
1 DPN模型(坐骨神经与尾神经肌电图结果)
两组动物在第20周测定坐骨神经运动神经传导速度和潜伏期及尾神经感觉神经传导速度和潜伏期,确定DPN动物模型成立,共计89例。结果显示:两种方法测出的坐骨神经MNCV均减慢,尾神经SNCV较正常组减慢,差异有统计学意义(P<0.05)。在体直接法潜伏期较正常组延长且差异有统计学意义(P<0.05)。而在体间接法所测MNCV潜伏期和尾神经较正常组虽延长,但差异无统计学意义(P>0.05)。依据神经传导速度判定DPN动物模型建立成功。(表1、2)。因方差齐,两组比较采用t检验。
表1 坐骨神经肌电图两组比较(±s)
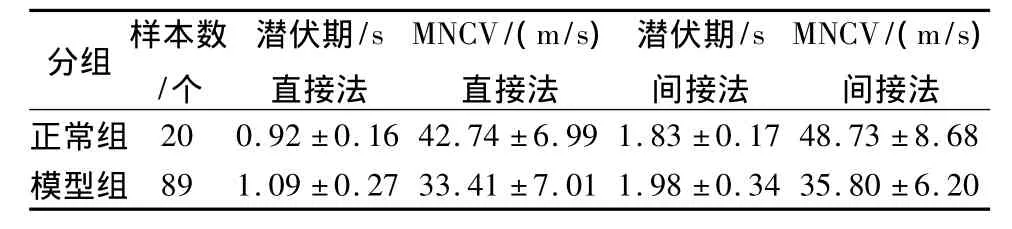
表1 坐骨神经肌电图两组比较(±s)
MNCV/(m/s间接法分组 样本数/个潜伏期/s直接法MNCV/(m/s)直接法潜伏期/s间接法正常组 20 0.92±0.16 42.74±6.99 1.83±0.17 48.73±8.68模型组 89 1.09±0.27 33.41±7.01 1.98±0.34 35.80±6.20
表2 尾神经肌电图两组比较(±s)

表2 尾神经肌电图两组比较(±s)
分组 样本数/个 潜伏期/s SNCV/(m/s)正常组20 2.53±0.45 48.99±5.16模型组89 2.72±0.50 44.00±7.07
2 络必通颗粒对DPN大鼠肌电图的影响
2.1 络必通颗粒对DPN大鼠坐骨神经肌电图的影响
造模20周,DPN大鼠模型成立共计89例,随机分配至5组,经药物治疗8周后,DPN大鼠死亡18只,正常对照组死亡2只。结果:DPN大鼠经药物治疗,各给药组大鼠运动神经传导速度较模型组有明显的加快,其中络必通大中剂量组提高更明显,优于阳性药物组,且差异有统计学意义(P<0.05),见表3。
表3 络必通颗粒对坐骨神经肌电图的影响(±s)
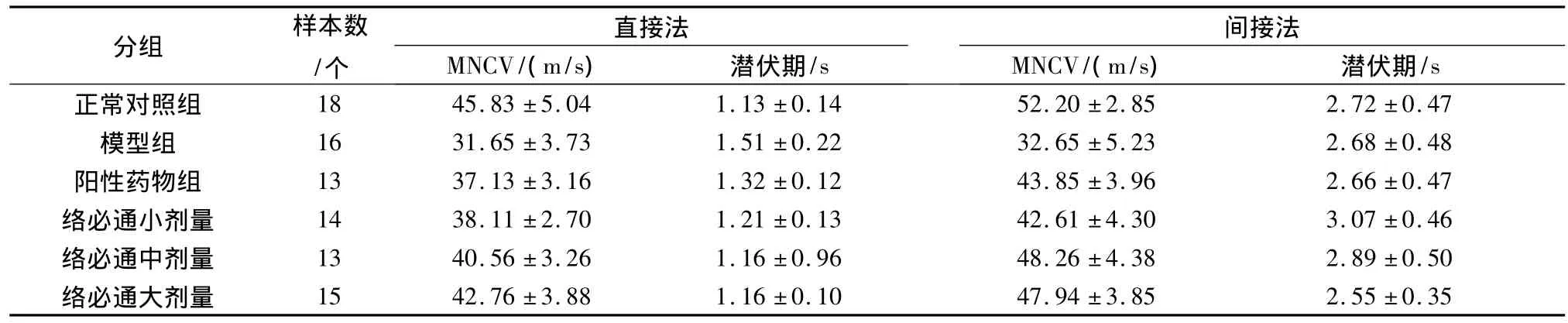
表3 络必通颗粒对坐骨神经肌电图的影响(±s)
分组 样本数/个/s正常对照组 18 45.83±5.04 1.13±0.14 52.20±2.85 2.72±0.47直接法MNCV/(m/s) 潜伏期/s间接法MNCV/(m/s) 潜伏期模型组 16 31.65±3.73 1.51±0.22 32.65±5.23 2.68±0.48阳性药物组 13 37.13±3.16 1.32±0.12 43.85±3.96 2.66±0.47络必通小剂量 14 38.11±2.70 1.21±0.13 42.61±4.30 3.07±0.46络必通中剂量 13 40.56±3.26 1.16±0.96 48.26±4.38 2.89±0.50络必通大剂量 15 42.76±3.88 1.16±0.10 47.94±3.85 2.55±0.35
2.2 络必通对DPN大鼠尾神经肌电图的影响
各给药组大鼠经治疗,SNCV均较模型组有所提高,其中络必通大剂量组与模型组比较差异有统计学意义(P<0.05),见表4。
表4 络必通对尾神经肌电图的影响(±s)
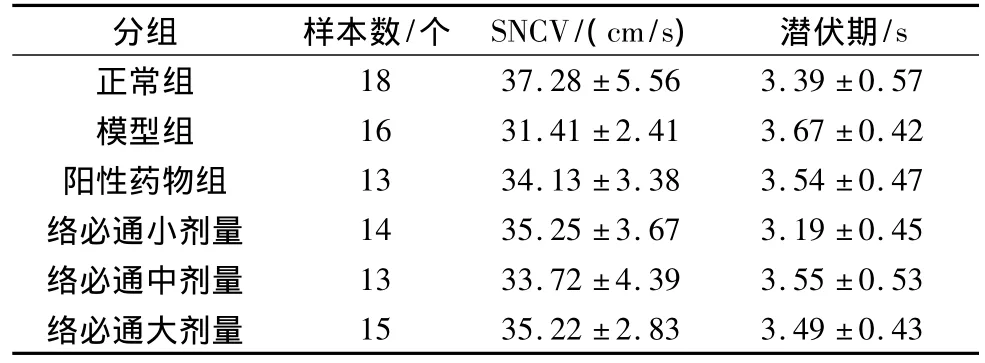
表4 络必通对尾神经肌电图的影响(±s)
18 37.28±5.56 3.39±0.57模型组 16 31.41±2.41 3.67±0.42阳性药物组 13 34.13±3.38 3.54±0.47络必通小剂量 14 35.25±3.67 3.19±0.45络必通中剂量 13 33.72±4.39 3.55±0.53络必通大剂量/s正常组分组 样本数/个 SNCV/(cm/s) 潜伏期15 35.22±2.83 3.49±0.43
3 络必通颗粒对DPN大鼠糖化血红蛋白及Na+,K+-ATP酶活性的影响
实验动物经肌电图检测时需腹腔注射氯胺酮20 mg/kg麻醉,肌电图检测结束后,死亡14只,最终样本数见表5,6。模型组大鼠HbA1C较正常组明显升高,差异有统计学意义(P<0.05);各治疗组均可降低HbA1C;络必通大剂量组与模型组比较差异有统计学意义(P<0.05)。模型组大鼠Na+,K+-ATP酶活性比正常组明显降低,差异有统计学意义(P<0.05);各治疗组均可延缓Na+,K+-ATP酶活性的降低,络必通中、大剂量,阳性药物与模型组比较差异有统计学意义(P<0.05)。(见表 5、6)
讨 论
1 络必通颗粒对血糖、糖化血红蛋白的影响
糖尿病时,糖化血红蛋白增多,其与氧的亲和力增加,而不易释放氧,造成局部组织细胞的长期缺氧,这是产生糖尿病神经病变的病理生理基础。此外,蛋白质的非酶糖化可涉及许多血浆和组织蛋白,导致蛋白变性,糖化蛋白的产生可引起神经髓鞘和组织结构的损伤改变,减弱神经组织的再生修复能力,髓鞘质糖化可引起神经髓鞘分离脱失,轴索微管蛋白糖化使其传导功能障碍,这些改变最终导致了糖尿病慢性并发症如DPN的发生。实验结果显示模型组大鼠血糖显著升高,糖化血红蛋白含量显著增加,应用络必通颗粒后,对DPN大鼠的糖化血红蛋白浓度有降低作用,与模型组比较有统计学差异,提示络必通颗粒可能通过降低血糖的途径,减少血糖与蛋白质之间的反应,抑制蛋白糖化后的各种病理反应,减少蛋白质的功能异常,达到治疗DPN的作用。积极控制血糖是治疗糖尿病及其并发症的一项基础措施。
表5 各组大鼠糖化血红蛋白比较(±s)
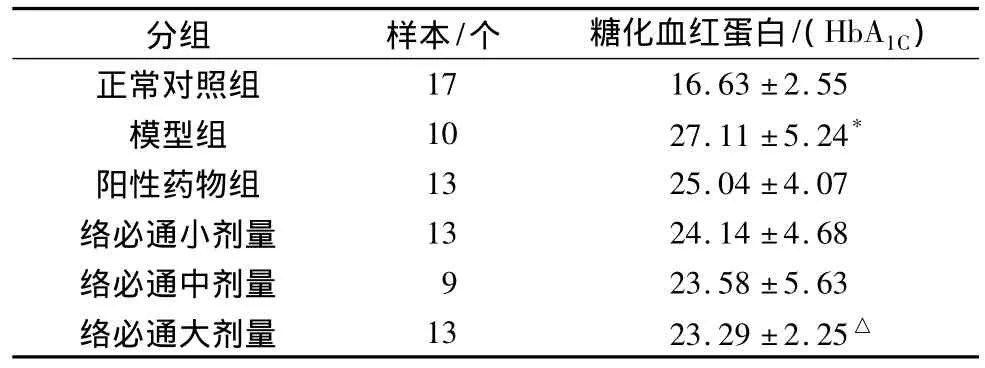
表5 各组大鼠糖化血红蛋白比较(±s)
分组 样本/个 糖化血红蛋白/(HbA1C )17 16.63±2.55模型组 10 27.11±5.24*阳性药物组 13 25.04±4.07络必通小剂量 13 24.14±4.68络必通中剂量 9 23.58±5.63络必通大剂量 13 23.29±2.25正常对照组△
表6 各组大鼠Na+,K+-ATP酶活性比较(±s)
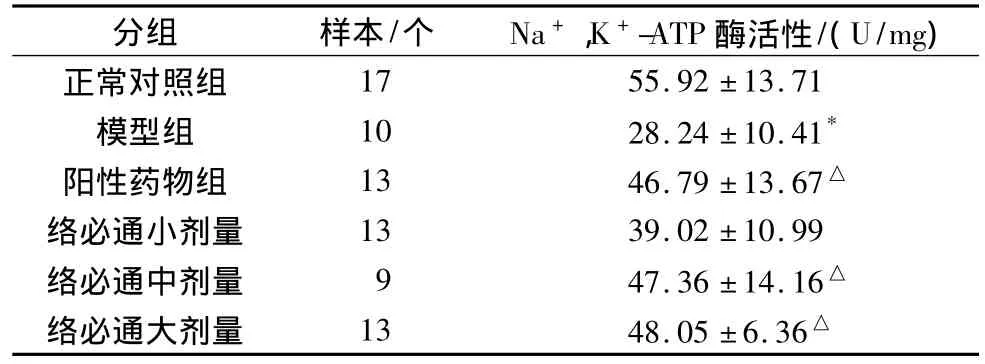
表6 各组大鼠Na+,K+-ATP酶活性比较(±s)
分组 样本/个 Na+,K+-ATP酶活性/(U/mg)17 55.92±13.71模型组 10 28.24±10.41*阳性药物组 13 46.79±13.67△络必通小剂量 13 39.02±10.99络必通中剂量 9 47.36±14.16△络必通大剂量 13 48.05±6.36正常对照组△
2 络必通颗粒对神经电生理的影响
宁光[6]对301例糖尿病患者进行神经传导检查结果表明,相对临床一般检查,无论是运动神经传导速度,还是感觉神经传导速度,其异常率都要高于临床一般检查结果,可以在这些糖尿病患者中早期发现临床无异常的神经损伤,从而达到早期诊断目的。近期国外学者[7]进一步肯定了神经传导检查、感觉定量测定,这两种神经电生理检查方式的良好可重复性以及在DPN临床试验中的应用前景。因此将神经电生理的改变作为DPN大鼠模型成立以及疗效判定是目前动物实验较经典的指标。本试验中具有益气养阴、活血祛瘀、解毒化浊功效的络必通颗粒在所观察的8周内可使模型大鼠已减慢的神经传导速度加快,提示络必通颗粒对糖尿病大鼠周围神经功能有明显的改善作用。其中医机理可能是益气养阴、活血祛瘀、解毒化浊法联合运用而达气阴得充,中焦得助,消渴得除,瘀浊邪毒得祛,经脉得养而通畅,从而受损的神经得以津血的濡养而功能恢复,神经传导速度加快,且络必通颗粒中多种中药均有降糖、降脂和改善多元醇通路状态的作用,从而机体的代谢和微循环得以改善,传导速度提高。
3 络必通颗粒对Na+,K+-ATP活性的影响
Na+,K+-ATP酶是生物体内广泛存在的一种极为重要的膜酶,广泛分布于各类细胞质膜上,它与神经肌肉兴奋性和传导性的保持,物质吸收和腺体的分泌等生理过程密切相关。Na+,K+-ATP酶活性的减小可反映出能量代谢的改变,影响到细胞能量释放,导致细胞内外离子浓度差的减小,引起NCV减慢。在实验性糖尿病动物中观察到[2],大鼠坐骨神经Na+,K+-ATP酶活性明显下降,表明糖尿病状态下,动物外周神经细胞Na+、K+的转运和能量供应可能产生障碍,糖尿病时的多元醇通路增强可以通过影响肌醇和牛磺酸代谢,减少NO合成,引起伪缺血等多种途径,导致神经Na+,K+,ATP酶活性的降低。Bianchi等[8]的研究表明,在链脲佐菌素诱导后11周的糖尿病大鼠坐骨神经中Na+,K+-ATP活性明显降低,与本文的结果相一致。本实验中,络必通治疗组增加Na+,K+-ATP酶的活性,且大剂量组效果明显,显示出具有增强神经功能的作用。分析原因,糖代谢的改善是基础治疗,对于控制糖尿病及并发症意义明确。微循环的改善有利于Na+,K+-ATP酶活性的恢复。同时这一作用可能还与络必通颗粒降低神经组织中多元醇含量,抑制醛糖还原酶活性等有关,这有待于今后的基础实验进一步证实。
[1]Boulton N J M,Vinik A I,Arezzo J C,et al.Diabetic Neuropathies:a statement by the American Diabetes Association[J].Diabetes Care,2005,28(4):956-962.
[2]Sima A A F,Subimoto K.Experimental diabetic neuropathy:an update[J].Diabetologia,1999,42:773-788.
[3]Klemm T,Paschke R.Possible genetic causes for late complications of diabetes mellitus[J].Med Klin,2000,95:31-39.
[4]Kishi Y,Nickanders K K,Schmelzer J D,et al.Gene expression of antioxidant enzymes in experimental diabetic neuropathy[J].J Peripher Nerve Syst,2000,5(1):11-18.
[5]Conti G,Scarpini E,Baron P,et al.Macrophage infiltration and
death inthenerve during the early phases of experimental diabetic neuropathy:a process concomitant with endoneurial induction of IL21 beta and p75NTR[J].J Neurol Sci,2002,195(1):35-40.
[6]宁 光.糖尿病周围神经病变诊断研究进展[J].中国实用内科杂志,2007,27(7):487-489.
[7]Bird S J,Brown M J,Spino C,et al.Value of repeated meas-ures of nerve conduction and quantitative sensory testing in adiabetic neuropathy trial[J].Muscle Nerve,2006,34:214-224.
[8]Bianchi R,Buyukakilli B,Brines M,et al.Erythropoi-etin both protects from and reverses experimental diabetic neuropathy[J].PNAS,2004,101(3):823-828.