纳米介孔分子筛球作为难溶性药物长效缓释的研究
徐莹璞 王宇 曲凤玉,2 武祥 马金艳
(1.哈尔滨师范大学化学化工学院,哈尔滨:150025;2.先进功能材料及激发态黑龙江省重点实验室,哈尔滨:150025)
1 前言
药物的缓/控释载体的研究一直是医药领域中一项重要的研究课题。因为药物的缓/控释制剂不仅具有重要的治疗价值,如保持稳定的血药浓度、降低毒副作用、提高生物利用度、延长药效时间、方便患者、保护药物免受胃酸或胃蛋白酶的降解、掩盖异味等,而且具有可观的商业价值。目前用作药物载体的主要有高分子化合物、脂质体、有机酸、多糖、纤维素、微粉硅胶等。自从2001年Vallet Regí等首次报道以介孔分子筛MCM-41作为药物缓释载体研究之后[1],很快引起生物医学,药学和材料化学界的关注,已经成为新型药物载体的研究热点和介孔材料研究领域又一新的重要研究课题[2]。目前国内外有多个介孔材料研究小组都在致力于该领域的研究工作。研究内容主要有以下几方面:①调节介孔分子筛的理化性质,如孔径、孔容、BET比表面积、孔道结构、表面修饰等缓释药物[3];②“智能性”的pH值、磁、光、酶、热、氧化还原等可控“诱导”释放[4-7];③介孔分子筛孔道“分子门”的可控设计[8-10];④多元释药等多功能体系的研究[11];⑤细胞粘附和生物相容性研究等[12]。
前期研究表明介孔分子筛载体的形貌对药物的释放性能有很大的影响,可以通过调控载体的形貌有效地控制药物释放速率。对于体内长循环缓释药物载体的形貌有明确的要求,一般要求其粒径分布在50~200 nm。较小的纳米级的介孔载体由于其药物的传输路径较短,难于实现药物的长效释放。
本文选用具有良好的药理活性、生物半衰期短(2h),难溶性的药物布洛芬为模型药物,以150 nm的介孔分子筛球为载体,通过三甲基氯硅烷对介孔分子筛球不同程度的修饰,精细调节有机基团(CH3)3Si-在介孔表面的嫁接量,从而实现药物的长效释放。同时用粉末X射线衍射(XRD)仪、红外光谱仪(FT-IR)、高分辨率透射电镜(HRTEM)和N2吸附-脱附对样品进行了表征。
2 实验部分
2.1 仪器和试剂
X-射线粉末衍射(XRD)采用Siemens D5005型衍射仪,扫描速度1°/min。氮气吸附/脱附采用Micromeritics ASAP2010 M分析仪。透射电镜采用日本电子公司的JEM-2010透射电子显微镜(加速电压200kV)。UV采用上海光谱仪器有限公司的752型紫外分光光度计。
十六烷基三甲基溴化铵(CTAB16,分析纯,惠世生化试剂有限公司,上海),正硅酸乙酯(TEOS,天泰化学品有限公司,天津),布洛芬(IBU,天尊泽众化学公司,南京),三甲基氯硅烷(TMCS,Aldrich)。
2.2 介孔分子筛的合成
介孔分子筛球MCM-41的合成见参照文献[13]。将0.5g CTAB16加入到240mL的蒸馏水中,搅拌、加热使其变成澄清溶液后加入2M NaOH溶液1.75mL,将溶液的温度调到80℃后,逐滴加入5mL的TEOS,继续搅拌2h,冷却至室温,过滤,用大量去离子水洗涤,室温下干燥。在550℃温度下,焙烧5h除去有机模板剂。
2.3 介孔分子筛的表面修饰
介孔分子筛的表面修饰方法见参考文献[14],称取三份焙烧后的分子筛1g,充分干燥后,分别置于含三甲基氯硅烷 0.2,0.4和1g的150mL甲苯中,在80℃下搅拌10 h后,用丙酮洗涤,室温下干燥。修饰后的产物分别标记为MCM-41(1:0.2),MCM-41 (1:0.4)和MCM-41(1:1)。
2.4 组装和释放方法
2.4.1 IBU在MCM-41中的组装
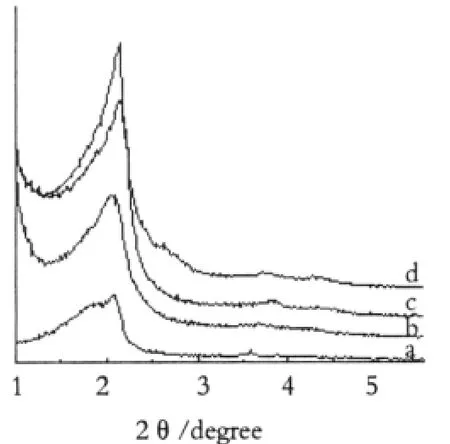
图1 介孔分子筛载体修饰前后的小角粉末X射线衍射图Fig.1 XRD patterns at low diffraction angles a.MC M-41;b.MC M-41(1:0.2);c.MC M-41(1:0.4); d.MC M-41(1:0.4)
将0.221g的分子筛加入到含有0.221g布洛芬的12 mL的正己烷溶液中磁力搅拌2 h,5G熔砂漏斗过滤后,适当稀释,紫外法测定滤液中药物的残留量,差减法计算组装体中布洛芬的含量,分别标记为IBU/MCM-41,IBU/MCM-41(1:0.2),IBU/MCM-41 (1:0.4),IBU/MCM-41(1:1)。
2.4.2 组装体中IBU的释放
分别称取一定量的布洛芬和介孔分子筛球的组装体经3MPa压片后准确称重,室温下置于500 mL模拟人工肠液中,定时吸取释放液,每次吸取后及时补充等量的模拟人工肠液,吸取液用0.45μm微孔滤膜过滤,紫外测定。
3 结果和讨论
3.1 粉末和红外分析
图1(a-d)为介孔分子筛载体修饰前后的小角粉末X射线衍射图。样品在修饰前后2θ=2°处均出现明显的(100)晶面的衍射峰,经过不同浓度的硅烷化修饰后,(100)晶面的衍射峰强度均明显增强,说明经过硅烷化后,仍然保持介孔相结构;且在2θ= 3.5~4°处出现(110)晶面的衍射峰,这可能是由于硅烷化使载体孔壁的Si-OH减少,疏水性增强,进而使孔道内残留H2O的量减少所致,有文献报道孔道内的吸附水对XRD衍射峰强度有明显的影响[15]。所以,载体经过硅烷化后,仍然保持有序的介孔相结构,可以进一步组装客体分子。
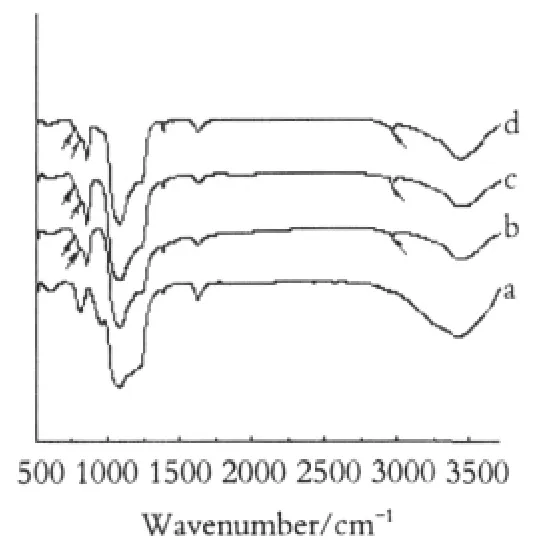
图2 介孔分子筛载体的红外光谱图Fig.2 IR spectra of calcined and silylation mesoporous silica a.MCM-41;b.MCM-41(1:0.2);c.MCM-41(1:0.4); d.MCM-41(1:0.4)
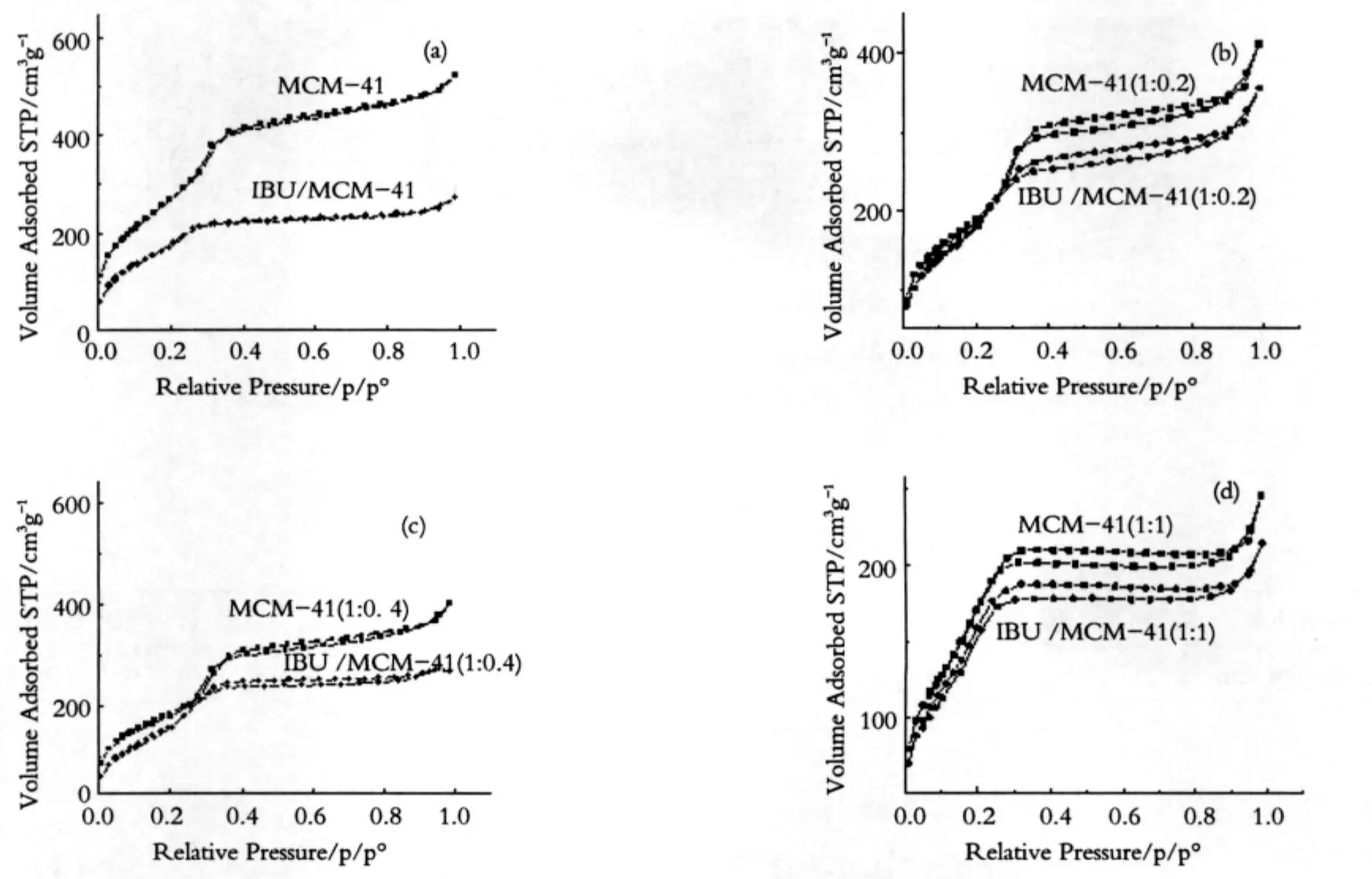
图3 介孔载体以及药物组装体的氮气吸附-脱附等温曲线图Fig.3 a-d Nitrogen adsorption/desorption isotherm of MCM-41,MCM-41(1:0.2),MCM-41(1:0.4),MCM-41(1:1)and the corresponding drug loading samples
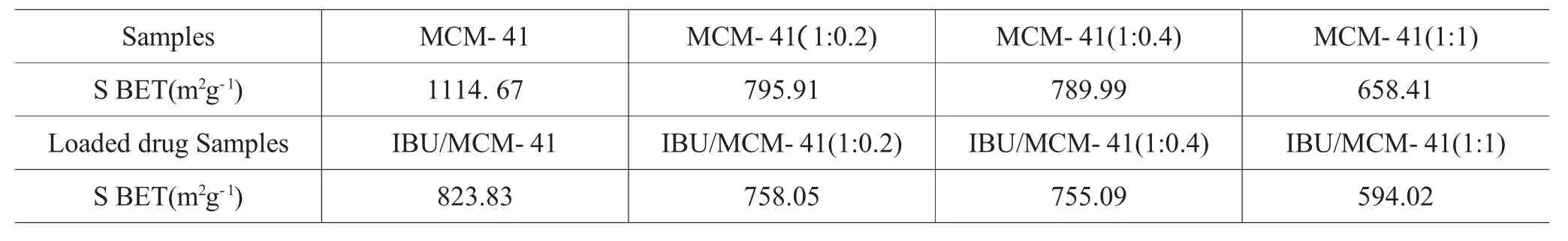
表1 比表面积Tab.1 Parameters of Brunauer-Emmett-Teller surface area
图2(a~d)为介孔分子筛载体的红外光谱图,经硅烷化后,在波长2963 cm-1和2920 cm-1处出现硅烷化残基C-H的伸缩振动峰,在807和780 cm-1处出现Si-C的伸缩振动峰[16],说明三甲基氯硅烷已经嫁接到介孔的孔壁上。
3.2 氮气吸附/脱附测试分析
图3中(a-d)为介孔载体以及药物组装体的氮气吸附-脱附等温曲线图,图中样品均为Ⅳ型等温曲线。根据BJH模型计算,比表面积如表1。
经硅烷化和载药后分子筛比表面积均有所下降,并且随着硅烷化程度的提高,介孔分子筛载体的比表面积呈下降趋势。但是从氮气吸附-脱附等温曲线的形状可知对介孔结构的有序性影响不大,仍然显示Ⅳ型吸附等温曲线,保持了介孔相的结构,这和XRD表征的结果一致。
3.3 透射电镜分析
图4中(a-d)为介孔载体从不同晶面方向的透射电镜照片,载体为粒径150 nm的球形形貌,经硅烷化后载体仍然具有六方相孔道结构,与XRD及氮气吸附-脱附分析结果一致。
3.4 布洛芬的组装及释放性能
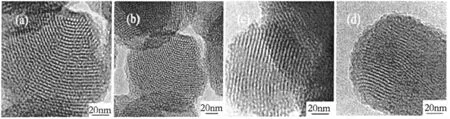
图4 介孔载体从不同晶面方向的透射电镜照片Fig.4 TEM images of parent and silylated samples: a.calcined MCM-41,b.MCM-41(1:0.2),c.MCM-41(1:0.4),d.MCM-41(1:1)

表2 布洛芬的组装及释放性能Tab.2 Loading of drug before and after silylation
未经修饰的MCM-41载药量为36.7 Wt%,硅烷化后样品IBU/MCM-41(1:0.2)、IBU/MCM-41(1:0.4)和IBU/MCM-41(1:1)的载药量分别为29.4、27.4和24.5Wt%。可见经硅烷化后其载药量均有所下降,并且随硅烷化程度的提高,其载药量亦下降,这可能由以下因素所致。文献报道药物分子在介孔分子筛中的组装量和介孔的BET比表面积相关,比表面积越大,药物的组装量越大[17]。MCM-41的BET比表面积为1114.67m2g-1,经硅烷化后MCM-41(1:0.2)、MCM-41 (1:0.4)和MCM-41(1:1)三个样品的比表面积分别下降为795.91、789.99和658.41 m2g-1。所以,硅烷化后BET比表面积均下降,是药物分子组装量下降的原因之一;另外,随着硅烷化程度的提高,三甲基氯硅烷与载体表面Si-OH缩合程度增大,使载体表面Si-OH数目减少,载体与药物分子中的-COOH作用位点减少,使主客体间的作用力减小,从而载药量降低。
图5是IBU/MCM-41、IBU/MCM-41(1:0.2)、IBU/MCM-41(1:0.4)和IBU/MCM-41(1:1)四种载药系统在模拟人工肠液中药物释放动力学曲线。由图可见,和IBU/MCM-41组装体比较,硅烷化后药物组装体均呈较好药物缓释性能。文献报道,分子筛经过硅烷化后,其孔径减少[18],而孔径的大小可以影响药物分子的释放速率,通常是孔径减小,释放速率减慢。此外,硅烷化后药物组装体药物释放速率减慢是由于介孔孔壁嫁接-Si(CH3)3基团后,增加了对药物分子释放的空间位阻,因而减缓了药物分子的释放速率。

图5 载药系统在模拟人工肠液中药物释放动力学曲线Fig.5 Cumulative release rates of IBU in simulated proximal intestinal fluid
由图可知,硅烷化后的药物组装体药物分子的初释放速率较IBU/MCM-41小,这可能是由于以下两方面的因素所致。介孔分子筛硅烷化时,外表面较内表面更易于硅烷化,疏水的外表面性质使药物在外表面的吸附量较MCM-41小,这是硅烷化后的药物组装体药物初释放速率较小的原因之一。其二,药物分子从介孔孔道释放可以分为两个过程:(i)溶出介质扩散进入介孔孔道中溶解药物分子;(ii)溶解的药物分子扩散出介孔的孔道。与IBU/MCM-41相比较,硅烷化后的药物组装体,由于介孔内表面的疏水性较强,使极性的水分子扩散进入孔道中的时间亦较长,这可能是硅烷化后的组装体药物分子初释放速率较小的另一原因。
由图5还可以发现,完全药物释放所需时间和硅烷化程度相关。三种组装体系IBU/MCM-41(1:0.2)、IBU/MCM-41(1:0.4)和IBU/MCM-41(1:1)完全药物释放分别需要83 h、65 h和53 h。这可能是由于随着硅烷化试剂浓度的增加,硅烷化程度提高,介孔表面疏水性的Si(CH3)3基团增多,而硅羟基减少,使介孔孔壁和药物分子羧基间的作用力减弱,导致药物分子的释放速率随着硅烷化程度的提高而增大。
因此,以150nm的介孔分子筛球为载体,通过对其不同程度的硅烷化方法,调节介孔分子筛的表面有机基团的嫁接量,调节主客体分子间的作用力及介孔分子筛载体对药物释放的空间位阻,从而实现了药物的长效缓释。
1 Vallet-RegiM.,Rámila A.,delRealR.P.and Pérez-Pariente J.A new property of MCM-41:drug delivery system.Chem.Mater.,2001,13:308~311
2 Yang P.P.,Huang S.S.,Kong D.Y.,Lin J.and Fu H.G. Luminescence functionalization of SBA-15 by YVO4:Eu3+as a noveldrug delivery system.Inorg.Chem,.2007,46: 3203~3211
3 Mu?oz B.,Rámila A.,Pérez-Pariente J.,Díaz I.,and Vallet-Regí M.MCM-41 organic modification as drug delivery rate regulator.Chemistry of Materials,2003,15: 500~503
4 Mal N.K.,Fujiwara M.and Tanaka Y.Photocontrolled reversible release of guest molecules from coumarin-modified mesoporous silica.Nature,2003,421:350~353
5 Hu S.H.,Liu T.Y.,Huang H.Y.,Liu D.M.and Chen S.Y. Magnetic-sensitive silica nanospheres for controlled drug release.Langmuir,2008,24:239~244
6 Han G.,You C.,Kim B.,Turingan R.S.,Forbes N.S.,Martin C.T.and Rotello V.M.Light-regulated release of DNA and its delivery to nuclei by means of photolabile gold nanoparticles. Angew.Chem.Int.Ed.,2006,45:3165~3169
7 Chi P.,Kyuho L.and Chul K.Angew.Chem.Int.Ed.,2009,48: 1275~1278
8 Angelos S.,Yang Y.W.,Patel K.,Stoddart J.F.and Zink J.I. pH-responsive supramolecular nanovalves based on cucurbit[6] uril pseudorotaxanes.Angew.Chem.Int.Ed.,2008,47: 2222~2226
9 Aznar E.,Marcos D.,Martinez-Manez R.,Sancenon F.,Soto J., Amoros P.and Guillem C.pH-and photo-switched release of guest molecules from mesoporous silica supports.J.Am.Soc. Chem.,2009,131:6833~6843
10 Agasti S.S.,Chompoosor A.and You C.C.Photoregulated release of caged anticancer drugs from gold nanoparticles.Am. Soc.Chem.,2009,131:5728~5729
11 Zhu Y.F.and Kaskel S.Comparison of the in vitro bioactivity and drug release property of mesoporous bioactive glasses (MBGs)and bioactive glasses(BGs)scaffolds.Micro.Meso. Mater.,2009,118:176~182
12 Li X.,Shi J.,Dong X.P.,et al.Biomed.Mater.Res.,2002,10: 84~91
13 Cheng Y.L.,Dusan M.J.,Ksenija J.,Shu X.,Srdija J.and Victor S.Y.A mesoporous silica nanosphere-based carrier system with chemically removable CdS nanoparticle caps for stimuli responsive controlled release of neurotransmitters and drug molecules.Am.Chem.Soc.,2003,125:4451~4459
14 Zhao X.S.,Lu G.Q.,Whittaker A.K.,Millar G.J.and Zhu H. Y.Comprehensive study of surface chemistry of MCM-41 using Si-29 CP/MAS NMR,FTIR,pyridine-TPD,and TGA. Phys.Chem.B.,1997,101:6525~6531
15 Zhao X.S.and Lu G.Q.Modification of MCM-41 by surface silylation with trimethylchlorosilane and adsorption study. Phys.Chem.B.,1998,102:1556~1561
16 HeJ.,Shen Y.,Yang J.,EvansD.and Duan X. Nanocomposites structure based on silylated MCM-48 and poly(vinyl acetate).Chem.Mater.,2003,15:3894~3902
17 Andersson J.,Rosenholm J.,Areva S.,et al.Influences of material characteristics on ibuprofen drug loading and release profiles from ordered micro-and mesoporous silica matrices. Chem.Mater.,2004,16:4160~4167
18 Qu F.Y.,Zhu G.S.,Huang S.Y.,et al.Effective controlled release of captopril by silylation of mesoporous MCM-41. Chem.Phys.Chem.,2006,7:400~406

