共抑制分子PD-1在类风湿关节炎模型免疫系统及滑膜组织的表达①
郭国宁 尚永军 朱国宴 文 亮 向 强 (第三军医大学附属西南医院急诊科,重庆 400038)
共抑制分子PD-1在类风湿关节炎模型免疫系统及滑膜组织的表达①
郭国宁 尚永军②朱国宴③文 亮④向 强 (第三军医大学附属西南医院急诊科,重庆 400038)
目的:探讨共抑制分子PD-1在牛二型胶原(CII)诱导的类风湿关节炎模型(CIA)小鼠免疫器官、关节及RA患者滑膜组织内的表达。方法:使用牛二型胶原免疫DBA-1/j小鼠,建立小鼠类风湿关节炎模型;免疫组化检测类风湿关节炎标本PD-1的表达变化;流式细胞分析术(FACs)检测对PD-1阳性细胞进行定位。结果:免疫组化的结果证实,小鼠的骨髓、胸腺、脾脏及淋巴结有中有大量的PD-1阳性细胞,FACs分析结果表明这些PD-1+细胞主要为CD3+T细胞,B220+B细胞,CD68+巨噬细胞及CD11c+树突状细胞,统计分析表明CIA小鼠体内PD-1表达及分布相对于对照组小鼠没有显著提高。此外,RA患者及CIA小鼠的滑膜组织内仅发现少量PD-1阳性的细胞。结论:PD-1阳性细胞可能不参与类风湿性关节炎的发生发展过程。
PD-1;类风湿关节炎;滑膜组织;免疫器官;免疫组化
①本文受国家自然科学基金(30700855及60971117)资助
②内蒙古赤峰学院第一附属医院骨科,赤峰024000
③重庆江陵医院妇产科,重庆400038
④通讯作者
类风湿关节炎(Rheumatoid arthritis,RA)是以对称性多关节滑膜炎为主要临床症状的自身免疫性疾病。多数病人有永久性骨破坏,并可出现关节外损害,若无恰当治疗,则最终形成终生残疾甚至危及生命[1]。
对RA关节损伤的病理研究发现,持续性活化的自身反应性T细胞在RA的病程中有重要作用。而对T细胞活化机制的研究表明,T细胞的有效活化和效应发挥需要共刺激信号,缺乏共刺激信号的抗原刺激易引起免疫耐受(Tolerance)、无反应性(Anergy)或细胞凋亡(Apoptosis)[2]。已知的几种共刺激分子(CD28、CTLA-4、ICOS 、PD-1、BTLA 等)在多种疾病中起主导作用,合理的增强或封闭这些共刺激途径已经应用于肿瘤、病毒和寄生虫感染、移植排斥及自身免疫性疾病等的实验治疗并取得了良好的效果[2]。特别是,基于CTLA-4及CD40等共刺激途径的免疫调节药物已经应用于RA的临床治疗并取得了初步成效[3,4]。如K remer等[3]使用CTLA-4-Ig融合蛋白对220例处于活动期的RA患者进行治疗,发现CTLA-4-IgFc治疗6个月后,患者关节炎症减轻,生活质量及关节功能均得到明显改善,并且与CTLA-4-IgFc融合蛋白的使用剂量呈正相关。表明通过共刺激途径来诱导T细胞对自身抗原的免疫耐受并应用于RA的临床治疗是—项很有前景、值得尝试的研究。
PD-1(Program death-1)是1999年鉴定的胞内具有两个免疫受体酪氨酸抑制性基序(ITIMs)共刺激分子受体,其结构和功能类似于CTLA-4。PD-1与其配体PD-L1或PD-L2交叉联结后可下调TCR信号并最终抑制T细胞的活化[5]。而PD-1基因敲除小鼠可自发产生狼疮样的增生性关节炎,表明该信号在维持外周耐受中有关键作用[6]。最近的研究表明,PD-1基因的多态性与类风湿关节炎的发生相关,在RA患者的关节积液内也发现有显著增多的CD4+PD-1+T细胞[7-9]。此外,使用PD-L1IgGFc融合蛋白增强PD-1信号可显著降低CIA小鼠关节炎症,提示PD-1信号可调节类风湿关节炎的发生及进程[10]。
虽然对PD-1在类风湿关节炎中的作用已经有了文献报道。但是迄今对PD-1在小鼠及RA患者体内尤其是滑膜组织内的分布尚未知。本研究主要对比分析PD-1在CIA小鼠及正常对照小鼠骨髓、胸腺、脾脏及淋巴结表达变化,分析PD-1在滑膜组织内的分布情况,为进一步阐明PD-1在类风湿关节炎的病理进程中的作用提供新的线索。
1 材料与方法
1.1 材料 类风湿关节炎患者的滑膜组织:4例类风湿关节炎患者的标本取自西南医院关节外科。患者经生化指标检测、抗风湿因子抗体滴度及滑膜组织H&E染色都证实为类风湿关节炎。所有的手术患者在术前3个月内都未接受任何激素治疗。标本使用4%甲醛固定,脱水后使用石蜡包埋。
1.2 方法
1.2.1 类风湿关节炎模型小鼠的建立 6周龄大小的雄性DBA-1/j小鼠购自上海中国科学院实验动物中心并饲养于第三军医大学实验动物中心。CIA模型的建立及评价如文献[11]报道。简单介绍如下:100μg牛二型胶原溶解于100μl的醋酸并使用完全佛氏佐剂充分乳化。选择小鼠的尾根部多点注射。21天后在相同的位置再次使用相同剂量增强免疫。小鼠接受相同体积(100μl)的PBS注射作为对照。
为了评价关节炎症程度,所有的小鼠每3天观察一次。连续观察40天。小鼠的关节炎症临床评分按如下标准划分:0.所有的关节无任何肿胀或变红;1.部分关节变红但不肿胀;2.多数关节肿胀及变红;3.关节及指头都肿胀及变红;4.关节僵硬或畸形强直[12]。
取经40天CII胶原免疫诱导的CIA模型(关节炎评分=4,n=5)及PBS对照(n=5)小鼠骨髓、胸腺、脾脏、腋下淋巴结组织。4%多聚甲醛固定并脱水后石蜡包埋。
1.2.2 PD-1表达的免疫组化 RA患者的滑膜组织及小鼠(PBS处理对照组及CIA模型)的免疫器官组织制成3~5μm的切片。免疫组化按常规方法进行。即切片经脱蜡及复水后,使用0.01 mol/L的枸橼酸钠抗原修复液进行抗原修复。待冷却后使用0.03%H2O2处理30分钟去掉内源性过氧化物酶活性。0.01%磷酸盐缓冲液(PBS)冲洗5分钟,3次后使用0.01%牛血清白蛋白(BSA)封闭30分钟,随即滴加山羊抗小鼠PD-1多抗(10μg/m l,该抗体也与人PD-1有交叉反应,R&D System),4℃条件下过夜孵育。次日滴加EnVision+TM(EnVisionTM System,HRP,mouse/rabbit,Dako)二抗并于室温孵育 70分钟。同时以山羊的IgG1作为同型对照。最后使用DAB对标本进行显色,显微镜下控制显色时间,使用苏木素复染细胞核,水洗,脱水,透明后中性树胶封片。
为了对比分析PD-1阳性细胞在PBS及CIA小鼠各器官内的表达变化,骨髓、淋巴结及胸腺各切片隋机选择5个区域(放大倍数×600,0.018mm2/区域)进行照相。而脾脏切片则仅仅选择白髓区域进行照相。阳性细胞使用Pro-Plus 5.0软件进行计算。
1.2.3 PD-1表达的流式分析 使用流式细胞仪分析PD-1在CD4+T细胞、CD8+T细胞、B220+B细胞及CD11c+树突状细胞的分布。实验步骤如下:骨髓,胸腺,脾脏及淋巴结组织制成单细胞悬液。细胞随即加入 PE-PD-1、FITC-CD4、FITC-CD8、FITC-B220、FITC-CD11c抗体并室温孵育30分钟。随后10 000细胞/样进行上机检测。实验结果使用CellQuest软件进行分析。
1.3 统计学分析 使用t检测对PD-1阳性细胞在关节炎及对照小鼠各器官的表达变化进行对比分析。P<0.05为显著差异。
2 结果
2.1 CIA模型的建立 PBS对照组小鼠后爪关节正常,而DBA-1/j小鼠在经牛Ⅱ型胶原免疫40天后,脚趾包括趾骨关节,掌骨关节,近端和远端指间关节都出现明显的肿胀。此外,H&E染色显示CIA模型小鼠有大量炎细胞浸润并出现滑膜增生,骨破坏及血管翳的形成(图1),表明DBA-1/j小鼠在经牛Ⅱ型胶原免疫40天后可诱发关节炎。
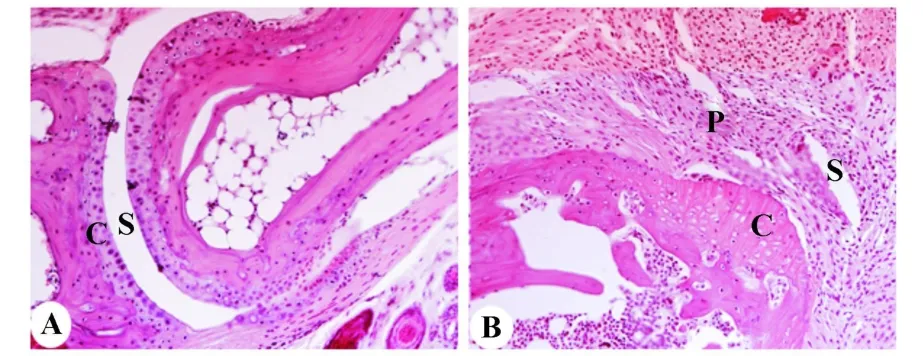
图1 类风湿关节炎小鼠模型的建立Fig.1 H istological analysis in the joint of hind limbs during CIA

图2 免疫组化分析PD-1在PBS及CIA小鼠各免疫器官的表达及分布Fig.2 The expression of PD-1 in the immune organs was determ ined by immunohistochem istry
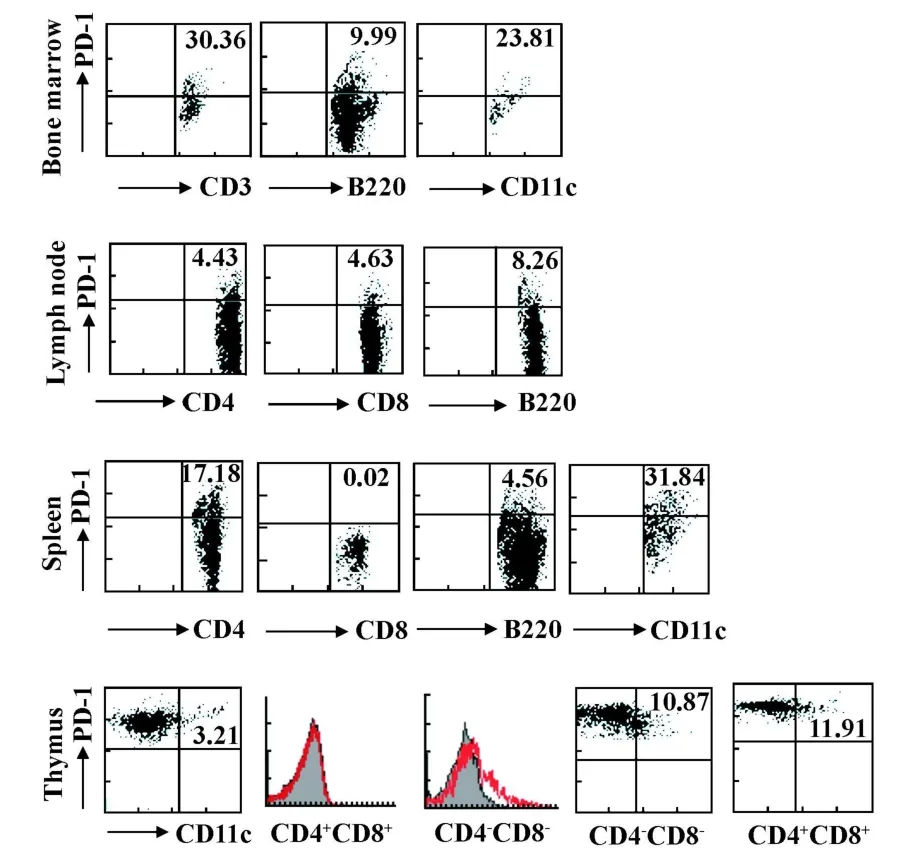
图3 FACs分析PD-1在各免疫器官内的表达Fig.3 The phenotype of PD-1+cells in immune organswas determ ined by flow cetometry
2.2 PD-1表达分析结果 为了探讨关节炎的发生及进程是否与免疫器官内PD-1的表达变化相关,我们使用免疫组化技术对CIA模型及对照组小鼠的免疫器官包括骨髓,胸腺,脾脏及掖下淋巴结的PD-1表达进行了分析。如图2所示,PD-1主要表达于骨髓淋巴样细胞;而淋巴结处,PD-1阳性的细胞也主要分布于皮质区;胸腺内PD-1阳性的细胞广泛分布于胸腺髓质及皮质区;而脾脏,PD-1主要表达白髓区内淋巴样的细胞,红髓及白髓/红髓连接区也有少量PD-1阳性的细胞。进一步使用FACs对骨髓、胸腺、脾脏及淋巴结的 CD4+T细胞、CD8+T细胞,B220+B细胞及CD11c+树突状细胞PD-1的表达情况进行了分析,结果显示PD-1表达于这些器官内CD11c+树突状细胞、巨噬细胞、B细胞及T细胞。此外,在胸腺,CD4+CD8+双阳性胸腺细胞缺乏PD-1表达(图3)。
我们对CIA模型及对照组小鼠免疫器官内PD-1阳性细胞的数目分别进行了计算,统计分析结果表明PD-1阳性细胞的数目在两组之间没有显著差异(图4),表明在关节炎发生及进程中,免疫器官内的PD-1功能状态未发生变化。
2.3 PD-1在滑膜组织的表达 为了进一步分析关节内PD-1的表达情况,我们对PBS对照、CIA模型小鼠及关节炎患者的滑膜组织进行免疫组化分析,如图5所示,PBS对照及CIA模型小鼠的关节处发现有少量PD-1阳性的细胞。此外,人RA患者的滑膜组织也发现有少量的PD-1阳性细胞,表型分析其主要是树突状细胞。关节炎滑膜组织内有少量的PD-1阳性细胞表明滑膜内PD-1阳性细胞可能不参与类风湿关节炎的病理进程的调节。

图5 PD-1在小鼠关节及RA患者滑膜组织内的表达Fig.5 The expression and distribution of PD-1 in joints of normalm ice,rheumatoid synovium from CIAm ice aswellasRA patients

图4 PD-1阳性细胞的数目在PBS处理组及CIA模型小鼠两组之间的统计分析Fig.4 Thenumber of PD-1+cells in immune organs between PBS-treated m ice vs CIA m ice
3 讨论
类风湿关节炎(Rheumatoid arthritis,RA)是一种累及滑膜关节为主的系统性自身免疫性疾病,早期以关节炎性肿胀、疼痛为主要表现,若未进行及时有效地治疗,可逐渐出现关节软骨及骨的损伤,最终导致关节畸形与强直,严重影响患者的生活质量及工作能力[1,2]。当前,RA的临床治疗仍以非甾体抗炎药物和慢作用抗风湿药物为主,糖皮质激素也较为常用。这些药物均有一定疗效,但由于毒副反应较人,病人难以长期服用。因此,急需新的特异性作用靶点或新的干预手段来对RA患者进行治疗。
由于共刺激信号PD-1/PD-L在维持外周耐受中有关键作用,因此探讨该途径在疾病中的功能是目前研究的热点。最近的研究表明,PD-1基因的多态性与类风湿关节炎的发生相关[7,8]。虽然在RA患者的关节积液内也发现有显著增多的PD-1+T细胞[9]。但是迄今对PD-1在关节炎患者体内,尤其是免疫器官及滑膜组织的表达及分布况尚未未知。本研究我们系统分析了PD-1在关节炎模型小鼠及人滑膜组织内的表达情况。FACs检测结果表明在正常小鼠,PD-1主要表达于免疫器官内的抗原递呈细胞包括树突状细胞,巨噬细胞及免疫细胞如T细胞及B细胞。免疫组化分析表明,PD-1主要表达于骨髓内淋巴样细胞;在胸腺,PD-1阳性的细胞广泛分布于胸腺髓质及皮质;而在脾脏,PD-1主要表达白髓区淋巴细胞;我们也发现大量PD-1阳性的细胞位于淋巴结的皮质区。此外,我们对CIA模型及对照组小鼠免疫器官内PD-1阳性细胞的数目分别进行了计算,统计分析表明PD-1阳性细胞的数目在两组之间没有显著差,表明在关节炎进程中,炎症并没有改变免疫器官内PD-1的表达。
为了进一步分析关节内PD-1的表达情况,我们对CIA模型小鼠及关节炎患者的滑膜组织进行免疫组化分析。结果显示CIA模型小鼠的关节处仅仅发现有少量的PD-1阳性细胞。此外,人RA患者的滑膜组织也发现少量的PD-1阳性细胞。关节炎滑膜组织内没有增多的PD-1阳性细胞浸润表明关节及滑膜内的PD-1信号可能没有参类风湿关节炎的病理进程的调节。
总之,本研究首次分析了PD-1在类风湿关节炎内的表达情况,为进一步基于通过PD-1/PD-L信号通路进行体内干预治疗提供了理论基础。
1 Goekoop-Ruiterman Y P,Huizinga TW.Rheumatoid arthritis:can we achieve true drug-free rem ission in patients with RA?[J].Nat Rev Rheumatol,2010;6:68-70.
2 Sharpe A H,Abbas,A K.T-cell costimulation-biology,therapeutic potential,and challenges[J].N Engl JM ed,2006;355:973-975.
3 Kremer JM,WesthovensR,Leon Metal.Treatment of rheumatoid arthritisby selective inhibition of T-cellactivation with fusion protein CTLA 4I[J].N Engl JMed,2003;349:1907-1915.
4 PiererM,Schulz A,RossolMetal.Herpesvirus entrymediator-Ig treatment during immunization aggravates rheumatoid arthritis in the collageninduced arthritismodel[J].J Immunol,2009;182:3139-3145.
5 Riley JL.PD-1 signaling in primary T cells[J].Immunol Rev,2009;229:114-125.
6 Nishimura H,Nose M,Hiai Hetal.Development of lupus-like autoimmune diseasesby disruption of the PD-1 gene encoding an ITIM motifcarrying immunoreceptor[J].Immunity,1999;11:141-151.
7 Prokunina L,Padyukov L,BennetAetal.Association of thePD-1.3A allele of the PDCD1 gene in patientswith rheumatoid arthritis negative for rheumatoid factor and the shared epitope[J].Arthritis Rheum,2004;50:1770-1773.
8 Lin S C,Yen JH,Tsai J Jetal.Association of a programmed death 1 gene polymorphism with the development of rheumatoid arthritis,but not system ic lupuserythematosus[J].Arthritis Rheum,2004;50:770-775.
9 HatachiS,Iwai Y,Kawano Setal.CD4+PD-1+T cells accumulate as unique anergic cells in rheumatoid arthritis synovial fluid[J].JRheumatol,2003;30:1410-1419.
10 Wang G,Hu P,Yang Jetal.The effectsof PDL-Ig on collagen-induced arthritis[J].Rheumatol Int,2009;25:1249-1250.
11 Kim SH,Kim S,Evans C Hetal.Effective treatment of established murine collagen-induced arthritisby systemic administration of dendritic cells genetically modified to express IL-4[J].J Immunol,2001;166:3499-3505.
12 Arnett F C,Edworthy SM,Bloch DAetal.The American Rheumatism Association 1987 revised criteria for the classification of rheumatoid arthritis[J].A rthritis Rheum,1988;31:315-324.
[收稿2010-07-29 修回2010-08-10]
(编辑 许四平)
Expression and distribution of the co-inhibitory molecule PD-1 in tissues from rheumatoid arthritis
GUOGuo-Ning,SHANGYong-Jun,ZHUGuo-Yan,WENLiang,XIANGQiang.DepartmentofWest-SouthHospital,the3rdMilitaryMedicalUniversity,Chongqing400038,China
Objective:To detect PD-1 protein expression in immuneorgans from bovine collagenⅡ(CII)-inducedmouse rheumatoid arthritis(CIA)and synovial tissuesof RA patients.Methods:Theexpression and distributionof PD-1 antigen was analyzed by immunohistochemistry.Moreover,flow cytometry(FACs)was further used to characterize PD-1 expression.Results:Immunohistochemicalanalysis revealed that PD-1 positive cellswere found in thymus,spleen,lymph nodes and bonemarrow,and FACs further demonstrated that PD-1 positive cellswere CD3+T cells,B220+B cells,CD68+macrophages or CD11c+dendritic cells.However,the exp ression and distribution of PD-1 were not changed significantly between normaland CIAm ice.Interestingly,seldom PD-1 positive cellswere found both in synovial tissues of CIAm ice and in RA patients.Conclusion:PD-1 signalm ightnotbe involved in regu lating the pathogenesis of RA.
PD-1;Rheumatoid arthritis;Synovial tissues;Immuneorgans;Immunohistochemistry
R392.3
A
1000-484X(2010)12-1119-05
10.3969/j.issn.1000-484X.2010.12.014
郭国宁(1974年-),男,博士,主治医师,主要从事免疫调节的基础及临床研究,E-mail:gotoguoguo@126.com。

