双黄连注射液的气相色谱指纹图谱及其化学成分的相关性分析
茹 鑫, 梁 悦, 于 翠, 张寒琦, 师宇华
(吉林大学化学学院,吉林长春130012)
双黄连注射液收载于卫生部部颁标准第十一册,由金银花250g、黄芩250g和连翘500g组成,为棕红色澄明液体。有抗菌消炎,清热解毒之功效,适用于球菌的各种感染。处方中金银花、连翘、黄芩性寒味苦,含有挥发性成分。现代药理学研究表明,这些挥发性成分具有解热、抗菌的作用[1],应加以利用。
目前双黄连制剂的研究多以高效液相色谱法对其主要药效成分分析为主。如张洁等[2]和马百平等[3]采用HPLCPDA(二极管阵列检测器)/ELSD(蒸发光散射)检测器,将双黄连粉针的指纹图谱与各组成单味药的指纹图谱进行比较分析,并进行了各峰的药味归属及定性。罗奇志等[4]采用液相色谱-质谱方法快速、全面地分析了双黄连粉针中的成分,为双黄连粉针的二次开发提供参考。李方等[5]建立了注射用双黄连(冻干)的液相色谱指纹图谱,用于该药生产过程的质量控制和评价。刘琳等[6]采用采用多波长反相-高效液相色谱法建立了同时测定双黄连口服液中黄芩苷、绿原酸和连翘苷的分析方法。此外,孙妍[7]和林林等[8]采用石墨炉原子吸收分光光度法分别检测了双黄连注射液中镉和铅元素,通过检测有害金属的含量控制双黄连注射液的安全性。马满玲等[9]采用紫外光谱法对双黄连注射液的稳定性进行了研究。中药制剂的成分具有复杂性,采用一种方法进行分析难以实现整体的质量控制,实现药品的安全和可靠。因此,为全面反映药品整体的质量状况,有必要对其中多组分、多指标进行分析和研究。目前,对双黄连注射液挥发性成分的研究少有报道。为有效控制双黄连注射液中挥发性成分的质量,针对制剂所含挥发性成分的特性,参照国家药品监督管理局颁布的中药注射剂指纹图谱研究的技术要求[10],对双黄连注射液中挥发性成分的提取和检测条件进行了考察和方法学验证。利用中药色谱相似度评价软件建立了双黄连注射液的GC对照谱图并与各组成单味药进行了对比和相关性分析,为双黄连注射液的质量控制和进一步研发提供依据。
1 实验部分
1.1 仪器与试药
HD挥发油提取器;DHT型搅拌恒温电热套(山东鄄城华鲁电热仪器有限公司);Varian CP-3800气相色谱仪;SPB-3全自动空气源(北京中惠普分析技术研究所);GCN1300氮气发生器(北京中惠普分析技术研究所);SGH-300高纯氢气发生器(北京东方精华苑科技有限公司);FID检测器;Star 5.0色谱工作站;岛津QP2010型气相色谱-质谱联用仪;双黄连注射液(黑龙江多多药业有限责任公司,市售10批次);正十二烷(色标,天津市光复精细化工研究所);正己烷为(分析纯,北京化工厂);实验用水为二次蒸馏用水。
1.2 实验步骤
1.2.1 参照物溶液的制备
精密量取正十二烷50 μL,置于5 mL量瓶中,加入适量正己烷定容,作为参照物溶液。以正十二烷为标准参照物,计算各色谱峰的相对保留时间和相对峰面积。
1.2.2 供试品溶液的制备
准确量取双黄连注射液180 mL,置500 mL圆底烧瓶中,参照《中华人民共和国药典》2005年版一部附录XD挥发油测定法[11],加热回流提取8 h。停止加热后,收集挥发油。加入10 μL参照物溶液,混匀、定容至0.3 mL,密封置于4℃冰箱中保存,作为供试品溶液。
1.3 气相色谱及质谱实验条件
1.3.1 气相色谱条件
进样量:0.5 μL,不分流进样;进样口温度:280℃;FID检测器温度:280 ℃;色谱柱:DB-5MS(30 m ×0.25 mm,0.25 μm);柱温:程序升温,初始温度50℃保持10 min,以5℃/min升至70℃后,以2℃/min升至100℃,再以10℃/min升至250℃保持10 min;载气:高纯氮气,流量:1.0 mL/min;燃烧气:高纯氢气,流量:30 mL/min;助燃气:空气,流量:300 mL/min。
1.3.2 气相色谱-质谱条件
进样量:0.5 μL,分流比为50∶1;进样口温度:280℃;色谱柱:Rxi-5MS(30 m ×0.25 mm,0.25 μm);柱温:同气相色谱柱温条件;载气:氦气,流速:1 mL/min。电子轰击源:离子源温度200℃,电子能量70 eV;扫描范围:50~450 amu;接口温度:250℃;倍增电压:1.2 kV;阈值:1 000 V;溶剂切除时间:3 min;结束时间:54 min。
2 结果与讨论
2.1 方法学考察
2.1.1 精密度试验
将批号为080913311的样品制成供试品溶液,连续进样6次。结果表明:谱图中各主要色谱峰相对保留时间和相对峰面积的RSD均小于3%,表明仪器精密度良好,符合指纹图谱研究的技术要求。
2.1.2 稳定性试验
将批号为080302311的样品制成供试品溶液,分别于10 min、3、9、12、18、24 和 48 h 进行测定。结果表明:谱图中各主要色谱峰相对保留时间和相对峰面积的RSD均小于3%,表明供试品溶液在48 h内稳定,符合指纹图谱研究的技术要求。
2.1.3 重复性试验
将6份批号为090213311的样品分别制备成供试品溶液并进行测定。结果表明:谱图中各主要色谱峰的相对保留时间和相对峰面积的RSD小于3%,表明供试品溶液的制备方法及仪器性能可靠,符合指纹图谱研究的技术要求。
2.2 双黄连注射液标准气相色谱指纹图谱和标准对照谱图的建立

图1 双黄连注射液的气相色谱指纹图谱A;双黄连注射液的标准对照谱图BFig.1 A-GC fingerprint and B-Standard referenced GC fingerprint of Shuanghuanglian Injection
取10批次双黄连注射液,分别按1.2.2项供试品溶液的制备方法和1.3.1项的色谱条件对供试品溶液进行制备和检测,建立了双黄连注射液的气相色谱指纹图谱。采用浙江大学中药色谱指纹图谱相似度评价系统首次生成了双黄连注射液的标准对照谱图,标示出15个共有峰(见图1,其中图 1A中 1~10分别为批号 080705322、090213311、090206311、080731312、080913311、090424311、080302311、080116312、080901322、080730322 的色谱图,S 为参照物十二烷的峰,R为生成的标准对照谱图;图1B为放大的标准对照谱图,其中1~15为15个共有峰,S为参照物十二烷的峰)。10批次样品中各共有峰的峰面积、相对保留时间RSD、相对峰面积RSD以及生成的标准对照谱图的保留时间和峰面积的数据见表1。10批次样品相似度的评价结果见表2。

表1 双黄连注射液气相色谱指纹图谱和标准对照谱图的实验数据Table.1 Experiment result of basic and standard referenced GC fingerprint of Shuanghuanglian Injection
从10批次指纹图谱的相对保留时间和相对峰面积的RSD可以看出:相对保留时间的RSD在0.04~0.72之间,均小于3%;相对峰面积的RSD在0.20~2.80之间(7号色谱峰除外,为3.25%),均小于3%,各色谱峰相对峰面积存在一些差异,可能为所用的原料产地和季节性不同或储藏方面存在差异造成的。

表2 相似度评价的结果Table.2 Result of similarity evaluation
利用中药指纹图谱相似度计算软件,以10批次双黄连注射液的指纹图谱综合平均作为对照模板,计算10批次样品的相似度。从相似度评价的结果可以看出:相似度均大于0.87,说明该厂家不同批次的双黄连注射液在整体上具有一定的相似性。
2.3 双黄连注射液中挥发性成分的定性及其相关性分析
分别按1.2.2项供试品溶液的制备方法和1.3.2项的气相色谱-质谱条件对供试品溶液进行制备和检测。对比双黄连注射液及其各单味药材中各挥发性成分GC-MS分析的结果,对各主要色谱峰进行了定性和相关性分析。双黄连注射液的总离子流图见图2,定性和归属分析的结果见表3。共检测出双黄连注射液中96个挥发性成分,按照各色谱峰的相对保留时间和保留值规律[12]、计算机数据库检索以及结合文献报道[13-15]鉴定了其中的54个成分,占总峰面积的92.12%。其中芳香族化合物为挥发油的主要成分(占78.11%),另外还有萜类(8.39%)和脂肪族化合物(5.62%)。对其相关性分析的研究结果表明:对于相对含量较高的化学成分都能从各单味药材的谱图中找到归属,细化了中药制剂的质量控制指标。归属的43个化合物占已鉴定成分峰面积百分含量的84.27%;未归属的11个化合物中含量最大的是8号色谱峰(水杨酸甲酯),疑是加工过程中的辅料。
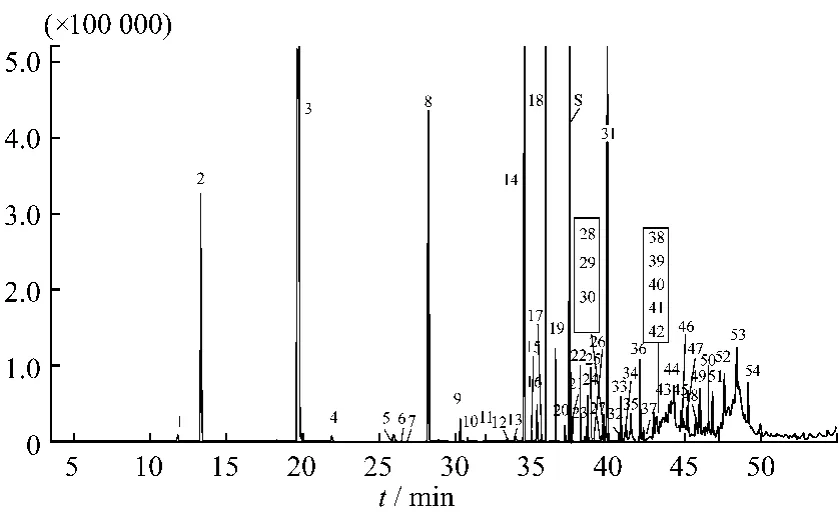
图2 双黄连注射液的总离子流色谱图Fig.2 TIC chromatogram of Shuanghuanglian Injection
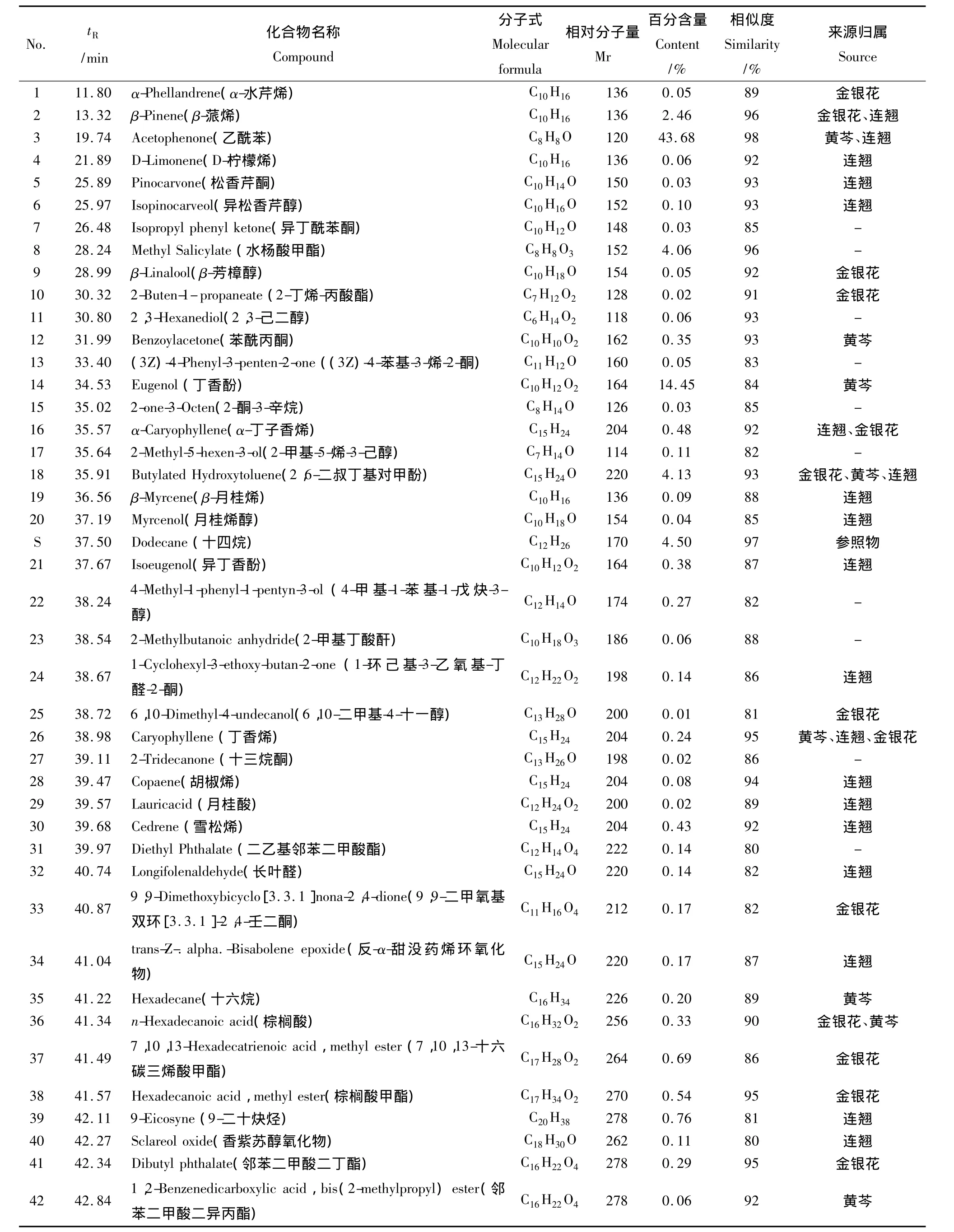
表3 双黄连注射液的化学成分及其相关性分析Table.3 Chemical components and their correlation analysis of Shuanghuanglian Injection

续表3
3 结论
利用中药指纹图谱相似度评价软件,以10批次双黄连注射液的指纹图谱综合平均生成的标准对照谱图作为模板,计算了10批次样品的相似度。研究结果表明:相似度在0.87~0.99,均大于0.85,说明该厂家不同批次双黄连注射液的质量基本稳定。但是不同的批号在含量上存在着一定差异,提示生产工艺或所用原料存在来源不稳定问题,中药必须在固定原药材产地及提取工艺的前提下,才能保证中药注射液的质量稳定可控。标准对照指纹图谱的生成以及相似度评价使结果具有客观性,避免了人为的误差,从总体上较全面反映该制剂中挥发性成分的信息;结合各色谱峰的定性和相关性分析的结果可为双黄连注射液的严格质量控制和进一步研发提供依据。
[1]袁宏伟.双黄连注射液的药理作用及临床新用途[J].现代医药卫生,2007,23(16):2505-2506.
[2]张 洁.双黄连粉针剂指纹图谱中特征色谱峰的组成药味归属及定性[J].中成药,2005,27(12):1365-1369.
[3]马百平.双黄连粉针剂高效液相指纹图谱的建立及应用[J].中成药,2006,28(2):157-161.
[4]罗奇志.双黄连粉针中化学成分的高效液相色谱-电喷雾串级质谱分析[J].中成药,2009,31(9):1402-1404.
[5]李 方.注射用双黄连(冻干)指纹图谱的建立及其在质量控制中的应用[J].中成药,2007,29(8):1196-1198.
[6]刘 琳.高效液相色谱-二极管阵列检测-电化学检测联用技术同时测定三精双黄连口服液中的4种化合物[J].色谱,2006,24(3):247-250.
[7]孙 妍.石墨炉原子吸收分光光度法检测双黄连注射液中镉元素的含量[J].黑龙江医药,2009,22(2):112-113.
[8]林 林.石墨炉原子吸收分光光度法检测双黄连注射液中铅元素的含量[J].黑龙江医药,2009,22(2):114-115.
[9]马满玲.双黄连注射液的稳定性实验[J].中医药学报,1992,(2):50-51.
[10]国家药品监督管理局.中药注射剂指纹图谱研究的技术要求[J].中成药,2000,22(10):671-675.
[11]中国药典,[S].一部.2005:附录XD.
[12]李浩春.分析化学手册第五分册[M].第2版,北京:化学工业出版社,1999:356-690.
[13]杨得坡.中药黄芩挥发性化学成分的研究[J].中药新药与临床药理,1999,10(4):234-236.
[14]梁 倩.金银花挥发油GC指纹图谱研究[J].中国中药杂志,2007,35(28):2359-2361.
[15]孔 杰.连翘挥发油化学成分的研究[J].西北师范大学学报(自然科学版),2001,37(4):77-81.

