苏丹红Ñ对大鼠肝损伤及CYP 1A 1表达的影响
严玉霖,高 洪,孙文汇,高利波,赵 汝
(云南农业大学动物科学技术学院,云南昆明 650201)
苏丹红Ñ对大鼠肝损伤及CYP 1A 1表达的影响
严玉霖,高 洪*,孙文汇,高利波,赵 汝
(云南农业大学动物科学技术学院,云南昆明 650201)
为探讨苏丹红Ñ(SudanÑ)对大鼠肝脏损伤及细胞色素CYP 1A 1表达的影响,将实验动物随机分为两组:对照组(C组)和 SudanÑ处理组,其中 SudanÑ处理组分为 4个剂量处理组:Ñ组(265 mg/kg)、Ò组(530 mg/kg)、Ó组(795mg/kg)和Ô组(975mg/kg),连续饲喂10天后采集肝脏作为检测样本。常规病理组织学及超微结构观察SudanÑ对肝细胞的损伤情况,运用免疫组化技术研究SudanÑ对CYP 1A 1表达的影响。组织病理学观察发现,SudanÑ处理组肝细胞发生脂肪变性,超微结构变化为肝细胞胞浆内有脂肪滴,免疫组化试验结果显示:SudanÑ处理组肝脏CYP 1A 1基因表达蛋白的积分光密度极显著高于C组(P<0.01),且在一定剂量范围内呈上升趋势。结果表明,SudanÑ能够上调CYP 1A 1基因的表达,从而发挥各种毒性效应,最终导致肝脏损伤。
苏丹红Ñ;肝损伤;细胞色素CYP 1A 1
近年来食品中的苏丹红事件层出不穷,给食品安全带来了新的隐患。2003年5月,法国首先发现了从印度进口的红辣椒粉制品中含苏丹红Ñ(Sudan Ñ),2005年2月,英国食品标准署(Food StandardAgency,FSA)在其网站上分布了30家企业生产的可能含有致癌物质苏丹红色素的359个品牌的食品,向消费者发出警告,引发了全球的/苏丹红0风暴。随后中国政府也对苏丹红下达了追杀令,亨氏、肯德基等知名跨的国公司相继被查出在所生产的食品中含有SudanÑ,同时在辣椒调味品、鸡蛋及唇膏等产品中发现SudanÑ[123]。SudanÑ是一类人工合成的亲脂性偶氮化合物,常作为一种工业原料被广泛用于如溶剂、油脂、蜡、汽油的增色及鞋、地板等增光方面,1896年科学家达迪将其命名为苏丹红并沿用至今。SudanÑ在世界许多国家都被明令禁止用于食品生产中,但由于其具有良好的光泽持久性与稳定性,被丧失良知的不法商贩用于改善食品的感官色泽,因此食品中的SudanÑ给人类健康构成了潜在的严重威胁。
肝脏是机体内最重要的解毒器官,已有研究证实肝脏是SudanÑ产生作用的主要靶器官,SudanÑ能够引起小鼠、大鼠、家兔的肝脏产生肿瘤[4]。进入体内的SudanÑ主要通过胃肠道微生物还原酶、肝和肝外组织微粒体和细胞质的细胞色素还原酶系(如细胞色素P450)和过氧化氢2过氧化物酶体系进行代谢[4,5]。人和鼠的CYP 1A 1是细胞色素P450基因组中研究较为清楚的两个功能基因,研究表明CYP 1A 1基因编码P450蛋白酶,此酶能催化药物的代谢以及胆固醇、类固醇和某些脂类的合成,同时也是某些毒素物质的主要代谢酶[6],因此研究Su2 danÑ进入机体后对肝损伤和CYP 1A 1基因表达的影响对阐明SudanÑ的毒性机理具有重要意义。
本研究采用SudanÑ处理大鼠建立苏丹红中毒模型,通过病理组织切片,电子显微技术及免疫组织化学(Imm unohistochem istry,IHC)技术分析Sudan Ñ对的大鼠肝脏组织的病理损伤、肝细胞超微结构的损伤及肝细胞中CYP 1A 1基因表达的变化,探讨SudanÑ的毒性和致病机理,从比较医学角度为Su2 danÑ对人类健康可能造成的影响提供理论依据。
1 材料与方法
1.1 主要试剂
SudanÑ为国药集团化学试剂有限公司产品;焦炭酸二乙酯(diethy lprocarbonate,DEPC)为美国Sigma公司产品;CYP 1A 1多克隆抗体由上海晶天生物科技有限公司提供;APES为美国Sigma公司产品;所用无水乙醇、二甲苯、甲醛、多聚甲醛、戊二醛、苏木精、曙红Y、中性树胶等试剂,均为市售分析纯。
1.2 实验动物的分组与处理
30只清洁级SD大鼠(由昆明医学院实验动物科提供),体重140~160 g/只,雌雄不拘。临床检查确认健康后,单笼、颗粒饲料预饲养3 d,自由饮水,编号并随机分为对照组(C组,n=6@1)和SudanÑ处理组(n=6@4)。将SudanÑ与饲料按一定比例充分混匀配制成颗粒饲料,分别以四个剂量饲喂SudanÑ 处理组:Ñ组(265 mg/kg)、Ò组(530mg/kg)、Ó 组(795 mg/kg)和 Ô 组(975 mg/kg)。另设空白对照组饲以普通颗粒饲料,连续饲喂10 d。
1.3 肝脏常规病理组织切片的制备及观察
肝脏组织切成4 mm厚薄,在100 m L/L中性甲醛固定液中固定48 h以上,依次进行梯度乙醇脱水、二甲苯透明、浸蜡、石蜡包埋。包埋好的肝脏组织蜡块用切片机切成4 L m的切片,贴在干净载玻片上,37 e温箱烤干,依次经二甲苯脱蜡、梯度乙醇复水,HE染色,采用改良的H arris苏木素与沉淀酸化伊红Y乙醇液染色,中性树胶封片,在光镜下观察肝脏组织变化的性质和程度。
1.4 肝组织超微切片的制备及观察
大鼠处死后,迅速取肝切成1 mm3的肝组织5块,于4 e预冷的3.5%戊二醛固定液中预固定,4 e保存。随即选取承固定的组织1块,漂洗后用10 m L/L饿酸后固定。丙酮逐级梯度脱水,环氧树脂812浸透、包埋,半薄切片、光镜定位、修快,Lei2 ca2V型超薄切片机切片,柠檬酸铅2醋酸铀双重染色,在JEM21011型透射电镜下系统观察肝细胞的形态变化性质和程度。
1.5 肝组织中CYP 1A 1基因表达的检测
采用SABC法检测肝脏中CYP 1A 1的表达[728]:常规病理组织切片经过灭活内源性酶和热修复抗原后,用50 g/L BSA封闭,滴加适当浓度的CYP 1A1一抗37e,再滴加生物素化山羊抗小鼠IgG,最后滴加试剂SABC。使用DAB显色试剂盒进行显色,加试剂盒中的A,B,C试剂各1滴,蒸馏水洗涤,苏木精复染,10m L/L盐酸酒精分化,水法返蓝,梯度乙醇脱水,二甲苯透明,中性树胶封片。取正常对照组肝脏,自身对照染色步骤同上。镜检免疫组化染色切片,阳性反应信号呈棕褐色或棕黄色着染,细胞核呈浅蓝色。每个样品随机选取5个视野,40倍物镜下观察免疫组化阳性物的分布,使用Image2Pro Plus 5.1测定以上样品阳性物质所占积分光密度,并利用SPSS软件进行均数运算和方差分析,分析试验组和对照组数据之间的差异显著性。
1.6 统计分析
所有实验数据采用SPSS 13.0进行统计分析,各组数据以平均值( X)?标准差(SD)表示,组间差异采取显著性t检验分析。
2 结果
2.1 肝脏病理组织学变化
对照组大鼠肝脏未见异常(图1A)。随着Su2 danÑ添加剂量的增加,肝脏组织脂肪变性的程度也随之恶化。Ñ组大鼠肝细胞胞浆内出现单个的空泡(脂肪滴);Ò组大鼠肝细胞胞浆内出现大小不等的脂肪滴;Ó组大鼠肝细胞胞浆内的小脂肪滴逐渐融合成大的脂肪滴,且数量较Ñ组明显增多(图1B),Ô组大鼠肝细胞胞浆内脂肪滴的体积较Ó组增大,数量增多。
2.2 肝细胞超微结构变化
对照组大鼠肝脏超微结构未见异常变化(图1D),SudanÑ作用组大鼠可见明显的超微结构病理变化(图4),表现为细胞出现大小不等脂肪滴,散在或积聚于细胞浆中,周围细胞器被挤压或变形。

图1 肝脏Fig.1 Liver
2.3 肝脏组织CYP 1A 1基因表达的免疫组化结果
肝脏组织中CYP 1A 1基因表达的免疫组织化学结果见图2。

图2 肝脏CYP 1A 1的表达(400@)Fig.2 The ex pression of CYP 1A 1 in liver(400@)
肝细胞胞浆出现的棕色阳性物质较Ò组明显增多,并且出现大小不等的脂肪颗粒
从图2B可以看出,Ó组肝细胞胞浆内 CYP 1A 1基因的表达水平较对照组明显增多。
肝脏CYP 1A 1基因表达蛋白的积分光密度见表1和图3。
从表1和图3中可以看出,Ñ、Ò、Ó和Ô组CYP 1A 1蛋白的积分光密度在一定剂量范围内呈增长的趋势,极显著高于对照组(P<0.01)。
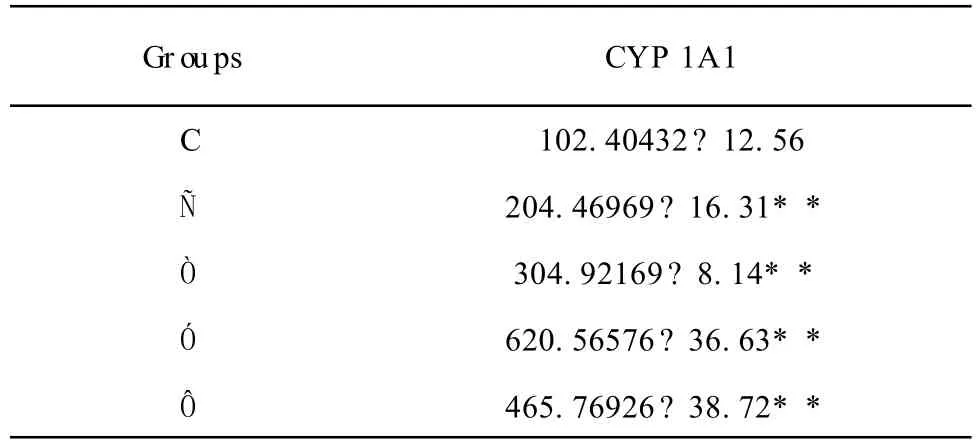
表1 肝脏CYP 1A 1的积分光密度Table1 The IOD of CYP 1A 1 in liver
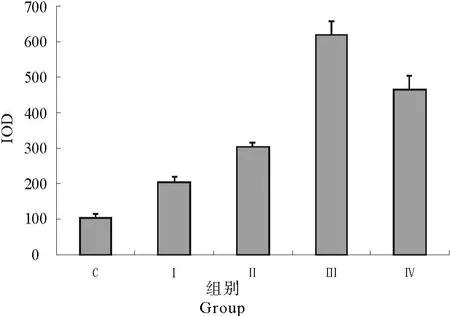
图3 肝脏CYP 1A 1的积分光密度Fig.3 The IOD of CYP 1A 1 in liver
3 讨论
整个试验期间,对照组大鼠未见异常变化,毛富有光泽,食欲旺盛,精神活泼。SudanÑ处理组大鼠,初期精神萎靡,食欲下降,几天之内便出现严重的体重下降,并伴随有肌肉和脂肪组织的急剧减少,随着剂量升高,后期出现精神亢奋。剖检发现对照组大鼠肝脏未见异常;Ñ组大鼠剖检肝脏未见明显异常变化,随SudanÑ剂量增加,大鼠肝脏肿大,质地脆软,色泽淡黄,切面结构模糊,有油腻感。肝脏是机体内SudanÑ作用最主要的靶器官之一,肝脏的病理组织切片结果表明,对照组大鼠肝脏未见异常(图1);Ñ组大鼠肝细胞胞浆内出现单个的脂肪滴;Ò组大鼠肝细胞胞浆内出现大小不等的脂肪滴,且数量较Ñ组增多;Ó组大鼠肝细胞胞浆内的小脂肪滴逐渐融合成大的脂肪滴(图2),Ô组大鼠肝细胞胞浆内脂肪滴的体积较Ó组增大,数量增多。对肝组织超微结构观察的结果表明,对照组大鼠肝脏超微结构未见异常变化(图3),SudanÑ处理组大鼠可见明显的超微结构病理变化(图4),表现为细胞出现大小不等脂肪滴,散在或积聚于细胞浆中,周围细胞器被挤压或变形。表明SudanÑ在早期主要对肝脏造成脂肪变性的组织细胞损伤,随着病程的发展,可能进一步形成肝硬化或肝癌。
本研究免疫组化的结果显示,在对照组和SudanÑ处理组(Ñ、Ò、Ó和Ô组)肝脏均有CYP 1A 1基因的表达,积分光密度分别是 102.404 32、204.469 69、304.921 69、620.565 76、465.769 26,说明 SudanÑ处理组肝脏CYP 1A 1基因的表达量均明显高于对照组(P﹤0.01),在一定剂量范围内随着SudanÑ剂量的增加而增加。这一结果说明SudanÑ能够显著上调 CYP 1A 1基因的表达。CYP 1A 1基因编码CYP 450蛋白酶,此酶能催化药物的代谢以及胆固醇、类固醇和某些脂类的合成。该基因的表达被某些多环芳香碳氢化合物诱导活化,继而将其代谢成有毒的中间物[5,9]。CYP 1A 1被证实在SudanÑ的代谢过程中起到至关重要的作用,能将SudanÑ代谢为活性物质,进而与DNA发生加合反应,形成DNA加合物,导致基因毒性[10211]。同时,SudanÑ在体内的代谢产物苯胺也能够损害肝脏,引起中毒性肝病,还有可能诱发肝脏细胞基因发生变异[12]。
总之,SudanÑ能够引起肝脏组织细胞发生脂肪变性,为SudanÑ致肝脏损伤提供了形态学依据,同时SudanÑ能够显著上调大鼠肝脏CYP 1A 1基因的表达,从而促进SudanÑ在体内代谢成有毒物质,是导致SudanÑ致肝脏损伤的重要机制之一。
[1] 宋 雁.食品中苏丹红的危险性评估[J].国外医学:卫生学分册,2005,32(3):1292132.
[2] Ghanadzadeh A,Tajalli H,Zirack P,et al.On the photo2physi2 calbehavior and electro2optical effect of oxazine dyes in aniso2 tropic host[J].Spectrochim Acta A Mol Biomol Spectrosc,2004,60(12):292522932.
[3] 秦品章.从苏丹红事件剖析食品安全与卫生问题[J].中国预防医学杂志,2006,7(3):2332234.
[4] 秦 菲.食品中苏丹红的毒性及检测方法[J].北京联合大学学报,2008,22(2):50254.
[5] Stiborov M,Schm eiser H H,Frei E.Prostaglandin H syn2 thase2mediated oxidation and binding to DNA of a detoxication metabolite of carcinogenic SudanÑ 12(phenylazo)22,62 di2 hydroxynaphthalene[J].Cancer Letters,1999,146(1):53260.
[6] 胡晓露,马文丽,郑文岭.苏丹红I对人淋巴细胞基因表达谱的影响[J].医学分子生物学杂志,2006,3(4):2502254.
[7] 齐新永.免疫组化非特异性背景着色因素及其消除措施[J].动物医学进展,2006,27(12):1132114.
[8] 王 钰,张 健,汤显斌.免疫组化染色过程中组织脱片的处理方法[J].郧阳医学院学报,2007,26(6):376.
[9] An Y,Jiang L P,Cao J,et al.SudanÑindu ces genotox ic effects and oxidative DNA damage in H epG2 cells[J].M utation Re2 search,2007,627:1642170.
[10] Stegeman JJ,Smolow itz R M,H ahn M E.Immunoh istochem i2 cal localization of environm entally induced cytochrome P450 1A 1 in multiple organs of themarine teleost Stenotomus chry2 sops(Scup)[J].Toxicol Appl Pharm acol,1991,110(3):4862 504.
[11] Stiborov M,Mart nek V,Rydlov H,et al.Expression of cy2 tochrome P450 1A 1 and its contribution to oxidation of a po2 tential human carcinogen 12phenylazo222naphthol(SudanÑ)in hum an livers[J].Cancer Letters,2005,220:1452155.
The Effect of SudanÑon Liver In jury and Exp ressions of CYP 1A1 in Rats
YAN Yu2lin,GAO Hong,SUN Wen2hui,GAO Li2bo,ZHAO Ru
Collegeof Animal Science and Technology,Yunnan Ag ricu ltural University,K unm ing,Yunan,650201,China)
In order to exp lore the effect of SudanÑon liver injury and expressionsof CYP 1A 1 in rats,ex2 perimental animals were random ly divided into two groups:control group(C group),SudanÑtreatment group(Ñ,Ò,Óand Ô groups).A ll ratswere killed and their livers were collected to be detec ted after ten days.Compared w ith contralgroup,the tissue structure of livers in SudanÑtreatment groups appeared fatty degeneration.M eanwhile the u ltrastructural changes weremarked by the fat d rops in liver cell cyto2 p lasm.The result of IHC exam ination show ed that IOD of CYP 1A 1 protein increased markedly(P<0.01)in livers in SudanÑtreatment groups and showed uptrend in certain dose range.The results indicated that SudanÑcan up2regulate the expressions of CYP 1A 1 and educe various kinds of poisoning effects.Fi2 nally,SudanÑcan lead to liver injury.
SudanÑ;liver in jury;CYP450
S852.3
A
100725038(2010)0420031205
2010203226
严玉霖(1979-),男,四川省攀枝花市人,讲师,博士,主要从事动物病理学研究。*通讯作者

