伽马射线对沙林模拟物O,O’-二甲基甲基膦酸酯的辐射降解作用
郁卫飞,张 勇,胡思得,孙 颖,李海波,李晓燕
1.中国工程物理研究院 化工材料研究所,四川 绵阳 621900;2.中国工程物理研究院,四川 绵阳 621900;3.中国工程物理研究院 核物理与化学研究所,四川 绵阳 621900
甲基氟膦酸异丙醇酯 (沙林)是一种毒性很强,与塔崩、梭曼和维埃克斯等同类的神经毒剂。人类若吸入或经由皮肤和眼睛以及肠胃等吸收后,它就会抑制神经系统内的乙酰胆碱酯酶的活性造成乙酰胆碱大量蓄积,而一旦致毒,就会给人留下长期的后遗症[1-3]。1995年,日本东京地铁的沙林毒气事件造成了大量平民伤亡。
针对沙林等生化武器毒剂的危害,世界各国均在毒剂的有效监控、销毁、预防和中毒治疗等相关领域开展了系统研究。这些研究对于降低毒剂对人类的风险和危害等方面具有重要意义,但尚不能彻底阻止生化攻击事件的发生,能够直接针对敌方生化武器储存库和武器库、在毒剂发挥作用之前将其摧毁的有效技术,即反生化武器的技术,就成为研究人员的追求目标。人们先后研究了超临界水、催化、脉冲光解和脉冲微波等原理的反毒剂技术。它们虽各有特点,但多以单一物理或化学作用为基础,难以广谱地面对种类和机理繁多的生化武器毒剂。20世纪90年代,美国提出用高温、高压、强辐射等效应综合地降解、破坏生化毒剂的设想,从原理上具备了广谱清除生化武器毒剂的技术可行性,并启动了粒子物理相关的概念研究[4-6]。此项研究在“9·11”以后作为单设专项列入美国政府国防预算,但目前未见其实验进展报道。
本工作拟选择O,O’-二甲基甲基膦酸酯(DMMP)作为沙林模拟物,开展DMMP的伽马辐射降解研究,以期为多效应综合条件下的广谱降解作用研究积累基础数据。
1 实验部分
1.1 材料和仪器
选用中国工程物理研究院钴源辐照中心的Co-60源,其γ射线能量为1.17、1.33 MeV,半衰期为5.27年,采用单板源2 400 mm×1 800 mm排布形式,放射源活度为8.14×1015Bq。
沙林模拟物DMMP购自青岛联美化工有限公司,无色或淡黄色透明液体,w(P)=25.0%,w(H2O)≤0.1%,粘度(25 ℃)为17.5 mPa·s。
HP6890气相色谱仪,美国惠普公司,配DB-5ms弱极性色谱柱、FID氢火焰离子化检测器、HP7673自动进样器;MAT 95有机磁质谱仪,德国Finnigan公司,配EI电离方式,质量扫描范围1~3 500 aum。
1.2 实验步骤
定量称取沙林模拟物,封装入玻璃安瓿瓶。本实验中DMMP为液态,真空封装难度较大,但其在空气中极为稳定,因而直接在空气环境下封装入玻璃安瓿瓶。封好的样品按辐射剂量率分别约为40、60、77、98、115 Gy/min进行辐照;选取5个剂量,分别为100、200、500、1 000、2 000 kGy。采用质谱方法定性检测辐射样品中的各种组分。采用气相色谱配FID检测器,以膦酸三甲酯作内标、以原样为100%内标定量法测试辐射样品中残余模拟物的质量分数。优化分离条件:DB-5ms色谱柱,氮气作为载气、流速1.0 mL/min,进样口温度180 ℃,柱初温90 ℃,保温5 min,以20 ℃/min升至210 ℃,保持1 min,检测器温度190 ℃。
2 结果和讨论
2.1 沙林模拟物的选取
先对DMMP模拟沙林进行降解破坏实验的可行性进行考察。量子化学计算结果表明,沙林中特有的P—F键极难断裂,而其它键与DMMP大多类同;沙林和DMMP在分子破坏历程中具有相似的引发反应及起始断裂键。质谱解析和分解机理研究同样表明DMMP与沙林、梭曼具有相似的分解方式[7],且DMMP分解所需的引发能稍大于沙林,表明完全破坏DMMP所需的能量足以彻底地降解破坏沙林分子。
2.2 测试方法的改进与误差控制
DMMP原样从封装、辐射到测试,历经数月,期间影响测试结果准确性的因素也较多。为了获得较好的测试结果,需要有效地控制样品全过程中各个环节的误差。
2.2.1封装过程 DMMP装入安瓿瓶后,还需要对安瓿瓶进行封口。高温烧制封口有可能造成样品的损失。封口端毛细段积存着难以被完全淌洗出来的部分,也会造成一定损失。在待用样品中随机选取2个样品,测得样品中DMMP的质量分数分别为(99.48±0.05)%和(99.67±0.04)%,略低于原样的100%。表明封装和取样过程对样品造成0.33%~0.52%的微量损失,但该损失小于或接近气相色谱测试误差,可认为封装和取样过程对w(DMMP)测试无显著影响。
2.2.2测试方法的改进 测试仪器和过程对于得到准确的数据较为关键。参照气相色谱方法标准[8],采用氢火焰离子化检测器,严格控制氢气流速、载气流速、色谱柱响应性、气化室温度、检测器温度、标准样等色谱条件,对样品存放与测试细节进行了改进。经多轮预备性实验,结果表明,这些措施起到了明显作用,标准偏差逐轮降低;样品测试值的相对标准偏差在0.01%~0.40%,明显优于标准[8]中小于2%的要求。
2.2.3平行样考察 为了获取更为准确的实验数据,对每个数据点都排布了4个平行样。平行样在完全同等的条件下称取、封装、贮存、转运、辐射和测试。测试了五组不同辐射参数下的平行样品:1 000 kGy,约115 Gy/min;2 000 kGy,约115 Gy/min;100 kGy,约40 Gy/min;500 kGy,约60 Gy/min;2 000 kGy,约77 Gy/min。结果表明,平行样测试值之间相差0.08%~0.71%,平均相差0.31%。
2.2.4存放时间的考察 辐射样品存放时间的不同可能会对样品中的w(DMMP)产生影响,测定结果列入表1。从表1可知,不同存放时间得到的w(DMMP)相差达-1.8%~+2.9%,显著大于前文测得的平行样误差。一般而言,辐射聚合生成的大分子产物在密闭存放期间有可能解聚再次生成降解前的分子结构,下文GC-MS谱中大量存在晚于DMMP出峰的辐射产物,也印证了辐射样品中确实存在大分子聚合产物。同时,伽马辐射降解生成的亚稳态小分子在密闭存放期间也有可能诱发DMMP的继续降解。表1数据表明这两种情形均不能排除。
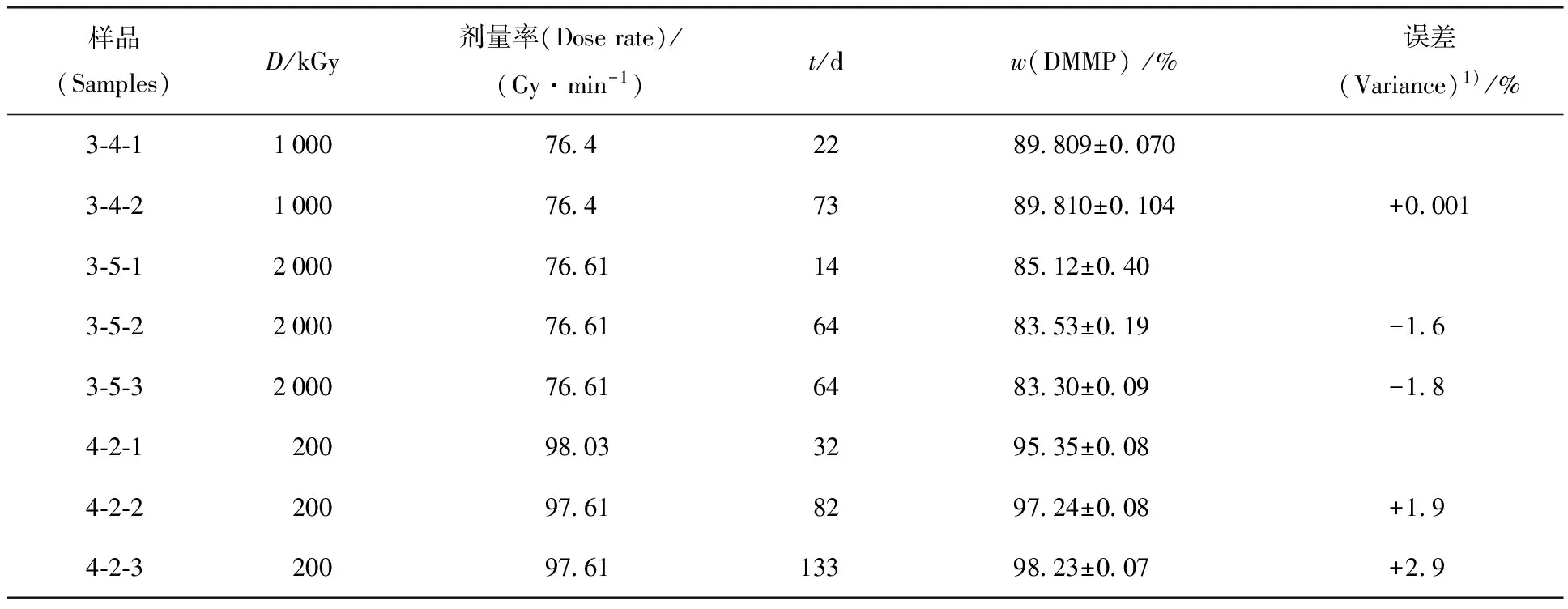
表1 存放时间对样品测试结果的影响Table 1 Effect of storage period on DMMP content
注(Note):1) 不同存放时间的测试结果与辐射后最快测试结果之间的差异(Variance ofw(DMMP) after storage period from data determined as soon)
2.3 辐射参数对降解作用的影响
不同辐射剂量率和剂量条件下所得辐射样品的DMMP残余量测定结果示于图1。从图1可知,DMMP的降解率整体不高,即使在剂量2 000 kGy、剂量率114.92 Gy/min的较高实验室辐射条件下,样品中DMMP残余仍高达83.76%,这与我们预期的单一物理或化学作用方式难以充分地降解DMMP相符,印证了强辐射与高温高压等效应协同效应具有技术必要性。由图1还可知,剂量越大,样品降解越多。这与通常的辐射降解实验一致。此外,图中500 kGy曲线和2 000 kGy曲线也显示出,剂量率增大有利于DMMP降解,但另外3条曲线中看不出这个变化趋势,推测认为,这种变化趋势与测试误差处于同一个量级,可能来自测试误差的影响,但目前也不能排除其它可能性。
2.4 降解产物与降解机理


图1 伽马辐射样品中残余DMMP的质量分数Fig.1 DMMP residue mass fraction after gamma irradiationD, kGy: 1——100, 2——200,3——500, 4——1 000, 5——2 000
射样中仍然存在高含量的DMMP,这与气相色谱测试结果一致;(2) 辐射样总离子流谱中出现了数个新峰,表明辐射样中出现了多种辐射产物,且辐射产物的峰强度随剂量率的增加而增加;(3) 多数产物的保留时间大于DMMP,表明辐射产物的沸点高于主成分DMMP,因此DMMP存在辐射聚合现象。

图2 DMMP原样及其辐射样的GC-MS总离子流谱Fig.2 Total ion chromatograms of original and irradiated DMMP samples 剂量率(Dose rate),Gy/min:(a)——0,(b)——97.06,(c)——112.03,(d)——128.09D=500 kGy
2.5 辐射化学产额
DMMP的伽马辐射降解过程属于自由基机理,其降解率主要与剂量相关,随剂量增加而增加,这些都与通常的辐射降解机制一致。若以辐射化学产额[9]G估算,5种剂量下的G依次为0.95、1.0、0.93、0.90、0.75 μmol/J。G随剂量增加而有所降低,这与低剂量下辐射时间较短、高剂量辐射实验时间较长相关联,表明G降低的原因有可能来自较长辐射时间下的逆反应加剧。
3 结 论
研究了伽马射线对沙林模拟物O,O’-二甲基甲基膦酸酯(DMMP)的辐射降解作用,结果如下:
(1) 封装和取样过程导致的样品损失较小,在色谱误差范围内;各个辐射样测试值的标准偏差在0.01%~0.40%;辐射样存放时间对样品的影响较大,不同存放时间样品中w(DMMP)的测定值相差-1.8%~+2.9%;
(2) 气相色谱测试表明,剂量是影响DMMP辐射降解的主要因素;辐射样中残余w(DMMP)随剂量的增加而明显降低,而随辐射剂量率的增加变化的趋势不显著;GC-MS分析表明,随着剂量率的增加,辐射样中生成了更多的辐射产物,辐射产物的峰强度增大,且多数辐射产物的保留时间大于DMMP;采用SPME/GC/MS等技术测出了辐射样品中含有二甲醚、甲醛、甲酸甲酯、丙酮、甲醇等小分子以及各种有机磷大分子,与自由基反应历程相符;
(3) 在剂量2 000 kGy、剂量率114.92 Gy/min的辐射条件下,样品中残余w(DMMP)=83.76%,分解率为16.24%,显示了单一的物理或化学作用方式难以充分地降解DMMP,也显示出多效应综合作用的必要性;
(4) 辐射化学产额G值随剂量增加而有所降低。
致谢:实验部分得到了中国工程物理研究院化工材料研究所和辐照中心的支持,黄辉、田勇、汤业朋、罗世凯等同志对本项目给予了帮助和支持,徐瑞娟、余昆、杨秀兰、逄小青、姜燕等参与了相关实验,在此谨致谢意。
[1] Abu-Qarel A W, Abou-Donia M B. Sarin Health Effects, Metabolism, and Methods of Analysis[J]. Food Chem Toxicol, 2002, 40: 1 327-1 333.
[2] Hartmann H M. Evaluation of Risk Assessment Guideline Levels for the Chemical Warfare Agents Mustard, GB, and VX1[J]. Regul Toxico Pharmacol, 2002, 35: 347-356.
[3] 陈久祯,王慧芳,李艳军,等.梭曼和沙林对电鳐电器官乙酰胆碱酯酶抑制作用动力学[J].中国生物化学与分子生物学报,1998,14(6):790-792.
[4] Kruger H, Mendelsohn E. Neutralization of Chemical Biological Ballistic Warheads by Low Yield Nuclear Interceptors, UCRL-1D-111403[R]. USA: NTIS, 1993.
[5] Hans Kruger. Defense Against Biological or Chemical Bomblet Warheads With Nuclear Interceptors, UCRL-1D-123815[R]. USA: NTIS, 1996.
[6] 张建宇.美国对除剂武器的研究[J].飞航导弹,2004,12:39-41.
[7] 郁卫飞,李海波,杨秀兰,等.沙林及其相关物的质谱解析和比较,GF-A0093558G[R].中国国防科学技术报告,2007.
[8] 项丰顺,卢彩虹,丛丽华,等.GJB4359 甲基膦酸二甲酯的测定 气相色谱法[S].国家军用标准,2002.
[9] 哈鸿飞,吴季兰.高分子辐射化学原理与应用[M].北京:北京大学出版社,2002:180-200.

