疫苗株病毒引起1例成人水痘的病原分离与鉴定
甘霖,王明丽,陈敬贤,2
1. 安徽医科大学微生物学教研室,合肥230032; 2. 美国哥伦比亚大学病理与细胞生物学系,纽约10032
水痘-带状疱疹病毒(varicella-zoster virus,VZV)属疱疹病毒α亚科,其原发感染为水痘,潜伏感染再激活时可引发带状疱疹。对于具有正常免疫能力的儿童,水痘是一种良性、自限性过程;但对于免疫功能低下者,水痘则是一种严重、甚至致命的疾病。接受肿瘤化疗、放疗的儿童感染水痘病毒后,约30%会产生进行性、全身性水痘,病死率为7%~28%[1]。孕妇若在分娩前5 d和产后48 h之间罹患水痘,可能引起围生期水痘,婴儿病死率高达30%[2]。成人罹患水痘并不常见,但发病时常伴比较严重的全身症状。
自从1995年美国食品与药品管理局(Food and Drug Administration,FDA)批准Oka水痘减毒活疫苗用于预防水痘以来,世界上多个国家相继开始使用该疫苗。我国从1998年开始引进该疫苗,用于12个月以上的VZV易感个体以预防水痘。目前我国市场上有4个厂家的疫苗,包括Merck公司的VariVax®、葛兰素史克公司的VarilRix®以及上海生物制品研究所和长春百克生物科技有限公司生产的冻干水痘减毒活疫苗。后2所厂家所使用的毒株均为日本Biken研究院的Oka减毒株。近年来,研究发现接种水痘疫苗后病毒可潜伏在接种者的感觉神经节中,并能被再次激活而引发带状疱疹[3,4],患者与易感个体接触后还可引起水痘[5,6]。因此在广泛使用减毒活疫苗的同时,有必要追踪水痘和带状疱疹病例中是否有疫苗株病毒感染致病的可能。
VZV只有1个血清型,基因组具有较好的稳定性,基因变异主要表现为单个核苷酸的变化。通过比对疫苗(v-Oka)与其亲本毒株(p-Oka)的全基因,发现42个核苷酸发生了突变,这些变异可以通过限制性片段长度多态性(restriction fragment length polymorphism,RFLP)和测序分析来检测。
本研究中,我们从水痘患者水疱液中分离到VZV,并对分离到的毒株开放读码框架(open reading frame,ORF)1、6、21、31、45、51和62进行测序分析,证实为疫苗株的VZV。
1 材料和方法
1.1 病例资料
患者为23岁女性,幼儿园教师,因患水痘于2008年4月前往安徽医科大学第一附属医院皮肤科就诊。体温37.8 ℃,次日其躯干出现50个以上散在分布的皮肤水疱疹,未出现并发症。患者及其父母均没有水痘史和疫苗接种史。发病17 d前,患者与其班级1名患带状疱疹的5岁男孩发生直接接触。回顾性调查显示,该男孩于2007年2月曾接种1人份某公司水痘疫苗,接种后接种部位皮肤出现1 cm左右的红斑,几天后消失。13个月后(2008年3月)男孩疫苗接种部位出现带状疱疹样的皮肤水疱疹。没有证据显示男孩和女教师有免疫缺陷。
1.2 细胞和病毒
人胚肺成纤维细胞(human embryonic lung fibroblast,HELF)为本室保存。日本Oka疫苗亲本株(p-Oka)和VZV美国野毒株(MLS)由美国哥伦比亚大学Anne A. Gershon教授惠赠;China-18和China-38为本室以前分离的VZV野毒株;VZV减毒活疫苗购自上海生物制品研究所(批号:2007120401)。
1.3 病毒分离与鉴定
病毒分离与鉴定参照文献进行[8]。在皮肤水疱疹出现3 d时,用1 ml注射器吸取皮肤水疱液,取10 μl接种至长成单层的HELF细胞,置5% CO2、37 ℃孵箱培养,每天观察细胞病变(cytopathic effect,CPE);待出现特征性CPE后,取少量细胞涂片,应用VZV糖蛋白gE单克隆抗体(Biodesign International®,Maine,USA),经间接免疫荧光染色予以鉴定。
1.4 血清中VZV特异性IgG检测
血清标本分别在第3和14天采集,并通过膜免疫荧光抗体(fluorescent antibody to membrane antigen,FAMA)法检测血清中VZV特异性IgG效价。方法和判断标准由美国哥伦比亚大学Anne A. Gershon教授提供[9]。
1.5 DNA提取和序列分析
用TaKaRa MiniBEST Viral RNA/DNA Extrac-tion Kit Ver.3.0试剂盒(大连宝生物工程有限公司)分别提取患者水疱液和体外培养HELF细胞中的病毒DNA。自患者水疱液提取的病毒DNA记为Vesicular DNA,自病变HELF细胞提取的病毒DNA记为Culture DNA。用同样方法从培养细胞中提取p-Oka、MLS、China-18、China-38的DNA和未感染VZV的HELF DNA(作为对照),上海生产的水痘疫苗DNA从未经分离培养的减毒活疫苗中直接提取。所有提取的DNA,经紫外分光光度法确定浓度后置-20 ℃保存。
采用文献[10]中的引物扩增VZV ORF 1、6、31、38、51、54和62,聚合酶链反应(polymerase chain reaction,PCR)产物经DNA凝胶回收试剂盒(大连宝生物工程有限公司)回收后,送上海英俊生物技术有限公司测序。测序结果用Mage 4.02软件进行比对分析。
2 结果
2.1 病毒分离与鉴定
单层HELF细胞在皮肤水疱液标本接种后第3天开始出现典型的局灶性CPE(图1 A),取少量呈现CPE的细胞涂片,固定后用VZV特异性gE抗体进行间接免疫荧光染色,阳性者呈现很强的胞质着色(图1 B)。
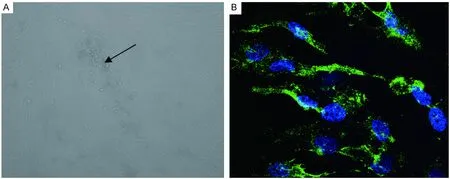
A: Focal cytopathic changes of VZV were observed 3 days following inoculation of virus into human embryonic fibroblasts (×100). B: Detection of VZV-specific antigens by indirect immunofluorescence using monoclonal antibodies against VZV glycoprotein E (×400). Nuclei staining by DAPI (blue). VZV gE detected by FITC-conjugated secondary antibody (green).
图1病毒分离和间接免疫荧光鉴定结果
Fig.1Theresultsofvirusisolationandindirectimmunofluorescence
2.2 血清中VZV特异性IgG效价
FAMA实验结果显示,第3天患者血清中VZV特异性IgG效价为1∶4,第14天上升至1∶128,升高4倍以上。
2.3 序列分析
测序结果经Mage 4.02软件比对发现,直接从患者皮肤水疱液标本获得的病毒DNA与从分离培养获得的病毒DNA序列完全一致,且不同于野毒株,而与Oka疫苗株的单核苷酸多态性(single nucleotide polymorphism,SNP)位点相同(图2)。核苷酸位置参照VZV Dumas株(GenBank 登录号:X04370),vOka为日本Biken研究院疫苗株的VZV(GenBank登录号:AB097932),VariVax为Merck公司生产的水痘疫苗(GenBank登录号:DQ008355),VarilRix为葛兰素史克公司生产的水痘疫苗(GenBank登录号:DQ008354)。
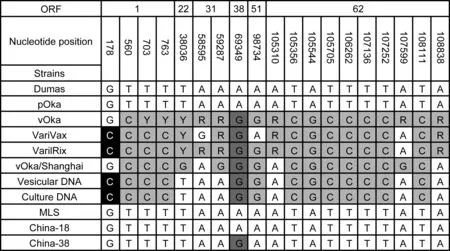
R, allelic mix (purine); Y, allelic mix (purimidine); vOka/Shanghai, vaccine manufactured in Shanghai.
图2测序后对疫苗相关单核苷酸多态性位点的比对分析
Fig.2Vaccinestrain-associatedsinglenucleotidepolymorphismsoftheisolatedviruses:analysisbetweenwildtypestrainsandvaccinestrains
3 讨论
水痘疫苗是通过减毒作用获得的,尽管迄今对Oka疫苗减毒的分子机制尚未阐明,但比对v-Oka与p-Oka的全基因,发现42个核苷酸发生突变,其中超过1/3(15/42)的突变发生在ORF 62中[7]。另外,通过减毒作用的疫苗株病毒并不是单个克隆,而是由多株基因差别很小的病毒形成的混合物,这使得不同厂家生产的疫苗基因也存在差异,但是它们预防水痘的效果并没有明显不同[7]。正是不同疫苗基因之间存在差异,使得我们更容易追踪病毒的来源及研究疫苗的应用是否对VZV的分子流行病学特征产生影响。
疫苗株VZV引起疾病并不罕见,但主要是以接种者出现带状疱疹为主,且症状均较轻[3-6]。疫苗株病毒传播到易感个体所引起水痘的病例较为罕见[11-13]。目前报道的病例具有共同的特征:①在家庭成员之间传播,如子女接种疫苗后,会使对VZV没有免疫力的父母罹患水痘;②儿童接种疫苗通常会在接种部位出现水疱或红斑等皮肤反应;③被传染者的水痘症状较轻。
当确认分离到的毒株为疫苗株后,我们对患者病史进行了调查。该患者曾与接种过某公司水痘疫苗后发生带状疱疹的男孩直接接触,从患者分离到的VZV在基因特征上更接近于该公司水痘疫苗,提示这可能是水痘疫苗发生二次传播(secondary transmission)的病例。与国外相关报道不同的是,本研究中二次传播发生在公共场所,而不是在家庭内部。
本研究提示,水痘疫苗株病毒二次传播不仅存在于家庭成员之间,还可出现在其他人员密切接触的地方,如学校等。因而有必要检测学校、医院等机构刚成年的工作人员是否对VZV有免疫力,对易感个体应尽早接种疫苗,以防成人水痘的发生。
[1] Feldman S, Lott L. Varicella in children with cancer: impact of antiviral therapy and prophylaxis [J]. Pediatrics, 1987, 80(4): 465-472.
[2] Enders G, Miller E, Cradock-Watson J, Bolley I, Ridehalgh M. Consequences of varicella and herpes zoster in pregnancy prospective study of 1 739 cases [J]. Lancet, 1994, 343(8912): 1548-1551.
[3] Uebe B, Sauerbrei A, Burdach S, Horneff G. Herpes zoster by reactivated vaccine varicella-zoster virus in a healthy child [J]. Eur J Pediatr, 2002, 161(8): 442-444.
[4] Hambleton S, Steinberg SP, Larussa PS, Shapiro ED, Gershon AA. Risk of herpes zoster in adults immunized with varicella vaccine [J]. J Infect Dis, 2008, 197(Suppl 2): S196- S199.
[5] Chaves SS, Haber P, Walton K, Wise RP, Izurieta HS, Schmid DS, Seward JF. Safety of varicella vaccine after licensure in the United States: Experience from reports to the vaccine adverse event reporting system, 1995-2005 [J]. J Infect Dis, 2008, 197(Suppl 2): S170-S177.
[6] Galea SA, Sweet A, Beninger P, Steinberg SP, Larussa PS, Gershon AA, Sharrar RG. The safety profile of varicella vaccine: a 10-year review [J]. J Infect Dis, 2008, 197(Suppl 2): S165-S169.
[7] Gomi Y, Sunamachi H, Mori Y, Nagaike K, Takahashi M, Yamanishi K. Comparison of the complete DNA sequences of the Oka varicella vaccine and its parental virus [J]. J Virol, 2002, 76(22): 11447-11459.
[8] 陈敬贤.诊断病毒学[M].人民卫生出版社,2008,244-251.
[9] Gershon A, Chen J, LaRussa P, Steinberg S. Manual of Clinical Microbiology [M]. 9th ed. Washington, DC: ASM Press, 2007.
[10] Wagenaar TR, Grose C, Loparev VN, Schmid DS, Breuer J. Genomic analysis of varicella-zoster virus: primers for individual open reading frames [J]. J Clin Virol, 2003, 28(1): 104-110.
[11] Grossberg R, Harpaz R, Rubtcova E, Loparev V, Seward JF, Schmid DS. Secondary transmission of varicella vaccine virus in a chronic care facility for children [J]. J Pediatr, 2006, 148(6): 842-844.
[12] Salzman MB, Sharrar RG, Steinberg S, LaRussa P. Transmission of varicella-vaccine from a healthy 12-month-old to his pregnant mother [J]. J Pediatr, 1997, 131(1 Pt 1): 151-154.
[13] Brunell P, Argaw T. Chickenpox attributable to a vaccine virus contracted from a vaccinee with zoster [J]. Pediatrics, 2000, 106(2): E28.

